Содержание статьи
Гиперлипидемии при хронической болезни почек: особенности и подходы к лечению
И. Б. Колина, кандидат медицинских наук
НИИ уронефрологии и репродуктивного здоровья человека, ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития РФ, Москва
Гиперлипидемия является частым спутником заболеваний почек, в некоторых случаях даже отражающим степень активности почечного процесса. К сожалению, практически всегда наличие нарушений липидного обмена у почечного больного ухудшает прогноз как за счет ускорения нефросклероза, так и за счет ускорения атеросклероза и развития сердечно-сосудистых осложнений. «Нефротоксическое» действие липидов широко исследуется с 1982 г., когда J. Moorhead была предложена теория о повреждающем действии гиперлипидемии на эндотелий капилляров клубочков. С тех пор стало ясно, что мезангиальные клетки, имеющие рецепторы к липопротеинам низкой плотности (ЛПНП), связывают и окисляют их, это запускает каскад выработки цитокинов, стимулирующих пролиферацию мезангия и развитие гломерулосклероза. Параллельно снижается выработка защитных протеогликанов и коллагенолитических ферментов, регулирующих образование мезангиального матрикса, ослабляются фагоцитарные свойства мезангиоцитов, мезангий «перегружается» макромолекулами. Липопротеиды, отложившиеся в базальной мембране клеток, связывают отрицательно заряженные гликозаминогликаны и нейтрализуют ее отрицательный заряд, повышая проницаемость мембраны для белков. Помимо этого, фильтрующиеся в клубочках липопротеины, осаждаясь в канальцах почек, индуцируют и тубулоинтерстициальные процессы, склероз интерстиция и развитие почечной недостаточности. При избыточном накоплении крупных липидных включений мезангиальные клетки, макрофаги и эпителиальные клетки канальцев в интерстиции клетки приобретают вид «пенистых».
При диабетической нефропатии, в дополнение к вышесказанному, происходит связывание мезангиальными клетками гликозилированных ЛПНП, которые особенно подвержены перекисному окислению, и без того активированному при гипергликемии.
Предполагается, что окклюзия капилляров клубочков липидными депозитами и пенистыми клетками уменьшает клубочковую фильтрацию. Это в свою очередь приводит к повышению системного артериального давления и повышает внутриклубочковое давление в интактных нефронах и таким образом способствует гломерулосклерозу.
Считается, что наибольшее повреждение клубочков почек вызывает высокий уровень общего холестерина сыворотки (ОХС). Гиперхолестериновая диета у экспериментальных животных вызывает появление в клубочках липидных депозитов, моноцитарной инфильтрации и гиперклеточности мезангия, увеличение мезангиального матрикса. Параллельно росту уровня ОХС нарастает протеинурия и количество склерозированных клубочков.
Даже просто гиперхолестеринемия приводит не только к развитию протеинурии, уремии и гломерулосклероза, увеличению внутриклубочкового давления не только в эксперименте. Клиническими исследованиями показано, что гиперлипидемия при любых нефропатиях ускоряет прогрессирование почечной недостаточности, причем скорость прогрессирования зависит от уровня ОХС, триглицеридов (ТГ), липопротеидов очень низкой плотности (ЛПОНП), апоВ и липопротеидов высокой плотности (ЛПВП) сыворотки.
А. В. Смирновым (1997) [1], показано, что гиперлипопротеидемия, преимущественно IIб и IV типов, свойственна всем больным хроническим гломерулонефритом (ХГН), включая нетяжелые варианты, а ее выраженность зависит от клинического варианта заболевания, наличия нефротического синдрома (НС), хронической почечной недостаточности (ХПН) и артериальной гипертензии. Для нефротической гиперлипидемии характерно, прежде всего, значительное повышение уровня ОХС. При выраженном НС и длительном его персистировании повышается и уровень ТГ, ЛПНП, ЛПОНП при нормальном или несколько сниженном содержании липопротеидов высокой плотности (ЛПВП). Наблюдаются изменения субфракций ЛПВП, увеличивается уровень апоА1, снижается соотношение ОХС/апоА1 во всех субфракциях ЛПВП. По мере прогрессирования НС повышаются уровни фосфолипидов (ФЛ).
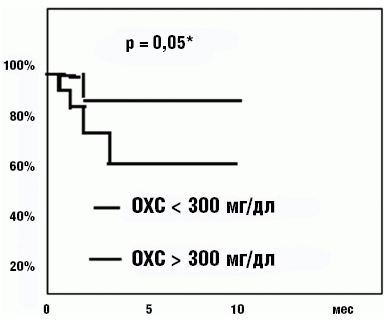
Рис. «Почечная» выживаемость больных с ХГН при различной степени гиперхолестеринемии к 12 мес персистирования НС
В нашем исследовании риск развития ХПН при нефротических вариантах ХГН, протекающих с наиболее выраженной гиперлипидемией, четко зависел от уровня ОХС: повышение ОХС в дебюте болезни более 300 мг/дл было достоверно связано со стойким повышением уровня креатинина ≥ 3 мг%. При анализе течения болезни у 165 больных ХГН с нефротическим синдромом мы выяснили, что выраженная гиперлипидемия, уже в дебюте нефротического синдрома отмечавшаяся у 95,3% больных, была тесно связана с его тяжестью. А при персистировании нефротического синдрома в течение 12 мес, высокая гиперхолестеринемия сопровождалась снижением 5-летней «почечной» выживаемости с 90% до 62% (рис.) [2, 3].
При развитии 3-й и выше стадий хронической болезни почек (ХБП) любой этиологии для липидных нарушений характерными становятся высокий уровень ТГ и низкий — ЛПВП за счет глубоких нарушений регуляции метаболизма (табл. 1).

Факторами, способствующими снижению уровня ЛПВП, являются уменьшение экспрессии генов апопротеина АпоА2 и хроническое воспаление, независимо от наличия нефротического синдрома приводящее к снижению уровня альбумина, транспортирующего свободный холестерин из периферических тканей к ЛПВП [4]. Повышение уровня ТГ может быть частично объяснено значительным увеличением в плазме АроС3, который является мощным ингибитором фермента липазы липопротеинов, отвечающей за деградацию частиц, богатых ТГ.
Ввиду выраженности липидных нарушений закономерным оказывается тот факт, что большинство пациентов с ХБП погибают от сердечно-сосудистых заболеваний (ССЗ) еще до развития терминальной почечной недостаточности и начала заместительной почечной терапии. Четкая самостоятельная связь между дислипидемией и повышением риска сердечно-сосудистых событий у пациентов с ХБП установлена многими исследованиями, несмотря на наличие у этих больных множества других факторов сердечно-сосудистого риска, включая увеличение окислительного стресса, воспаления, отсутствие физической активности, анемию, кальцификацию сосудов, эндотелиальную дисфункцию, а также снижение выработки оксида азота (табл. 2).
Развитие 5-й стадии ХБП и заместительная почечная терапия еще больше увеличивают заболеваемость и смертность от сердечно-сосудистых заболеваний. В частности, распространенность ишемической болезни сердца (ИБС) у пациентов на гемодиализе составляет 40%, а смертность от ССЗ до 30 раз выше, чем среди населения в целом, несмотря на стратификацию по полу, возрасту, расе и наличию сахарного диабета [5].
Способы коррекции липидных нарушений при ХБП
Необходимость коррекции липидных нарушений у больных с ХБП очевидна уже на ранних стадиях болезни. Гиполипидемическая терапия на сегодняшний день — важнейший элемент нефропротективной стратегии, призванной тормозить прогрессирование ХБП, предупреждая или надолго отодвигая развитие почечной недостаточности. Принципы диетической и лекарственной терапии являются общими для гиперлипидемий любой этиологии. В разных ситуациях используются и препараты, препятствующие всасыванию липидов в кишечнике, — секвестранты желчных кислот (анионообменные смолы — холестирамин, колестипол; неспецифические энтеросорбенты, специфические энтеросорбенты холестерина), и препараты, усиливающие катаболизм ТГ, — фибраты (клофибрат, безафибрат, гемфиброзил, ципрофибрат, фенофибрат), и препараты, снижающие выработку ЛПНП и ЛПОНП, — производные никотиновой кислоты (никофураноза, аципимокс, Эндурацин), и препараты на основе омега-3-полиненасыщенных жирных кислот (Омакор, Омеганол, рыбий жир, Максепа, Эйконол, Полиен и т. п.). Актуальна и комбинированная терапия с использованием препаратов разных групп. Однако при комбинированной терапии, при всей ее актуальности, приходится учитывать почечный метаболизм фибратов и необходимость корректировки дозы и очень тщательного мониторинга в связи с повышенным риском развития рабдомиолиза, о чем подробно будет рассказано ниже. Помимо лекарственной терапии, для коррекции гиперлипидемии в труднокурабельных случаях применяют экстракорпоральное удаление липопротеинов, но описание этих методов не входит в задачи данного обзора.
Краеугольным же камнем терапии дислипидемии при ХБП являются конкурентные ингибиторы ГМГ-КоА-редуктазы — фермента, катализирующего трансформацию ГМГ-КоА в мевалоновую кислоту на начальных этапах синтеза холестерина в клетках печени, — статины. Эти препараты не только способствуют нормализации липидного спектра и тем самым препятствуют развитию атеросклероза, но и, уменьшая накопление липидов в почках, угнетают пролиферацию мезангиальных клеток и развитие гломерулосклероза.
Сопоставление течения нефрита в группах больных нашей клиники, получавших терапию ренопротективными препаратами, включая статины, с естественным течением заболевания, прослеженным катамнестически, выявило более быстрое прогрессирование почечного процесса в контрольной группе (нарастание протеинурии, уровня креатинина сыворотки крови) по сравнению с группой, получавшей статины [3].
Нефропротективное действие статинов связано помимо основного, гиполипидемического, действия с рядом плейотропных свойств, спектр которых расширяется по мере их изучения. Описано их положительное влияние на функцию эндотелия, сосудорасширяющее, антиишемическое и антитромбогенное действие, противовоспалительные и иммуносупрессивные свойства. Статины предотвращают развитие гипертрофии левого желудочка сердца, обладают антиаритмическими свойствами. Высокая кардиопротективная эффективность статинов доказана при проведении первичной (исследования WOSCOPS, APCAPS) и вторичной (4S, CARE и пр.) профилактики ишемической болезни сердца в аспекте снижения частоты сердечно-сосудистых осложнений, общей и коронарной смертности.
Данные исследований, проведенных на популяциях больных ХБП, не столь однозначны. В частности, исследование 4D, являющееся на сегодняшний день единственным проспективным рандомизированным клиническим исследованием (РКИ) использования статинов (аторвастатин) у больных диабетической нефропаией, получающих гемодиализ в течение 4 лет, сообщало о плохом прогностическом значении низкого уровня ОХС (табл. 3). Было продемонстрировано незначительное снижение относительного риска на комбинированной первичной конечной точке сердечной смерти, нефатального инфаркта миокарда (ИМ) или инсульта, повышение риска смертельного инсульта, преобладание среди причин летальности внезапной сердечной смерти. Эксперты считают, что эти данные требуют дополнительных исследований с поправкой на воспалительный и питательный статус, а также свидетельствуют о том, что важным и немодифицируемым статинами фактором смертности диализных больных могут быть нарушения сердечного ритма [7, 8].
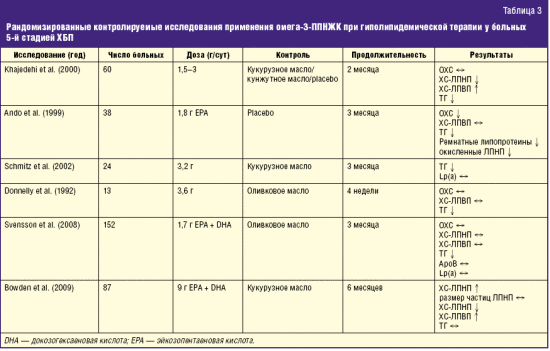
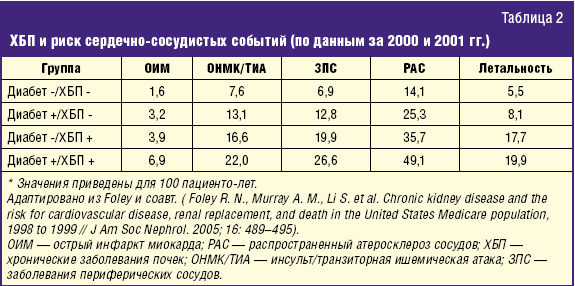
Попытки альтернативных методов коррекции дислипидемии и предупреждения развития сердечно-сосудистых осложнений у почечных больных предпринимались неоднократно, в частности с применением ПНЖК [9]. При хорошо изученной эффективности омега-3-ПНЖК в отношении предупреждения осложнений у кардиологических больных, в отношении предупреждения сердечно-сосудистых осложнений у больных с ХБП РКИ проведено относительно немного [10, 11]. Показано, что при всей выраженности как традиционных, так и специфических для диализных пациентов факторов сердечно-сосудистого риска, применение омега-3-ПНЖК приводит к достоверному улучшению липидного спектра у больных с 5-й стадией ХБП в основном за счет снижения гипертриглицеридемии и снижению частоты сердечно-сосудистых осложнений (табл. 3).
Исследование OPACH, проведенное у пациентов, получающих хронический гемодиализ, продемонстрировало уменьшение частоты сердечно-сосудистых событий, особенно внезапной смерти, даже без явного влияния на липидный спектр (табл. 4).
Помимо гиполипидемического действия изучены также и другие воздействия ПНЖК. В частности, они значимо снижают частоту тромбозов сосудистого доступа у диализных больных [12, 13]. Кроме того, большой интерес представляет влияние ПНЖК на состояние воспалительного статуса, в частности, за счет уменьшения образования лейкотриенов, играющих не последнюю роль в прогрессировании атеросклероза у этой категории больных. Также сообщается об улучшении состояния проводящей системы сердца и снижении частоты инфарктов на фоне 2-летнего применения ПНЖК [14]. В исследовании CARE прием правастатина 40 мг/с в течение примерно 5 лет приводил к снижению относительного риска и 4% ARR в первичной конечной точке (смерть от ишемической болезни или нефатального инфаркта миокарда) у пациентов с ХБП.
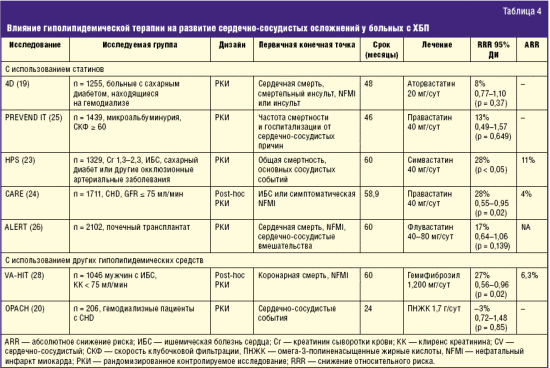
PREVEND IТ, в течение 4 лет исследовавшее (табл. 4) частоту сердечно-сосудистых событий в группах фозиноприла 20 мг/с или плацебо и правастатина 40 мг/с или плацебо, продемонстрировало 13% снижение в первичной конечной точке сердечно-сосудистой смертности и госпитализации по поводу сердечно-сосудистой заболеваемости в группе правастатина. Это исследование было ограничено необычайно малым количеством сердечно-сосудистых событий в исследуемых группах.
ALERT — рандомизированное двойное слепое плацебо-контролируемое исследование применения флувастатина 40–80 мг/сут у 2102 реципиентов почечного трансплантата (табл. 4). Продемонстрировано 17% снижение риска (р = 0,139) в комбинированной первичной конечной точке сердечно-сосудистых осложнений без увеличения потери трансплантата или почечной дисфункции. Последующий анализ с использованием сердечной смерти и нефатального ИМ в качестве первичной конечной точки продемонстрировал статистически значимое 35% снижение риска (р = 0,005).
В VA-HIT более 2500 мужчин с ИБС были включены и рандомизированы на гемфиброзил 1200 мг/сут или плацебо. Оно показало 27% снижение относительного риска и 6,3% ARR в отношении смертельных и несмертельных ИМ при приеме этого препарата (табл. 4).
Плейотропные эффекты, с которыми связывают большинство как нефро-, так и кардиопротективных эффектов статинов, предотвращают образование промежуточных продуктов биосинтеза ХС, т. н. изопренов — фарнезилпирофосфата и геранилгеранил пирофосфата, которые участвуют в посттрансляционной модификации ряда белков (G-белок, ядерные ламины, небольшие ГТФ-связывающие белки — Ras, Rho, Rab, Rac, Rap) — регуляторов пролиферации, дифференцировки, митогенеза, апоптоза различных клеток. Статины также ингибируют экспрессию антигенов класса II главного комплекса гистосовместимости на макрофагах и клетках сосудистой стенки [15, 16]. Кроме того, статины подавляют синтез важных «провоспалительных» цитокинов, таких как фактор некроза опухоли ФНО-альфа, интерлейкин ИЛ-6, ИЛ-1 и ИЛ-8 [17]. Имеются сообщения и о выраженном снижении уровней С-реактивного белка (СРБ) у больных с первичной гиперлипидемией при назначении аторвастатина [18], комбинации симвастатина и эзетимиба — препарата нового класса селективных ингибиторов абсорбции холестерина, одобренного в США Foоd and Drug Administration (FDA) [19, 20].
Безопасность гиполипидемической терапии при ХБП
Таким образом, статины обладают способностью оказывать влияние на широкий спектр потенциальных патогенетических механизмов не только при атеросклерозе, но и при ХБП и считаются препаратами выбора при гиперлипидемии у больных ХБП. Рекомендуемым K/DOQI guidelines уровнем ЛПОНП у этих пациентов является уровень менее 100 мг/дл (< 2,6 ммоль/л) [21]. Однако некоторые авторы с целью снижения риска ССО рекомендуют и более низкое — менее 70 мг/дл [22].

В клинической практике для этого используют несколько классов статинов (табл. 5 и 6). Статины первой генерации получены в процессе ферментации грибковых производных (ловастатин, симвастатин, правастатин), препараты второй (флювастатин), третьей (церивастатин, аторвастатин) и четвертой (розувастатин, питавастатин) генерации полностью синтетические. Все препараты катаболизируются в печени, хорошая переносимость больше свойственна природным производным (симвастатин, правастатин). Для большинства пациентов с заболеваниями почек 1–2 ХБП применение статинов достаточно безопасно, однако различия в фармакокинетических свойствах делают прием некоторых препаратов, особенно в высоких дозах, довольно рискованным. В частности, из-за опасности развития статининдуцированной миопатии и рабдомиолиза. Наиболее безопасны в этом отношении гидрофильные статины (правастатин и розувастатин), а также статины, не имеющие активных метаболитов (флувастатин, правастатин и питавастатин).

Побочные эффекты статинов:
- боли в животе, запоры, диарея (не требуют прекращения терапии);
- повышение уровня АСТ и АЛТ (если в 3 раза и более в двух последовательных анализах — лечение прекратить);
- миопатия (креатинфосфокиназа (КФК) > 5N — лечение прекратить);
- рабдомиолиз (КФК > 10N, лечение прекратить немедленно!).
Учитывая необходимость приема пациентами с ХБП большого количества препаратов, важную роль играют возможные лекарственные взаимодействия. Важное значение поэтому имеет фармакокинетика препарата. Так, для статинов, метаболизирующихся через систему цитохрома печени Р450 3А4 (CYP3A4) (симвастатин, ловастатин, аторвастатин), может быть опасен одновременный прием препаратов, которые подавляют CYP3A4 (ингибиторы протеазы, циклоспорин, амиодарон, фибраты). В результате повышается концентрация статина в крови и риск миопатии увеличивается. Флувастатин и розувастатин (метаболизируются CYP2C9) и правастатин (метаболизируется в почках) считаются более безопасными для пациентов, особенно принимающих несколько препаратов. Кроме того, фармакокинетика флувастатина не изменяется у пациентов на гемодиализе или на хроническом амбулаторном перитонеальном диализе.
Не так давно FDA США опубликовал дополнительное предупреждение о том, что симвастатин, ранее считавшийся одним из оптимальных препаратов для ведения больных с ХБП, противопоказан пациентам, получающим гемфиброзил, противогрибковые лекарства, включая итраконазол, кетоконазол, позаконазол; антибиотики, такие как эритромицин, кларитромицин, телитромицин; ингибиторы протеазы ВИЧ, нефазодон, циклоспорин, даназол. В 2010 г. тем же FDA опубликованы данные о большем риске развития симвастатининдуцированных миопатий у пациентов китайского происхождения и носителей полиморфизма гена SLCO1B1 эффектов. Кроме того, сообщалось, что при общей дозозависимости побочных эффектов статинов у женщин, пожилых пациентов, пациентов с осложненным семейным анамнезом и принимающих несколько лекарственных стредств и испытывающих экстремальные физические нагрузки риск миопатии увеличен.
Существуют и новые дополнительные ограничения в дозах для симвастатина:
- не более 20 мг для пациентов, принимающих амлодипин и ранолазин;
- не более 10 мг для пациентов, принимающих амиодарон, верапамил и дилтиазем.
Побочные эффекты со стороны мышц разной выраженности отмечают около 10% пациентов, принимавших статины. В числе предполагаемых механизмов статининдуцированных миопатий:
- снижение содержания холестерина в мембранах миоцитов, делающее их более чувствительными к травмам;
- истощение коэнзима Q10 с последующим негативным влиянием на функции митохондрий;
- уменьшение биодоступности изопреноидов, приводящее к гибели клетки in vitro.
Наиболее частыми локализациями миалгии на фоне приема статинов, не исчезающей даже через 3–4 дня после физической нагрузки, являются мышцы бедер и икр. Кроме болей могут также отмечаться тяжесть, жесткость или мышечные спазмы. Наиболее эффективным алгоритмом, рекомендуемым специалистами, является исследование КФК в группах риска до начала приема с повторными исследованиями уровня фермента через 10 дней, месяц от начала приема и при возникновении мышечного дискомфорта. К счастью, острый некроз скелетных мышц встречается редко, признаком рабдомиолиза и поводом к срочной отмене препарата во избежание повреждения почек служит уровень КФК, в 10 раз выше верхней границы нормы. При этом не следует забывать, что причинами повышения КФК, не связанными с приемом статинов, могут быть интенсивные физические нагрузки, гипотиреоз, алкоголизм, травмы, судороги, употребление кокаина и амфетаминов, дефицит витамина D.
Состояния, которые увеличивают риск развития миозитов и рабдомиолиза при применении статинов:
- пожилые больные с сочетанной патологией (сахарный диабет и ХПН);
- хирургические вмешательства (необходима отмена статинов!);
- недостаточное питание;
- печеночная недостаточность;
- избыточное употребление алкоголя;
- употребление грейпфрутового сока;
- полипрагмазия.
При необходимости гиполипидемической терапии статинами в этих случаях больные должны находиться под возможно более тщательным наблюдением с контролем ферментов (АЛТ, АСТ, ГГТП, КФК) не реже одного раза в месяц.
Для снижения риска побочных эффектов у пациентов из перечисленных групп предлагаются альтернирующие режимы приема препаратов (табл. 7), коррекция дефицита витамина D, сочетанное применение с коэнзимом Q10 в дозе 100–200 мг/сут [22].
Что касается наблюдений, показавших появление альбуминурии на фоне приема аторвастатина, установлено, что это происходит из-за дефицита мевалоната, необходимого для нормальной реабсорбции альбумина в проксимальных канальцах и в отношении протеинурических нефропатий этот эффект может оказывать даже нефропротективное действие, уменьшая тубулотоксическое действие протеинурии.
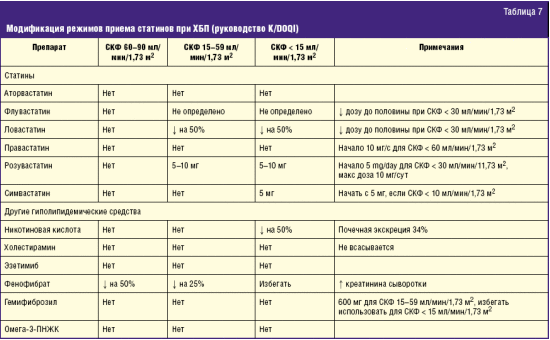
Безопасность производных фиброевой кислоты
Назначение фибратов при ХБП затруднено почечным метаболизмом этой группы препаратов, и достаточно частым для этого класса препаратов является умеренное обратимое повышение уровня креатинина сыворотки крови. Случаи рабдомиолиза чаше связаны с сочетанным приемом статинов и резким повышением концентрации последних за счет нарушения их глюкуронизации (кроме флувастатина). Другой причиной считается снижение выработки простагландинов, оказывающих сосудорасширяющее действие. По разрозненным данным нескольких небольших исследований скорость клубочковой фильтрации (СКФ) при этом сильно не снижается. Фенофибрат не удаляется при диализе, и при постоянном использовании у пациентов с умеренной ХБП (СКФ < 50 мл/мин/1,73 м2) отмечается снижение темпов его выделения [23]. Этим объясняется осторожное использование фибратов как в начальных, так и в продвинутых стадиях ХБП, с рекомендациями обязательного контроля уровня креатинина и снижения дозы на 75% при снижении СКФ от 15 до 59 мл/мин/1,73 м2 и полной отмены по достижении СКФ < 15 мл/мин/1,73 м2 и лечении гемодиализом. Для гемфиброзила у больных ХБП с СКФ < 60 мл/мин/1,73 м2 рекомендуемой является доза 600 мг (50% снижения) и полная отмена по достижении СКФ < 15 мл/мин/1,73 м2. Кроме того, существуют данные о возможном действии клофибрата и фенофибрата на уровень гомоцистеинемии и увеличение частоты тромбоэмболических осложнений [24].
Так как статины и фенофибрат независимо связаны с повышенным риском развития миопатии, существует повышенный риск развития миопатии и рабдомиолиза при их сочетании, поэтому в случае тяжелой смешанной гиперлипидемии для оптимальной безопасности фибратов в сочетании со статинами рекомендуется использовать низкие дозы обоих препаратов [25].
Безопасности других гиполипидемических препаратов
Нельзя не сказать о том, что дислипидемия у больных с ХБП часто имеет многофакторное происхождение, при ней могут встречаться и предсуществующие моно- и полигенные первичные семейные расстройства метаболизма ХС и ТГ, что не может не сказываться на ее курабельности. Необходимо также учитывать, что ХБП может осложнять латентный сахарный диабет, алкоголизм, заболевания, связанные с холестазом, гипотиреозом и терапию гипотензивными и иммуносупрессивными препаратами. Гиперлипидемия такого сложного генеза, как правило, требует сочетания гиполипидемических препаратов с различными механизмами действия.
Секвестранты желчных кислот, как правило, безопасны для использования при ХБП из-за низкой системной адсорбции, однако они могут увеличивать уровень ТГ и поэтому противопоказаны при соответствующей категории больных.
Ограниченные данные по эффективности и безопасности применения никотиновой кислоты в ХБП показывают, что 34% препарата выводится почками. В соответствии с K/DOQI [26] снижение СКФ < 15 мл/мин/1,73 м2, должно сопровождаться снижением дозы на 50%.
Относительно новый препарат эзетимиб безопасен и хорошо переносится в умеренной и тяжелой ХПН и не требует изменения дозировки при снижении СКФ [27].
Кроме того, хорошо зарекомендовали себя комбинации препаратов: эзетимиб/симвастатин и пролонгированного ниацина с симвастатином. Сочетание статинов с секвестрантами жирных кислот ограничено вызываемой последними гипертриглицеридемией, и без того выраженной в продвинутых стадиях ХБП, а также сложностями дозирования препаратов из-за склонности секвестрантов к связыванию лекарств в просвете кишечника.
Омега-3-жирные кислоты безопасно могут быть использованы в комбинации со статинами, т. к. не имеют значимого взаимодействия со статинами и не требуют снижения дозы для нарушения функции почек.
Для лечения смешанной дислипидемии было показано достаточно успешное сочетание статинов с препаратами никотиновой кислоты, сопровождавшееся помимо всего прочего повышением уровня ХС ЛПВП и снижением липопротеина — (а) и ТГ, но применение этих препаратов ограничено из-за плохой переносимости. Рекомендуется уменьшать дозировку никотиновой кислоты на 50% при СКФ < 15 мл/мин на 1,73 м2 [26].
Очень высокий уровень ТГ (> 500 мг/дл) опасен прежде всего возникновением острого панкреатита, для его коррекции оптимальными средствами считаются фибраты самостоятельно или в сочетании с препаратами ПНЖК (табл. 8).
Постоянно растущая заболеваемость ХБП, с присущим этим пациентам повышенным риском развития сердечно-сосудистых событий и смерти, требуют контроля тяжелых расстройств обмена липопротеинов, свойственных почечной патологии. Статины являются краеугольным камнем терапии для большинства пациентов с ХБП. Применение статинов у этих больных относительно безопасно и перспективно в плане профилактики сердечно-сосудистых осложнений практически для всех категорий больных, за исключением диализных больных. В случае тяжелой гипертриглицеридемии предпочтительнее использование гемфиброзила или омега-3-ПНЖК. При наличии смешанной дислипидемии пациенты ХБП нуждаются в лечении несколькими гиполипидемическими препаратами с учетом безопасности их применения при снижении фильтрационной функции почек (табл. 8).

Литература
- Смирнов А. В. Клиническое и прогностическое значение дислипидемий у больных ХГН. Дис. … д.м.н. СПб, 1997. 244 с.
- Колина И. Б. Влияние нарушений липидного обмена на течение и прогноз хронического гломерулонефрита с нефротическим синдромом. дисс… к.м.н. М., 2002.
- Колина И. Б., Ставровская Е. В, Шилов Е. М. // Materia Мedica. 2003, 37 (1): 31.
- Vaziri N. D. Dyslipidemia of chronic renal failure: the nature, mechanisms, and potential consequences // Am J Physiol Ren Physiol. 2005; 290: F262–F272.
- Parfrey P. S., Foley R. N., Harnett J. D., Kent G. M., Murray D., Barre P. E. Outcome and risk factors of ischemic heart disease in chronic uremia // Kidney Int. 1996; 49: 1428–1434.
- Muntner P., He J., Astor B. C., Folsom A. R., Coresh J. Traditional and nontraditional risk factors predict сoronary heart disease in chronic kidney disease: results from the Atherosclerosis Risk in Communities Study // J Am Soc Nephrol. 2005; 16: 529–538.
- Wanner C., Krane V., Marz W. et al. Atorvastatin in patients with Type 2 diabetes mellitus undergoing hemodialysis // N. Engl. J. Med. 2005, 353 (3), 238–248.
- Fellstrom B. C., Jardine A. G., Schmieder R. E. et al. Rosuvastatin and cardiovascular events in patients undergoing hemodialysis // N. Engl. J. Med. 2009, 360 (14), 1395–1407.
- Jeppe Hagstrup Christensen, Erik Berg Schmidt. N-3 Polyunsaturated Fatty Acids, Lipids and Lipoproteins in End-stage Renal Disease // Clin Lipidology. 2011; 6 (5): 563–576.
- Saravanan P., Davidson N. C., Schmidt E. B., Calder P. C. Cardiovascular effects of marine omega-3 fatty acids // Lancet. 2011, 376 (9740), 540–550.
- De Caterina R. N-3 fatty acids in cardiovascular disease // N. Engl. J. Med. 2011, 364 (25), 2439–2450.
- Khajehdehi P. Lipid-lowering effect of polyunsaturated fatty acids in hemodialysis patients // J. Ren. Nutr. 2000, 10 (4), 191–195.
- Bowden R. G., Wilson R. L., Gentile M., Ounpraseuth S., Moore P., Leutholtz B. C. Effects of omega-3 fatty acid supplementation on vascular access thrombosis in polytetrafluorethylene grafts // J. Ren. Nutr. 2007, 17 (2), 126–131.
- Svensson M., Schmidt E. B., Jorgensen K. A., Christensen J. H. N-3 fatty acids as secondary prevention against cardiovascular events in patients who undergo chronic hemodialysis: a randomized, placebo-controlled intervention trial // Clin. J. Am. Soc. Nephrol. 2006, 1 (4), 780–786.
- Kwak B., Mulhaupt F., Myit S., Mach F. Statins as a newly recognized type of immunomodulator // Nat Med. 2000, Dec; 6: 1399–1402.
- Palinski W. Immunomodulation: a new role for statins? // Nature Med. 2000; 12: 1311–1312.
- Rosenson R. S., Tangney C. C., Casey L. C. Inhibition of proinflammatory cytokine production by pravastatin // Lancet. 1999; 353: 983–984.
- Krane V., Winkler K., Drechsler C., Lilienthal J., Marz W., Wanner C. Effect of atorvastatin oninflammation and outcome in patients with type 2 diabetes mellitus on hemodialysis // Kidney Int. 2008, 74: 1461–1467, 387.
- Nutescu E. A., Shapiro N. L. Ezetimibe: A Selective Cholesterol Absorption Inhibitor // Pharmacotherapy. 2003. Vol. 23, № 11. P. 1463–1474.
- Sager P. T., Melani L., Lipka L. et al. Effect of coadministration of ezetimib and simvastatin on high-sensitivity C-reative protein // Amer. J. Cardiology. 2003. Vol. 92, № 12. P. 1414–1418.
- Herzog C. A. How to manage the renal patient with coronary heart disease: The agony and the ecstasy of opinion-based medicine // J Am Soc Nephrol. 2003; 14: 2556. Simvastatin for Secondary Prevention of All-Cause Mortality and Major Coronary Events in Patients With Mild Chronic Renal Insufficiency // American Journal of Kidney Diseases, Vol. 4, Issue 3, P. 373–382.
- Charles R. Harper, Terry A. Jacobson // Managing Dyslipidemia in Chronic Kidney Disease // J Am Coll Cardiol. 2008; 51 (25): 2375–2384.
- Chapman M. J. Pharmacology of fenofibrate // Am J Med. 1987; 83: 21–25.
- Westphal S., Dierkes J., Luley C. Effects of fenofibrate and gemfibrozil on plasma homocysteine // Lancet. 2001; 358: 39–40.
- Davidson M. H., Armani A., McKenney J. M., Jacobson T. A. Safety considerations with fibrate therapy // Am J Cardiol. 2007; 99: 3–18 C.
- K/DOQI clinical practice guidelines for managing dyslipidemia in chronic kidney disease // Am J Kidney Dis. 2003; 41 (S. 3): S1–S237.
- Landray M., Baigent C., Leaper C. et al. The second United Kingdom Heart and Renal Protection (UKHARP-II) study: a randomized controlled study of the biochemical safety and efficacy of adding ezetimibe to simvastatin as initial therapy among patients with CKD // Am J Kidney Dis. 2006; 47: 385–395.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru





