Введение
Течение беременности у пациенток с нарушением углеводного обмена сопряжено с высоким риском материнских и/или перинатальных осложнений и является частой причиной досрочного родоразрешения [1, 2]. Данные, представленные Международной диабетической федерацией (International Diabetes Federation), показали, что общее число беременных с диабетом составляет 16,7%: у 1,8% пациенток беременность наступила на фоне сахарного диабета (СД) 1 или 2 типа, у 1,5% беременных был впервые выявлен манифестный, а у 13,4% — гестационный СД (ГСД) [3].
Используемые ранее критерии диагностики нарушений углеводного обмена, на основании которых пациенток во время беременности распределяли в группы риска и, в зависимости от полученной стратификации, выбирали срок и способ скрининга (уровень гликемии натощак или пероральный глюкозотолерантный тест (ПГТТ)), в настоящее время пересмотрены [4, 5]. Доказано, что беременность сопровождается физиологической инсулинорезистентностью, обусловленной действием гормонов фетоплацентарного комплекса, и является значимым фактором риска нарушений углеводного обмена. Именно поэтому беременным показано рутинное двухэтапное тестирование. Первый этап скрининга включает определение уровня гликемии натощак в венозной крови и выполняется при первой явке беременной в женскую консультацию, на втором этапе, в 24–32 нед., проводят ПГТТ среди пациенток, у которых ранее не было выявлено нарушений углеводного обмена [4].
Глобальный рост частоты ГСД в настоящее время обусловлен как введением в практику клинических рекомендаций по диагностике и акушерской тактике у беременных с нарушениями углеводного обмена, так и распространенностью среди женщин репродуктивного возраста избыточной массы тела и ожирения, обусловленных гиподинамией и неправильными пищевыми привычками, увеличением возраста женщин, вступающих в беременность, наличием гипертензивных расстройств и СД 2 типа в популяции в целом [5–7]. В Российской Федерации на протяжении последних лет отмечается аналогичная тенденция — увеличение числа пациенток с ГСД в 4,7 раза, с 2,2% в 2015 г. до 10,4% в 2023 г.1
На скрининг во время беременности возложены большие надежды по снижению акушерских и перинатальных осложнений. Однако важно не только своевременно диагностировать осложнение. Необходимо рекомендовать терапевтическую модификацию образа жизни и мотивировать к ней, разъяснить необходимость и возможности контроля содержания глюкозы в крови на протяжении беременности как с использованием традиционных методов самоконтроля, так и с применением современного инструмента — непрерывного мониторинга гликемии [4, 5, 8].
Диабетическая фетопатия (ДФ) как основной маркер течения гестационного процесса на фоне хронической гипергликемии является фактором риска развития неблагоприятных материнских и перинатальных исходов [9–11]. Впервые в работе J. Pedersen et al. [12] 1954 г. было показано, что избыточную массу тела младенцев связывают с гипергликемией матери, которая влечет за собой повышенное поступление глюкозы в кровь плода. Согласно современным представлениям ДФ — это комплекс осложнений неонатального периода, характеризующийся полисистемным поражением, метаболическими и эндокринными дисфункциями у плода и/или новорожденного, прогрессирующими на протяжении беременности и предопределяющими перинатальный исход. К критериям диагностики ДФ у плода относят асимметричную макросомию: увеличение размеров живота более 90 перцентиля для данного срока гестации при нормальных размерах головки и длине бедра; фенотипические признаки: двойной контур головки, увеличение буккального индекса >0,9, толщина подкожно-жировой клетчатки (ПЖК) шеи >0,32 см, толщина ПЖК груди и живота >0,5 см; висцеральные признаки: гепатомегалия, кардиомегалия [9, 10].
Существующие данные показывают, что метаболическая перестройка в виде гестационной гипергликемии влияет на систему мать — плацента — плод в настоящем и способна изменять метаболизм детей, рожденных от таких матерей, в будущем [11]. Развившаяся ДФ плода ассоциирована как с развитием краткосрочных рисков (комплексные осложнения в фетоплацентарном комплексе, макросомия, дистоция плечиков, перинатальное поражение центральной нервной системы, гипогликемия, полицитемия, кардиомиопатия), так и с наступлением тяжелых отдаленных последствий у потомства в будущем (ожирение, СД, гипертензивные расстройства) [11, 13].
Цель исследования: анализ перинатальных исходов у беременных с СД 1 типа и ГСД, осложненными развитием ДФ новорожденного.
Содержание статьи
Материал и методы
Ретроспективно проанализировано 570 историй родов, состоявшихся в профильном родильном доме по ведению пациенток с нарушением углеводного обмена КГБУЗ «КМКБ № 20 им. И.С. Берзона» г. Красноярска за период с января по декабрь 2022 г.
Среди проанализированных историй родов у 30 пациенток, находившихся на этапе дородовой госпитализации в акушерском отделении патологии беременности с последующим родоразрешением, беременность наступила на фоне СД 1 типа, а у 540 беременных был диагностирован ГСД. У 10 пациенток с СД 1 типа (группа СД 1 типа) и 34 пациенток с ГСД (группа ГСД) была установлена ДФ новорожденных.
Критерии включения в исследование: беременность; СД 1 типа, диагностированный до наступления беременности; ГСД, установленный на основании результатов двухэтапного скрининга (данных о содержании глюкозы в венозной крови натощак при первом обращении беременной в женскую консультацию и в ходе проведения ПГТТ в сроке 24–32 нед. беременности) [4], ДФ у новорожденных.
Критерии невключения в исследование: другие виды нарушения углеводного обмена при беременности (СД 2 типа, манифестный СД); ГСД, установленный при неправильном проведении тестирования.
Обследование беременных обеих групп включало: анализ данных анамнеза, объективное исследование органов и систем, консультации специалистов (эндокринолог, офтальмолог, терапевт), оценку состояния плода различными методами (наружное акушерское исследование, ультразвуковая фетометрия во II и III триместрах, допплерометрия, кардиотокография). В послеродовом периоде проанализированы частота акушерских и перинатальных осложнений, способы родоразрешения, состояние новорожденных (данные клинического осмотра, результаты развернутого клинического и биохимического анализа крови, нейросонографии, ультразвукового исследования органов брюшной полости и сердца, электрокардиографии).
Статистическая обработка полученных результатов проведена с помощью пакета прикладных программ Statistica 10.0 (StatSoft, США) и Microsoft Office Excel 2013 (Microsoft, США). При анализе количественных признаков проведена проверка на нормальность распределения, результаты представлены в виде M±SD, где M (Mean) — среднее арифметическое значение, SD (standard deviation) — стандартное отклонение. Статистическую значимость различий между двумя средними показателями оценивали с помощью t-критерия Стьюдента для независимых выборок. При оценке качественных показателей вычисляли абсолютные и относительные (%) частоты наблюдений признака. Изучение взаимосвязи между парами качественных признаков проводили путем анализа парных таблиц сопряженности с вычислением критерия Пирсона (χ2), точного критерия Фишера. Различия считали статистически значимыми при p≤0,05.
Результаты исследования
Средний возраст пациенток обеих групп составил 27,7±5,4 года. Ретроспективный анализ перинатальных исходов показал, что признаки ДФ были выявлены у 10 (33,3%) новорожденных, родившихся от матерей с СД 1 типа, тогда как среди беременных с ГСД было 34 (6,3%) новорожденных с признаками ДФ, что достоверно ниже, чем у пациенток с СД 1 типа (ОШ 7,44, 95% ДИ 3,23–17,15).
Вопросы, связанные с акушерской тактикой в поздние сроки беременности, сроком и способом родоразрешения у пациенток с нарушением углеводного обмена во время беременности, в настоящее время не имеют однозначного решения. СД не является показанием к плановому оперативному родоразрешению, однако своевременное выявление осложнений беременности диктует необходимость ее завершения с применением программированных родов [14]. Согласно клиническим рекомендациям при наличии осложнений у матери и/или плода оптимальным сроком родоразрешения считают срок не позднее 39 нед. беременности2. Пролонгирование беременности после 39 нед. возможно только при компенсации СД и отсутствии перинатальных осложнений. Cреди пациенток, у которых была диагностирована ДФ плода, досрочное родоразрешение (в сроке 360–366 нед.) потребовалось 3 (30%) пациенткам группы СД 1 типа и 4 (11,8%) беременным группы ГСД (ОШ 3,21, 95% ДИ 0,58–17,74). У беременных с ГСД чаще была возможность пролонгировать беременность свыше 37 нед. Так, среди пациенток группы ГСД в сроке 370–376 нед. были родоразрешены 10 (29,4%) женщин, в сроке 380–386 нед. — 14 (41,2%), а в сроке 390–396 нед. — 6 (17,7%) пациенток. Родоразрешение у пациенток группы СД 1 типа проведено в сроке 370–376 нед. у 2 (20%) пациенток, а в сроке 380–383 нед. — у 5 (50%).
Анализ способа родоразрешения при ДФ новорожденных показал, что в группе СД 1 типа у 7 (70%) пациенток беременность завершена путем операции кесарева сечения. В группе ГСД количество пациенток с оперативным родоразрешением составило 15 (44,1%), 19 (55,9%) пациенток были родоразрешены рer vias naturales (ОШ 2,96, 95% ДИ 0,65–13,41).
Среди родившихся детей с признаками ДФ число мальчиков и девочек не имело достоверных различий между группами. Так, среди новорожденных, родившихся от матерей группы СД 1 типа, количество мальчиков и девочек составило 6 (60%) и 4 (40%) соответственно. В группе ГСД родилось 17 (50%) мальчиков и 17 (50%) девочек. Средняя масса тела и рост младенцев при рождении в обеих группах достоверно не различались и составили 3955,1±660,1 г и 54,3±2,4 см в группе СД 1 типа, а в группе ГСД — 3806,5±519,6 г и 54,7±3,1 см (р=0,86 для массы тела, р=0,92 для роста).
Наиболее часто встретившиеся осложнения неонатального периода представлены в таблице.
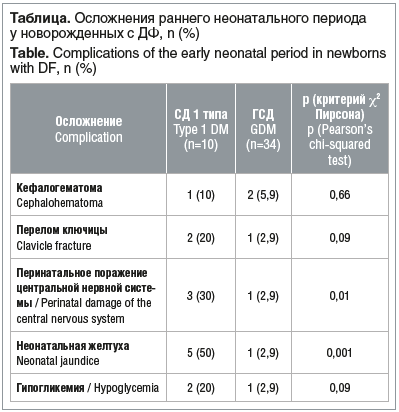
Число детей, требующих дальнейшего стационарного лечения в детском отделении, составило 6 (60%) в группе СД 1 типа и 6 (17,7%) в группе ГСД (p<0,05). Перинатальных потерь в 2022 г. не было.
Обсуждение
Приоритетными задачами системы здравоохранения РФ и Национальной стратегии действий в интересах женщин на 2023–2030 гг. являются: улучшение демографической ситуации, повышение качества оказания медицинской помощи в целях снижения частоты осложнений беременности и улучшения перинатальных исходов3. Период беременности предъявляет особые требования к физиологии материнского организма, предопределяя возможность изменений гомеостаза гликемии и формирования метаболических нарушений со стороны плода. Исследования распространенности ДФ при различных видах диабета во время беременности встречаются редко и не всегда точны, что обусловлено отсутствием единой мировой стратегии диагностики и лечения диабета во время беременности. Однако в вопросе о пусковом факторе развития осложнений со стороны плода/ новорожденного мнения авторов сходятся и показывают, что рождение ребенка с признаками ДФ чаще встречается при длительно существующей гипергликемии, которая диагностируется у пациенток с любым нарушением углеводного обмена при плохом метаболическом контроле [5, 7, 9, 15]. Результаты, полученные D. Mitanchez et al. [16], продемонстрировали линейную зависимость между уровнем материнской гликемии и увеличением массы тела новорожденного. Авторы отметили, что серьезные перинатальные осложнения, связанные с ГСД, встречаются реже по сравнению с осложнениями, связанными с прегестационным СД. Данные, полученные отечественными учеными ранее, свидетельствуют о развитии ДФ у 40 и 33% беременных c СД 1 и 2 типа соответственно и у 19% беременных c ГCД [17]. Полученные в ходе настоящего исследования результаты не противоречат сложившейся статистике. Группу высокого риска по развитию ДФ составили пациентки с прегестационным СД 1 типа, где это осложнение выявлено в 5,3 раза чаще по сравнению с группой пациенток с ГСД.
Довольно много исследований связано с изучением различных клинических проявлений ДФ. Краткосрочные осложнения, связанные с макросомией, показывают тесную взаимосвязь между массой тела при рождении и неблагоприятными исходами. Так, данные, полученные A.R. Bjørstad et al. [18] при изучении 372 128 рождений за период 1999–2005 гг., продемонстрировали увеличение количества акушерских осложнений при рождении детей с массой >4000 г по сравнению с новорожденными с нормальной массой тела: увеличение любых акушерских осложнений (ОШ 1,4, 95% ДИ 1,4–1,5), дистоции плечиков (ОШ 6,8, 95% ДИ 6,3–7,5), перелома ключицы (ОШ 3,4, 95% ДИ 3,0–3,8). В работе A. Ferrara et al. [19] отмечено, что гипергликемия у матери связана с повышением риска рождения ребенка с гипогликемией (ОШ 2,61, 95% ДИ 0,99–6,92), макросомией (ОШ 3,40, 95% ДИ 1,55–7,43), гипербилирубинемией (ОШ 2,22, 95% ДИ 0,98–5,04). Изучение осложнений неонатального периода у новорожденных с ДФ в данном исследовании показало, что родовая травма (кефалогематома, перелом ключицы) встречается в 6,8% случаев, перинатальное поражение ЦНС — у 9,1% новорожденных, неонатальная желтуха и гипогликемические состояния — у 13,6 и 6,8% соответственно, и эти осложнения требуют дальнейшего лечения и реабилитации. Отдаленные риски развития метаболических расстройств рассмотрены с точки зрения эпигенетических изменений различных генов внутриутробно у плода от матери с ГСД и трансгенерационной передачи ГСД и СД 2 типа, что приводит к появлению нового поколения матерей с ГСД [11]. Связь ожирения и гипергликемии у беременных с показателями ожирения у детей 10–14 лет, рожденных от них, изучена в международном эпидемиологическом исследовании «Гипергликемия и неблагоприятный исход беременности» — HAPO (Hyperglycemia and Adverse Pregnancy Outcomes, 2000–2006 гг.) и HAPO Follow-up Study (2013–2016 гг.). Сравнительный анализ детей (n=4 832), рожденных от матерей с ожирением и ГСД, по сравнению с детьми, рожденными от матерей без этих осложнений, показал значимую ассоциацию с более высокими рисками приобретения избыточной массы тела (ОШ 4,56, 95% ДИ 3,18–6,55) и ожирения (ОШ 7,70, 95% ДИ 5,12–11,60) у детей в возрасте 10–14 лет, рожденных от матерей с ожирением и ГСД [13].
Заключение
Формирование ДФ/макросомии на фоне повышения уровня глюкозы в крови приводит к развитию неонатальных осложнений и увеличению частоты оперативного родоразрешения. Уже более 10 лет в практическую работу акушеров-гинекологов введены критерии диагностики и акушерская тактика при ГСД и других нарушениях углеводного обмена во время беременности, основанные на согласованном мнении экспертов Российской ассоциации эндокринологов и Российской ассоциации акушеров-гинекологов с целью снижения развития перинатальных осложнений и, в идеальном итоге, получения исхода беременности у пациенток c СД, сопоставимого с исходом у здоровых женщин. Исследование показывает, что признаки ДФ чаще диагностируются в группе пациенток с прегестационным СД 1 типа, имеют более тяжелые осложнения и требуют дальнейшего лечения и реабилитации.
Сведения об авторах:
Шапошникова Екатерина Викторовна — к.м.н., доцент кафедры акушерства и гинекологии института последипломного образования ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; ORCID iD 0000-0001-8068-0699
Менцик Марина Мубаракзяновна — заместитель главного врача по акушерству и гинекологии КГБУЗ «КМКБ № 20 им. И.С. Берзона»; 660123, Россия, г. Красноярск,
ул. Инструментальная, д. 12; ORCID iD 0009-0008-8768-3700
Гольцман Елена Викторовна — заведующая отделением для новорожденных КГБУЗ «КМКБ № 20 им. И.С. Берзона»; 660123, Россия, г. Красноярск, ул. Инструментальная, д. 12; ORCID iD 0009-0006-9332-6190
Меджидли Эльгюн Шакир кызы — клинический ординатор кафедры акушерства и гинекологии института последипломного образования ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; ORCID iD 0009-0007-5423-6704
Контактная информация: Шапошникова Екатерина Викторовна, е-mail: catrinaek@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 25.01.2024.
Поступила после рецензирования 19.02.2024.
Принята в печать 18.03.2024.
About the authors:
Ekaterina V. Shaposhnikova — C. Sc. (Med.), Associate Professor of the Department of Obstetrics and Gynecology, Continuous Professional Education Institute, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0001-8068-0699
Marina M. Mentsik — Deputy Chief Physician for Obstetrics and Gynecology, I.S. Berzon Krasnoyarsk Interregional City Hospital No. 20; 12, Instrumental’naya str., Krasnoyarsk, 660123, Russian Federation; ORCID iD 0009-0008-8768-3700
Elena V. Gol’tsman — Head of the Neonatal Department, I.S. Berzon Krasnoyarsk Interregional City Hospital No. 20; 12, Instrumental’naya str., Krasnoyarsk, 660123, Russian Federation; ORCID iD 0009-0006-9332-6190
Elgyun Sh. Medzhidli — Resident Physician of the Department of Obstetrics and Gynecology, Continuous Professional Education Institute, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0009-0007-5423-6704
Contact information: Ekaterina V. Shaposhnikova, e-mail: catrinaek@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
Conflict of interest: no conflict of interest.
Received 25.01.2024.
Revised 19.02.2024.
Accepted 18.03.2024.
1Здравоохранение в России. 2023: Стат. сб. Росстат. М., 2023.
2Клинические рекомендации. Неудачная попытка стимуляции родов (подготовка шейки матки к родам и родовозбуждение). (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/recomend/640_1 (дата обращения: 15.01.2024).
3Распоряжение Правительства РФ от 29.12.2022 № 4356-р «Об утверждении Национальной стратегии действий в интересах женщин на 2023–2030 годы». (Электронный ресурс.) URL: https://mintrud.gov.ru/ministry/programms/37/3 (дата обращения: 15.01.2024).
Информация с rmj.ru






