Гастроэзофагеальный рефлюкс — фактор риска малигнизации послеожоговых и пептических стриктур пищевода
А.С. Аллахвердян, В.С. Мазурин, И.А. Казанцева, В.А. Исаков.
Введение
Несмотря на то, что на долю рака пищевода приходится всего 3% заболеваемости злокачественными новообразованиями, среди причин смертности он занимает 5-е место [1]. Хронический эзофагит различной этиологии, которому всегда сопутствует пролиферативный фон с частой дисплазией эпителия, является общепризнанным предрасполагающим фоном для малигнизации. Так, тяжелая дисплазия плоскоклеточного эпителия приводит к развитию плоскоклеточного рака. А гастроэзофагеальная рефлюксная болезнь (ГЭРБ), вызывающая кишечную метаплазию эпителия с развитием пищевода Баррета, может приводить к развитию аденокарциномы [2].
Рубцовые стриктуры пищевода относятся к предопухолевым заболеваниям. Изучение механизмов малигнизации на их фоне, безусловно, важная и актуальная задача.
Малигнизация рубцовых стриктур пищевода изучается около ста лет. В 1904 г. L. Teleky [3] впервые описал случай развития плоскоклеточного рака на фоне рубцовой послеожоговой стриктуры пищевода. С того времени в литературе отражено множество подобных наблюдений [4, 5].
Многие специалисты отмечают негативную роль вторично возникающего гастроэзофагеального рефлюкса в развитии хронического эзофагита у больных с послеожоговыми рубцовыми стриктурами пищевода [6-8]. Однако влияет ли рефлюкс на развитие злокачественной опухоли в этой зоне? Этот вопрос до конца не изучен.
Общепринятая концепция морфогенеза рака при ГЭРБ базируется на поэтапной железистой метаплазии эпителия, приводящей к развитию аденокарциномы пищевода. Однако в мировой литературе имеется немало описаний случаев развития плоскоклеточного рака на фоне ГЭРБ [9-12]. И тем не менее роль гастроэзофагеального рефлюкса в патогенезе плоскоклеточного рака пищевода дискутируется и даже полностью отрицается некоторыми исследователями [13].
Многие аспекты канцерогенеза при рубцовых стриктурах пищевода остаются неизученными. Какие факторы его провоцируют? Если ли общие черты канцерогенеза на фоне послеожоговых и пептических стриктур пищевода?
Данная работа основана на результатах обследования, лечения, гистологического исследования биопсий и операционных препаратов пищевода и отдаленного наблюдения за 221 больным с рубцовыми стриктурами пищевода. Пациентов лечили и наблюдали в клиниках торакальной хирургии и гастроэнтерологии МОНИКИ в 1994-2004 гг. Среди них были 62 (28,5%) больных с пептическими стриктурами пищевода и 159 (71,9%) — с послеожоговыми. Мужчин — 166 (75,1%), женщин — 55 (24,9%). Средний возраст составил 41,2 года.
Обследование больных обязательно включало рентгено-контрастное исследование пищевода и желудка, эзофаго-, при возможности, и гастроскопию. В комплекс обследования больных включались компьютерная томография (РКТ) и магнитно-резонансная томография (МРТ) пище- вода и желудка. Степень выраженности гастроэзофагеального рефлюкса мы оценивали по данным суточного рН-мониторинга в пищеводе и желудке.
Характер проведенного лечения представлен в табл. 1. Резекции пищевода с одномоментной внутриплевральной пластикой желудком выполнены 67 (30,3%) больным. У 152 (68,8%) пациентов в качестве единственного метода или в сочетании с оперативным пособием проводили бужирование. При пептических стриктурах в 17 случаях была выполнена фундопликация. У 55 больных по поводу послеожоговых стриктур формировались гастростомы и (или) выполняли операции, направленные на ликвидацию сочетанного стеноза антрального отдела желудка или привратника (24 пациента).
Таблица 1. Распределение больных по группам в зависимости от проведенного лечения
| Диагноз | Бужирование | Резекции | Фундопликации пищевода | Другие операции | Общее число больных |
| Пептические стриктуры, в том числе с малигнизацией | 49 | 12 | 17 | . | 62 |
| Послеожоговые стриктуры, в том числе с малигнизацией | 103 | 56 | . | 55 | 159 |
| Всего, в том числе с малигнизацией | 152 | 67 | 17 | 55 | 221 |
По поводу поздних рецидивов дисфагии (позднее 12 мес после проведенного бужирования) к нам обратились 18 больных с послеожоговыми стриктурами пищевода. У 8 (44,4%) из них была выявлена малигнизация в рубцовоизмененном участке пищевода. Также с поздними рецидивами дисфагии после бужирования пептических стриктур обратились 11 больных. Малигнизация была выявлена у 3 (27,3%) больных (табл. 2). Длительность анамнеза до появления рестеноза также представлена в табл. 2.
Таблица 2. Сроки возникновения редицива дисфагии после лечения
Характер стриктуры пищевода
| Характер стриктуры пищевода | До выявления рецидива | Всего | ||||||||
| <2 | 2-5 | 6-10 | 11-20 | 21-40 | 41-50 | >50 | ||||
| Послеожоговая, | 4 | 3 | 2 | 5 | 1 | 1 | 2 | 18 | ||
| в том числе с малигнизацией | 1 | . | . | 3 | 1 | 1 | 2 | 8 | ||
| Пептическая, | 5 | 4 | 2 | . | . | . | . | 11 | ||
| в том числе с малигнизацией | 2 | 1 | . | . | . | . | . | 3 | ||
| Итого, | 9 | 7 | 2 | 5 | 1 | 1 | 2 | 20 | ||
| в том числе с малигнизацией | 3 | 1 | . | 3 | 1 | 1 | 2 | 11 | ||
Было выявлено 8 случаев развития плоскоклеточного рака на фоне послеожоговой стриктуры и 3 случая развития плоскоклеточного рака на фоне пептической стриктуры. В 2 случаях наличие плоскоклеточного рака (по типу веррукозной карциномы) было случайной находкой в препарате резецированного пищевода: у 1 больного, оперированного по поводу послеожоговой стриктуры, и у 1 больного с пептической стриктурой. В остальных случаях речь идет о длительно наблюдавшихся больных (см. табл. 2). Верификация у них была получена при биопсии из зоны стриктуры. Поводом для выполнения биопсии послужило появление или усугубление явлений дисфагии. Резекция пищевода была выполнена 7 из 10 больных.
Таблица 3. Грыжа пищеводного отверстия диафрагмы у больных с послеожоговыми стриктурами
| Диагноз |
Грыжа ПОД |
Всего |
||||
| есть | нет | абс | % | |||
| абс | % | абс | % | |||
| Послеожоговая стриктура пищевода без малигнизации | 32 | 21,9 | 119 | 78,1 | 151 | 95,0 |
| Послеожоговая стриктура пищевода с малигнизацией | 5 | 62,5 | 3 | 37,5 | 8 | 5,0 |
| Итого… | 37 | 23,3 | 122 | 76,7 | 159 | 100 |
При гистологическом исследовании рубцовых послеожоговых стриктур пищевода, в том числе и при сочетании с поражением желудка (в сроки от 9 мес до 2 лет), нами выявлена комбинация рубцовых и воспалительных изменений. Так, при сочетанной стриктуре пищевода и антрального отдела желудка в резецированном пищеводе наблюдали активное хроническое воспаление с наличием крупноочаговых, местами сливающихся инфильтратов из мононуклеаров с преобладанием плазматических клеток (рис. 1, а). Интенсивная воспалительная инфильтрация определялась в зоне рубца с очагами гемосидероза, расположенного под множественными гранулирующими эрозиями и язвами со слабо выраженной регенерацией покровного эпителия по краям.
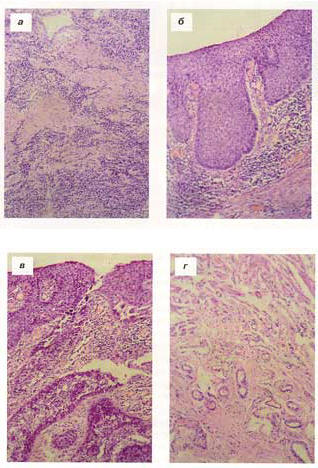
Рис. 1. Развитие рака в рубцовой стриктуре пищевода. Окраска гематоксилином и эозином. Ув. 100. а — крупноочаговые воспалительные инфильтраты в рубце в зоне ожоговой стриктуры пищевода; б — карцинома in situ на фоне длительно существующей постожоговой стриктуры; в — мультицентрическая инвазия умереннодифференцированного плоскоклеточного рака на фоне постожоговой стриктуры; г — ангиоматоз подслизистого слоя в зоне рубцовой стриктуры пищевода.
В случае развития рака пищевода непосредственно в зоне рубцового сужения спустя 40 лет после химического ожога выявлялась распространенная дисплазия многослойного плоского эпителия разной степени тяжести с участками карциномы in situ (рис. 1, б) и мультицентриче- ской инвазией умереннодифференцированного плоскоклеточного рака (рис. 1, в). Под эпителием определялся полосовидный «плотный» лимфоцитарный инфильтрат. Обращал на себя внимание резко выраженный ангиоматоз подлежащей ткани рубца с обилием кровеносных сосудов всех отделов микроциркуляторного русла и преобладанием капилляров (рис. 1, г). Можно предположить, что гиперваскуляризация рубца является косвенным признаком начинающейся малигнизации эпителия. Известно, что раковые клетки выделяют фактор роста сосудов VEGF, активно участвующий в новообразовании сосудов [14, 15].
Несколько иную картину начинающейся малигнизации эпителия наблюдали при пептической стриктуре пищевода. Область рубцового сужения была представлена клеточно-волокнистой, умеренно васкуляризированной соединительной тканью (рис. 2, а). На всем протяжении удаленного отрезка пищевода определялась гиперплазия покровного эпителия с очагами папилломатоза и полосовидной лимфоцитарной инфильтрацией субэпителиальной ткани. На этом фоне появлялись очаги дисплазии легкой степени с базально-клеточной пролиферацией и единичными атипичными митозами, в том числе многополюсным (трехполюсным) митозом (рис. 2, б). Выявлены также достаточно распространенные изменения эпителия, приближающиеся по морфологии к так называемой веррукозной карциноме, обычно встречающейся в полости рта и гортаноглотке, с характерным гиперкератозом и образованием зубчатых папилломатозных экзофитных выступов в комбинации с пальцевидными акантотическими погружными разрастаниями эпителия, в которых определяется гиперхромия ядер и повышенная митотическая активность клеток базального слоя (рис. 2, в).
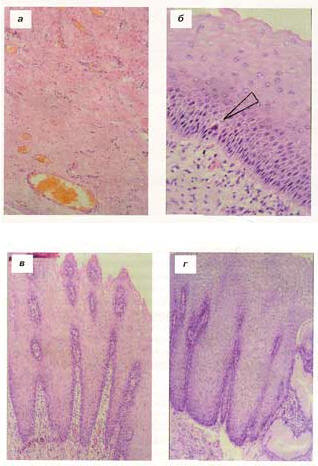
Рис. 2. Начальные признаки малигнизации эпителия при пептической и постожоговой стриктурах пищевода. Окраска гематоксилином и эозином. Ув.: а, в, г — 100; 6 — 400. а — умеренно васкуляризированная соединительная ткань в зоне пептической стриктуры; б — тот же больной. Дисплазия эпителия пищевода легкой степени с базально-клеточной пролиферацией и единичным многополюсным (трехполюсным) митозом — отмечено стрелкой; в — изменения эпителия по типу веррукозной карциномы (начало малигнизации в области пептической стриктуры); г — начало малигнизации при рубцовой стриктуре среднегрудного отдела пищевода. Изменения по типу веррукозной карциномы в зоне кардиоэзофагеального перехода.
Сходные морфологические изменения отмечены при гистологическом изучении операционного материала больного, оперированного спустя 18 мес после ожога кислотой с развитием рубцовой стриктуры среднегрудного отдела пищевода, сочетавшейся со стенозом привратника. Выявлена распространенная веррукозная гиперплазия многослойного плоского эпителия пищевода в зоне Z-линии, местами приближающаяся к веррукозной карциноме (рис. 2, г). Эти изменения были расположены значительно ниже рубцовой стриктуры. Рубец в стенке пищевода представлен преимущественно волокнистой соединительной тканью с небольшим количеством фибробластов и очагами ангиоматоза с наличием скоплений тонкостенных сосудов синусоидного типа.
Формирование плоскоклеточного рака в самой рубцовой стриктуре позволяет поставить под сомнение наличие механизма тормозящего влияния массивных зрелых рубцов на процессы эпителизации [16]. Вероятнее всего, рубцовая ткань нарушает нормальную трофику и иммун- ную регуляцию регенерации эпителия, что может приводить к возникновению ее патологии, лежащей в основе последующей атипии эпителия и малигнизации. Об этом свидетельствует и обнаружение нами фигур патологических митозов, являющихся одним из механизмов нарастания анеуплодии.
Рак пищевода был выявлен нами на уровне максимально выраженного рубцового сужения или ниже его. Мы не отметили ни одного случая развития рака в супрастенотически расширенном участке пищевода. Это не позволяет сделать вывод об онкогенной роли застойного хронического эзофагита.
Изменения эпителия с его малигнизацией по типу поверхностно распространяющейся веррукозной карциномы и при пептической, и при послеожоговой стриктурах пищевода, на фоне субкомпенсированного стеноза привратника, по-видимому, связано с наличием гастроэзофагеального рефлюкса. Во всемирной литературе нами обнаружено всего 15 описаний веррукозной карциномы пищевода, развивающейся, как правило, на фоне рефлюкс-эзофагита [14,17].
Среди наблюдавшихся нами 159 больных с послеожоговыми стриктурами грыжа пищеводного отверстия диафрагмы выявлена в 37 (23,3%) случаях (табл. 3.) В то же время она выявлена у 5 (71,4%) из 7 пациентов, у которых развилась малигнизация на этом фоне (р<0,005). Все это косвенно подтверждает негативную роль рефлюкса желудочного содержимого в пищевод у данной категории больных.
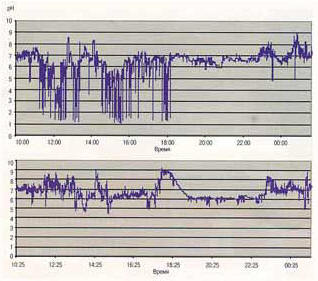
Рис. 3. рН-граммы больного до и после формирования пептической стриктуры (24-часовой мониторинг).
В то же время при пептических стриктурах отмечены следующие закономерности: при формировании пептической стриктуры мы отметили ослабление степени рефлюкса, по данным рН-метрии (рис. 3). В группе из 20 больных ГЭРБ, у которых сформировалась пептическая стриктура и ранее проводилась рН-метрия, у 19 отмечено уменьшение интенсивности гастроэзофагеального рефлюкса и у 8 из них отсутствие такового, по данным рН-метрии. И что важно отметить, при исследовании биопсий из зоны стеноза нами не выявлено ни одного случая тяжелой дисплазии на фоне пептических стриктур.
Выявлена сходная картина развития начальных форм рака пищевода (веррукозная карцинома) у больного на фоне послеожоговой рубцовой стриктуры с наличием вторичного укорочения пищевода и как следствие развитием несостоятельности кардиального жома и гастроэзофагеального рефлюкса и у больного с пептической стриктурой. Это позволяет сделать вывод о важной роли такого агрессивного для слизистой оболочки пищевода повреждающего фактора, как хронический рефлюкс желудочного содержимого, в результате которого снижаются барьерные функции слизистой оболочки пищевода и, конечно, местный тканевый иммунитет.
Тем не менее при пептических стриктурах мы не наблюдали развития аденокарциномы пищевода. Объяснить это можно следующим образом: гастроэзофагеальный рефлюкс способствует развитию эзофагита и формированию стриктуры. Однако уже сформировавшаяся стриктура пищевода уменьшает количество поступающего проксимальнее рефлюктата. Вот почему уменьшается вероятность развития метаплазии по кишечному типу и при малигнизации формируется плоскоклеточный рак, в развитии которого играют решающую роль уже другие механизмы. Очевидно, что эти механизмы могут быть общими при послеожоговых и пептических стриктурах (экзогенные канцерогены, папилломавирусная инфекции и т.п.). Здесь уместно отметить, что в мировой литературе есть описания случаев развития плоскоклеточного рака на фоне пищевода Баррета, после того как у пациента сформировалась пептическая стриктура [10,12].
Нами выявлена сходная картина развития начальных форм рака пищевода (веррукозная карцинома) у больного на фоне послеожоговой рубцовой стриктуры с наличием вторичного укорочения пищевода и, как следствие, развитием несостоятельности кардиального жома и гастроэзофагеального рефлюкса и у больного с пептической стриктурой.
При рецидиве рубцового процесса в зоне стриктур пищевода важную роль играет хронический гастроэзофагеальный рефлюкс, приводящий к развитию эзофагита и повторного стенозирования. Агрессивный для слизистой оболочки пищевода хронический рефлюкс желудочного содержимого снижает ее барьерные функции и, конечно, местный тканевый иммунитет.
Причиной рецидива дисфагии в первое десятилетие при лечении послеожоговых стриктур пищевода является рецидив рубцового стеноза. Позднее причиной рестеноза у этих больных чаще всего является малигнизация в зоне стеноза.
Сформированная пептическая стриктура пищевода снижает интенсивность гастроэзофагеального рефлюкса и уменьшает риск развития метаплазии эпителия по кишечному типу и возникновению аденокарциномы пищевода. Однако это не препятствует формированию рака из плоскоклеточного эпителия под воздействием неблагоприятных факторов.
- Янкин А.В. Рак пищевода; от статистики к диагностике. Практич. онкол. 2003; 4 (2): 61-5.
- Teleky L. Lye bums of the esophagus (Die laugenverat-zungen der speiserobre). Ztschr Heilk 1904; 5:1.
- Rosengard AM, Hamilton SR. Squamous carcinoma of the esophagus in patientswith Barrett’s esophagus. Mod Pathol 1989; 2:2-7.
- 4. Davids PH, Bartelsman JP, Tilanus HW, van Lanschot JJ. Consequences of caustic damage of the esophagus. Ned Tijdschr Geneeskd 2001; 145 (44): 2105-8.
- Kim YT, Sung SW, Kim JH. Is it necessary to resect the diseased esophagus in performing reconstruction for corrosive esophageal stricture? Eur J Cardiothorac Surg 2001; 20 (1): 1-6.
- Скворцов М.Б. Выбор оптимального способа лечения рубцовых сужений пищевода. Автореф. дис… д-ра мед. наук. М. 1991.
- Черноусов А.Ф., Нарезкин Д.В., Степанкин С.И., Сташинская А.В. Лечение ожоговых стриктур пищевода, сочетащихся с грыжей пищеводного отверстия диафрагмы. В сб. Актуальные вопросы реконструктивной и восстановительной хирургии. Иркутск, 1988; 4.1:115-7.
- Blesa Е., Moreno С, Alaminos M et al. Severe caustic injuries of the esophagus: when to replace the esophagus. Cir Pediatr 2001; 14 (1): 34-7.
- Андрианов В.А. Толстокишечная пластика при протяженных рубцовых стриктурах пищевода и глотки. Дис…. д-ра мед. наук. М, 1991.
- Para JP, Flejouj, Potet F et al. Esophageal squamous carcinoma in five patients ivitb Barretts esophagus. Am J Gastroenterol 1992; 87: 746-50.
- Ribet ME, Mensier EA. Reflux esophagitis and carcinoma. Surg Gynecol Obstet 1992; 175 (2): 121-5.
- Spechler SJ. Barrett’s esophagus and esophageal adenocarcinoma: pathogenesis, diagnosis, and therapy. Med Clin North Am 2002; 86 (6): 1423-45.
- Lagergrenf, Bergstrom R, Lindgren A, Nyren O. Symptomatic gastroesophageal reflux as a risk factor for esophageal adenocarcinoma. N Engl J Med 1999; 340 (11): 825-31.
- Ereno C, Lopez Jl, Loizate A, Bilbao PJ. Verrucous carcinoma of the esophagus. Endoscopy 2001; 33 (3): 297.
- Koto H, Yoshikawa M, Miyazaki T et al. Expression of vascular endothelial growth factor (VEGF) and its receptors (Flt-1 andFlk-1) in esophageal squamous cell carcinoma. Anticancer Res 2002; 22 (6C): 3977-84.
- Сапожникова М.А. Рубцовые сужения пищевода и их последствия. Грудн. хирургия. 1974; 5:91-7.
- Tajiri H, Muto M, Boku N et al. Verrucous carcinoma of the esophagus completely resected by endoscopy. Am J Gastroenterol 2000; 95 (4): 1076-7.
Статья опубликована на сайте http://www.gastroscan.ru
материал с сайта MedLinks.ru



