Гастроэнтерологическая безопасность применения ацетилсалициловой кислоты как антиагреганта
Т.Л. Лапина
О том, что кора ивы обладает свойством уменьшать боль и лихорадку, знал еще Гиппократ. Действующее вещество из ивовой коры было выделено в начале ХIХ века, а работы по синтезу ацетилсалициловой кислоты (от латинского «ива» – «salix») относятся к середине и концу ХIХ. Первый представитель нестероидных противовоспалительных средств появился в 1899 году. Лишь десятилетия спустя был расшифрован основной механизм противовоспалительного действия ацетилсалициловой кислоты (АСК). В 1971 году исследователь из Великобритании Джон Роберт Вейн показал, что АСК снижает синтез простагландинов и тромбоксанов, за что был удостоен рыцарского звания и Нобелевской премии (1982).
АСК снижает синтез простагландинов и тромбоксанов за счет конкурентного и необратимого связывания с ферментом циклооксигеназой (ЦОГ). ЦОГ катализирует превращение арахидоновой кислоты в простаноиды (простагландины, тромбоксан А2 и простациклин) – семейство аутокринных и паракринных медиаторов, участвующих во многих физиологических и патофизиологических процессах. АСК работает как ацетилирующий агент, и ее ацетил–группа ковалентно связывается с сериновым остатком в активном центре ЦОГ. Такое ковалентное связывание отличает АСК от других НПВП, которые, как правило, являются обратимыми ингибиторами ЦОГ.
Простагландины обладают очень широким спектром биологической активности, в том числе они участвуют в воспалении, в формировании болевого восприятия, модулировании гипоталамических структур, участвующих в терморегуляции. Простациклин расширяет сосуды и тормозит агрегацию тромбоцитов. Тромбоксан, наоборот, отвечает за агрегацию тромбоцитов и формирование сгустка.
При назначении АСК происходит ингибирование ЦОГ тромбоцитов. Так как тромбоциты лишены ядра, новые молекулы ЦОГ не образуются. В результате на весь срок жизни тромбоцитов в них подавляется образование метаболитов арахидоновой кислоты, в том числе тромбоксана А2. В эндотелии сосудов синтез простациклина не прекращается за счет короткого времени нахождения АСК в циркуляции и появления новых молекул ЦОГ. Таким образом, АСК оказывает преобладающее влияние на ЦОГ тромбоцитов.
Именно АСК служит наиболее широко применяемым настоящее время антиагрегантом. Ее эффективность для лечения и профилактики тромбообразования у больных с различными заболеваниями сердечно–сосудистой системы имеет обширную доказательную базу и продемонстрирована многолетними наблюдениями.
Главной проблемой безопасности при назначении НПВП служит их негативное влияние на желудочно–кишечный тракт. Это объясняется механизмом действия данной группы лекарственных средств. Показано наличие двух изоэнзимов: ЦОГ–1 и ЦОГ–2. Дело в том, что ингибирование ЦОГ–1 приводит к снижению цитопротективных свойств простагландинов в слизистой оболочке желудочно–кишечного тракта (ингибирование именно этого изоэнзима наиболее значимо для профилактики тромбообразования). Наиболее изучены функции простагландинов в желудке и двенадцатиперстной кишке, которые можно суммировать следующим образом:
- увеличение секреции слизи и бикарбонатов;
- усиление кровотока в слизистой оболочке;
- обеспечение нормальной пролиферации эпителиоцитов, реконструкции экстрацеллюлярного матрикса и полноценного ангиогенеза.
Снижение синтеза простагландинов – вероятно, основная, но не единственная причина гастропатии. В качестве других механизмов негативного влияния АСК на слизистую оболочку называют активизацию перикисного окисления липидов и индукцию апоптоза эпителиоцитов (доказан каспаз–обусловленный механизм). Продуктом деацетилирования АСК служит салицилат, который оказывает локальное негативное воздействие: повышает проницаемость клеточных мембран, изменяет их электрическую активность и ионный транспорт. Естественно, что присущие желудку агрессивные факторы – кислота и пепсин в этих условиях легче реализуют свой негативный потенциал.
Не следует забывать, что негативные эффекты НПВП и АСК могут реализоваться не только в желудке, но и в других отделах желудочно–кишечного тракта.
Рассмотрим возможный спектр гастроэнтерологических нежелательных эффектов АСК (рис. 1). Прием АСК может сопровождаться болями и дискомфортом в эпигастральной области, то есть проявлять себя диспепсией. Так при проведении анкетирования пожилых лиц прием НПВП/АСК (1375 человек, США (Olmsted County, Minnesota)) сопровождался диспепсией (отношение шансов для диспепсии при приеме других НПВП составило 1,8; при приеме АСК – 1,6) [Talley N.J. et al., 1995]. В исследовании 592 молодых здоровых лиц прием АСК также был связан с диспепсией (отношение шансов 2,2) [Nandurkar S. et al., 1998]. Но, как правило, поражение гастродуоденальной слизистой оболочки, индуцированное АСК, не сопровождается симптоматикой. При проведении эндоскопии на фоне приема НПВП/АСК различные дефекты слизистой оболочки разных размеров и в разных отделах выявляют у 60% осмотренных лиц без симптомов диспепсии.
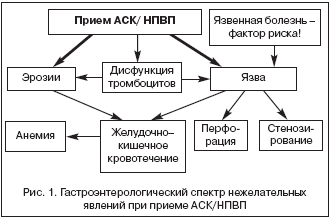
Итак, АСК вызывает появление эрозий, язв и в желудке, и двенадцатиперстной кишке. Смертельно опасными могут быть их осложнения – кровотечение, перфорация, стенозирование. Таким образом, повреждения слизистой оболочки желудка и других отделов желудочно–кишечного тракта при приеме АСК/НПВП особенно опасны тем, что могут протекать бессимптомно и приводить к осложнениям. Следует отметить, что в качестве факторов, которые бы позволили предсказать возможность кровотечения, ни диспепсия, ни обнаружение дефектов слизистой оболочки при эндоскопии не могут быть использованы. Риск гастропатии, индуцированной приемом НПВП или АСК возрастает у лиц, страдающих язвенной болезнью, в более старшей возрастной группе, а также при приеме вместе с АСК НПВП, или при одновременном приеме антикоагулянтов и кортикостероидов (табл. 1). В специальном исследовании, посвященном переносимости АСК как антиагреганта у пожилых пациентов, в качестве изучаемого критерия была установлена необходимость прекратить прием АСК из–за побочных эффектов (диспепсия, признаки кровотечения, изъязвления, выявленные при эндоскопии). В качестве факторов, которые были связаны с отказом от лечения АСК авторы называют: язвенную болезнь или диспепсию в анамнезе, возраст (старше 80 лет), уровень гемоглобина (ниже 11 г/дл) и одновременный прием других НПВП.

В какой мере АСК, которую назначают как антиагрегант в низкой дозе может способствовать желудочно–кишечному кровотечению? Рассчитано, что относительный риск кровотечения при приеме НПВП составляет от 2,1 до 5,5. Для АСК в стандартной дозе относительный риск составляет от 1,5 до 3,3; а для АСК в низкой дозе относительный риск, вероятно, еще ниже [Irvine E.J., Hunt R.H., 2001]. В некоторых исследованиях риск кровотечения вообще не удалось подтвердить, хотя имеются и другие данные. Так в исследовании случай–контроль [Weil J. et al., 1995] для кровотечения при приеме АСК в дозе 75 мг/сут. отношение шансов составило 2,3 (доверительный интервал для вероятности 95% 1,2–4,4), в дозе 150 мг – 3,2 (1,7–6,5), в дозе 300 мг – 3,9 (2,5–6,5). Наиболее значимым фактором риска кровотечения на фоне АСК служит кровотечение в анамнезе. Почти 15% пациентов с бывшим кровотечением буду иметь повторное кровотечение в течение года наблюдения [Garcia Rodrigues L.A. et al., 1999].
Helicobacter pylori, микроорганизм, заселяющий слизистую оболочку желудка, приводит к развитию в ней хронического воспаления, то есть является возбудителем гастрита. Ему принадлежит существенная роль в патогенезе различных заболеваний желудка, в том числе язвенной болезни. Участие H. pylori в развитии гастропатии, индуцированной АСК/НПВП до недавнего времени вызывало дебаты, но с принятием решения согласительной конференции под эгидой Европейской группы по изучению Helicobacter (Маастрихтский консенсус–III, 2005) эти вопросы следует считать решенными.
В мета–анализе Huang J.Q., Sridhar S., Hunt R.H. (2002) отношение шансов для пептической язвы при инфицировании H. pylori и одновременном приеме НПВП составило 61,1 по сравнению с неинфицированными лицами, не принимающими НПВП. H. pylori повышает риск язвенного кровотечения в 1,79 раза, НПВП в 4,85 раза, когда присутствуют оба этих негативных фактора риск кровотечения возрастает в 6,13 раз. Таким образом, и геликобактерная инфекция и прием НПВП служат двумя разными факторами риска повреждения гастродуоденальной слизистой оболочки.
На вопрос о необходимости проведения эрадикационной терапии H. pylori при приеме НПВП или АСК отвечает Маастрихтский консенсус–III. Основные положения по этому вопросу следующие:
- Эрадикационная терапия H. pylori имеет важное значение при длительном приеме НПВП, но одной этой меры недостаточно для полного предотвращения язвообразования.
- Перед началом курса НПВП (у пациентов, ранее НПВП не принимавших) следует провести антигеликобактерную терапию для профилактики язвообразования и кровотечения.
- При необходимости длительного приема НПВП и наличии язвенной болезни и/или кровотечения поддерживающая терапия ингибиторами протонной помпы более эффективна, чем эрадикация инфекции H. pylori (для предотвращения язвообразования и кровотечения).
- При необходимости длительного приема АСК и при наличии кровотечения в анамнезе следует проводить тест для определения инфекции H. pylori и при положительном результате назначать антигеликобактерное лечение.
В качестве оснований для вынесения подобных суждений Маастрихтский консенсус–III опирался на данные исследований, отвечающих критериям доказательной медицины. В этом плане показательно исследование Francis K.L. и соавт. (2001), в которое включались больные, у которых желудочно–кишечное кровотечение на фоне приема АСК или НПВП было подтверждено при эндоскопии. После курса лечения омепразолом для заживления язвенного дефекта эти пациенты по показаниям продолжили прием АСК в дозе 80 мг/сут. (250 человек) или напроксена 1000 мг/сут. (150 человек) в течение полугода. Они были рандомизированы в две группы в зависимости от избранного метода профилактики НПВП–гастропатии: в одной группе был назначен омепразол 20 мг на 6 месяцев, в другой – курс эрадикационной терапии инфекции H. pylori, а затем плацебо 6 месяцев. В группе больных, принимавших АСК, повторное кровотечение возникло у 1,9% после эрадикационной терапии, и у 0,9% на фоне приема омепразола (разница статистически достоверна). В группе больных, принимавших напроксен, повторное кровотечение возникло в 18,8% случаев после эрадикационной терапии и в 4,4% случаев на фоне приема омепразола.
Ингибиторы протонной помпы, таким образом, рассматриваются как лекарственные средства, безусловно эффективные и для заживления язвы и эрозий, индуцированных АСК, и для профилактики их возникновения на фоне продолжения антиагрегантного лечения. Ингибиторы протонной помпы, подавляя кислотную продукцию желудка, предотвращают ульцерацию, и следовательно, могут рассматриваться как профилактика кровотечений из желудка и двенадцатиперстной кишки. Следует отметить, что они не влияют на вероятность кровотечения из других отделов желудочно–кишечного тракта.
Другой класс лекарственных средств, который может быть использован для лечения и профилактики гастродуоденальных эрозивно–язвенных повреждений, вызванных НПВП – это синтетические аналоги простагландинов, например, мисопростол. К сожалению, прием мисопростола сопряжен с большим числом нежелательных явлений (в том числе с диареей), что ограничивает его применение.
Можно ли говорить о полном исключении риска гастроэнтерологических нежелательных эффектов при применении лекарственных средств с другим механизмом снижения агрегации тромбоцитов? Как показывают разные источники, при лечении клопидогрелом этот риск не может быть исключен полностью. Так, при лечении пациентов, перенесших желудочно–кишечное кровотечение, сравнивали гастроэнтерологическую безопасность клопидогрела (161 человек) и АСК в сочетании с ингибитором протонной помпы (159 человек). Повторное кровотечение (наблюдение в течение года) произошло у 8,6% пациентов на фоне приема клопидогрела и у 0,7% на фоне приема АСК «под прикрытием» антисекреторной терапии. Авторы делают вывод о том, что для вторичной профилактики гастропатии и кровотечений АСК с ингибитором протонной помпы оказались более эффективны, чем клопидогрел [Francis K.L. и соавт., 2005].
Для снижения риска гастроэнтерологических нежелательных явлений предложена комбинация АСК с невсасывающимся антацидным комплексом – гидроокисью магния (Кардиомагнил, фармацевтическая компания Nycomed). Антацид действует, непосредственно нейтрализуя кислоту в желудке, а соединение магния позволяет эксплуатировать его свойства как обволакивающего и абсорбирующего средства. При применении антацидов доказана абсорбция пепсина, а при нейтрализации «кислотности» пепсиноген не конвертируется в пепсин, таким образом, снижается протеолитическая активность желудочного сока. Антациды связывают лизолецитин, желчные кислоты, повреждающие слизистую оболочку желудка и усиливающие негативное влияние НПВП. Ряд авторов показывают способность невсасывающихся антацидов повышать концентрацию простагландинов в гастродуоденальной слизистой оболочке.
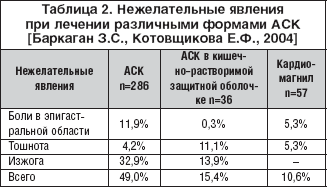
Удалось показать лучшую переносимость Кардиомагнила по сравнению с обычной формой АСК и АСК в кишечно–растворимой защитной оболочке. При адекватной антитромбоцитарной активности АСК с гидроокисью магния на фоне ее приема диспепсия и изжога отмечались существенно реже, особенно по сравнению с обычной лекарственной формой АСК (табл. 2).
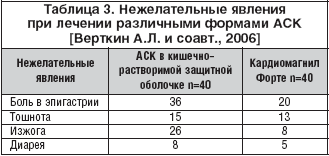
В другом отечественном исследовании [Верткин А.Л. и соавт., 2006] пациенты с ИБС получали Кардиомагнил Форте или АСК в кишечно–растворимой защитной оболочке. Для оценки боли в животе, тошноты, изжоги, диареи применяли балльную оценку (0 – симптомов нет; 1 – симптомы слабые; 2 – симптомы средней силы; 3 – симптомы выраженные). Выраженность гастроэнтерологических нежелательных явлений на фоне Кардиомагнила была ниже и они встречались у меньшего числа больных (табл. 3). Продолжительность диспепсии у больных, принимавших Кардиомагнил, в среднем составила 24,7 дней, тогда как в группе АСК – 43,3 дня. Эрозивные поражения были выявлены при проведении ЭГДС у 65% пациентов, принимавших АСК в кишечно–растворимой защитной оболочке, и в 22,5% у пациентов, принимавших Кардиомагнил. Язвенных поражений в обеих группах больных выявить не удалось.
Значение АСК в качестве антиагрегантного средства возрастает и возрастает количество больных, которые получают такую терапию. У врача имеется целый арсенал способов снизить частоту нежелательных гастроэнтерологических явлений. Это и эрадикационная терапия инфекции H. pylori, и ингибиторы протонной помпы, и синтетические аналоги простагландинов. Сочетание АСК с антацидным средством в одном препарате (Кардиомагнил) также позволяет повысить гастроэнтерологическую безопасность.
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru






