Введение
В последние годы коррекция дисбиоза рассматривается как одно из приоритетных направлений профилактики и лечения многих заболеваний. По определению ВОЗ, «пробиотики — это живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма-хозяина». Наиболее часто в качестве пробиотиков используются штаммы Lactobacillus и Bifidobacterium, кроме того, используются дрожжи Saccharomyces cerevisiae и Saccharomyces boulardii и некоторые виды Escherichia coli и Bacillus. Недавно в Европейском союзе зарегистрирован новый пищевой продукт — Clostridium butyricum [1].
Актуально исследование применения пробиотических культур в педиатрии. Показано, что олигосахариды, содержащиеся в материнском молоке, способствуют развитию бифидогенного микробиома у младенцев. Изменение состава данного микробиома может приводить к значительным функциональным расстройствам желудочно-
кишечного тракта (ЖКТ) и ассоциированным с ними заболеваниям.
Функциональные нарушения ЖКТ — одна из самых распространенных проблем в детской гастроэнтерологии. По данным различных авторов, функциональные нарушения ЖКТ встречаются у 55–75% детей первых месяцев жизни. У детей раннего возраста отсутствует диагноз «функциональная абдоминальная боль». Состояние с похожими симптомами называют младенческими коликами. В первые три месяца жизни более чем у 70% детей отмечаются функциональные кишечные колики. В соответствии с Римскими критериями IV колики у младенцев представляют собой эпизоды повышенной раздражительности, беспокойства или безутешного плача, возникающие и завершающиеся без очевидных причин. Длительность младенческих кишечных колик составляет более трех часов в день и не менее трех дней в течение одной недели.
Младенческие кишечные колики характеризуются многофакторной этиологией, при этом патофизиологические механизмы, лежащие в основе кишечных колик, не установлены. Общепринято связывать их с непосредственными нарушениями функционирования ЖКТ [2]. Многофакторная этиология младенческих кишечных колик связана с различными подходами к лечению данного заболевания, включая изменение ухода за ребенком, поддержку грудного вскармливания, рациональное питание матери и медикаментозную терапию [3].
В педиатрической практике широкое применение в терапии колик нашли пеногасители, в основном препараты симетикона. Несмотря на некоторые позитивные отзывы со стороны родителей, нет достоверных доказательств в пользу пеногасителей как обезболивающего средства при кишечных коликах у младенцев [4]. Плацебо-контролируемые исследования симетикона подтверждают эти выводы [5, 6]. Сравнительные исследования пробиотиков и симетикона также показали, что симетикон неэффективен в терапии младенческих колик [7].
В терапии желудочно-кишечных нарушений у детей (в частности, при острой инфекционной диарее) довольно широко используются адсорбенты, например диосмектит. С одной стороны, метаанализ показывает, что диосмектит сокращает продолжительность диареи на один день и увеличивает шансы на полное выздоровление на третий день лечения [8]. С другой стороны, клинические рекомендации Европейского общества педиатрической гастроэнтерологии, гепатологии и нутрициологии (the European Society for Paediatric Gastroenterology Hepatology and Nutrition, ESPGHAN) подчеркивают, что комбинация диосмектита и пробиотика, содержащего Lactobacillus GG (LGG), и LGG отдельно одинаково эффективны при терапии острой инфекционной диареи у детей раннего возраста [9]. Соответственно, вопрос о сравнительной эффективности диосмектита и пробиотика остается открытым.
В последнее время состав микробиоты кишечника рассматривается как независимый фактор риска развития младенческих колик. Сравнительные исследования микрофлоры кишечника у детей с коликами и детей без колик показали значительное увеличение заселенности анаэробными грамотрицательными и грамположительными бактериями (Clostridium difficile) и снижение колонизации кишечника бактериями Lactobacillus spp. [10, 11].
Отмечено, что при тяжелых формах колик изменяется
профиль жирных кислот — это также связано с лактобациллами.
Считается, что образование кишечных газов является одной из причин брюшного дискомфорта у младенцев, страдающих коликами. К главным газообразующим бактериям кишечной микрофлоры относятся Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca, Enterobacter aerogenes, Enterobacter cloacae и Enterococcus faecalis. Положительный эффект бактерий рода Lactobacillus объясняется ингибированием подобных газообразующих микроорганизмов кишечника [12].
Пробиотики при кишечной колике могут оказывать разнонаправленное действие: нормализовать микрофлору, улучшать моторику кишечника, подавлять рост патогенных микроорганизмов и усиливать барьерные функции кишечника. Пробиотики, оптимизируя микробиоценоз, одновременно корректируют другие звенья кишечного гомеостаза, связанные с микрофлорой. В клинической практике для лечения детских колик применяются бактерии рода Lactobacillus и рода Bifidobacterium. Раннее применение пребиотиков и пробиотиков у недоношенных детей может облегчать симптомы, связанные с младенческими коликами [13].
Известно, что микрофлора детей, находящихся на грудном вскармливании, значительно отличается от таковой у младенцев, получающих молочные смеси [14]. В случае раннего перевода ребенка на вскармливание искусственной смесью процесс становления микробиоценоза кишечника нарушается. Микрофлора кишечника искусственно вскармливаемых детей характеризуется повышенным содержанием бактероидов, энтеробактерий, а также более частым выделением представителей условно-
патогенной флоры на фоне снижения количества бифидобактерий.
С целью воссоздания бифидогенных свойств грудного молока производители обогащают молочные смеси комплексом пре- и пробиотиков. Согласно заключению Комитета нутрициологии ESPGHAN включение в состав молочных смесей пробиотиков (по отдельности или в комбинации) безопасно и может быть ассоциировано с рядом положительных клинических эффектов, таких как снижение риска неспецифических инфекций ЖКТ, снижение частоты применения антибиотиков и меньшая частота колик и раздражения кишки [15]. У младенцев, которые получали LGG-обогащенную формулу в течение 6 мес., наблюдались более значительное увеличение роста и веса и более высокая частота дефекации, чем в группе контроля [16].
Несмотря на то, что клинические данные преимущественно свидетельствуют об эффективности пробиотических препаратов у детей с функциональными нарушениями ЖКТ, подобные исследования имеют ряд ограничений (например, размер выборки, выборочные критерии включения детей), что не дает возможности однозначной рекомендации пробиотиков при данных видах патологий. Данные обстоятельства требуют проведения дальнейших исследований.
Цель настоящего ретроспективного фармакоэпидемиологического исследования — получение дополнительных клинических данных по особенностям применения пробиотических средств у детей раннего возраста с функциональными нарушениями ЖКТ.
Материал и методы
Проведен ретроспективный анализ случайно выбранных историй болезни пациентов в возрасте до 3 лет, обратившихся за медицинской помощью и проходивших амбулаторное лечение в 7 лечебных учреждениях г. Москвы с тремя группами диагнозов: I — младенческие кишечные колики и другие функциональные нарушения ЖКТ;
II — острые кишечные инфекции, ОРВИ с кишечными проявлениями, другие инфекционные заболевания; III — атопический дерматит и другие аллергические реакции.
Была сформирована база данных, включающая 502 истории болезни только тех детей, у которых были диагностированы нарушения микробиоценоза кишечника различной этиологии и присутствовали как минимум такие симптомы, как продолжительный плач и беспокойство в дневное и ночное время.
Сбор необходимых для исследования данных осуществлялся путем копирования соответствующей информации из истории болезни пациента в специально разработанную индивидуальную регистрационную карту (ИРК), в которую вносились клинико-эпидемиологические характеристики детей. Во избежание дублирования данных каждой ИРК присваивался уникальный идентификационный номер.
Критерии эффективности терапии. Эффективность терапии оценивалась по длительности симптомов заболевания (температура, диарея, рвота, боли в животе — колики, метеоризм, кожная сыпь и др.). Общая продолжительность болезни рассчитывалась как число полных дней с момента обращения к врачу до разрешения симптомов.
Дети были разделены на 3 группы в зависимости от назначенных им препаратов для ЖКТ или пробиотических продуктов:
1-я группа получала одно- и двухкомпонентные пробиотические препараты, содержащие до двух штаммов бактерий;
2-я группа получала пробиотические препараты, содержащие более двух штаммов бактерий каждый;
3-я группа не получала препараты с живыми пробиотическими бактериями, а получала другие симптоматические средства для лечения нарушений ЖКТ, например пеногасители и сорбенты.
Статистические методы. Размер выборки предварительно не рассчитывался. Данные из индивидуальных карт стационарных больных вносились в единую базу в MS Excel. Значения количественных признаков представляли в форме среднего со стандартным отклонением (M±SD) в случае нормального распределения значений или медианы и квартилей (2,5% и 97,5%). Нормальность распределения определяли по критерию Колмогорова — Смирнова. Достоверность различий средних значений определяли с использованием t-критерия для независимых выборок в случае нормального распределения значений и с применением непараметрического критерия Тьюки в иных случаях. Качественные признаки представляли в форме доли пациентов со значением данного признака от общего числа пациентов с известным значением данного признака. Доверительный интервал для доли пациентов определяли по методу Wald. Значения частоты качественных признаков в группах сравнивались с помощью критерия хи-квадрат (χ2). Достоверными считали различия при уровне значимости p≤0,05. При множественных сравнениях учитывалась поправка Бонферрони. Анализ данных проводили в пакете программ R-Studio version 1.2.1335. Результаты представлены в соответствии со стандартом STROBE. В данной работе не было условий, способных существенным образом повлиять на выводы. В связи с ретроспективным характером исследования диагнозы или патологические состояния определялись по имеющимся в медицинской документации сведениям.
Результаты исследования
Для анализа данных по детям с функциональными нарушениями ЖКТ в исследование было включено 259 историй болезни детей раннего возраста, мальчиков и девочек поровну. Абсолютное большинство детей — 92% — получали грудное вскармливание, на смешанном питании и на сухих смесях находились 6% и 2% детей соответственно. Продолжительность симптоматики до обращения к врачу в среднем составляла 2,08±2,39 сут, среднее время, в течение которого дети находились на амбулаторном наблюдении, — 8,89±4,48 сут. Общая клинико-эпидемиологическая характеристика пациентов, включенных в исследование, приведена в таблице 1.


Для оценки эффективности пробиотиков в комплексной терапии функциональных нарушений ЖКТ исследуемая когорта детей была систематизирована по составу принимаемых препаратов. Из общего числа пациентов, включенных в исследование, 37 младенцев получали пробиотики из группы лактобактерий, 28 — бифидобактерии, 110 — лакто- и бифидобактерии в комбинациях, 37 — препараты энтерококков, 6 — препараты сахаромицетов и 41 младенец получал различные препараты для симптоматического лечения нарушений ЖКТ (табл. 2).
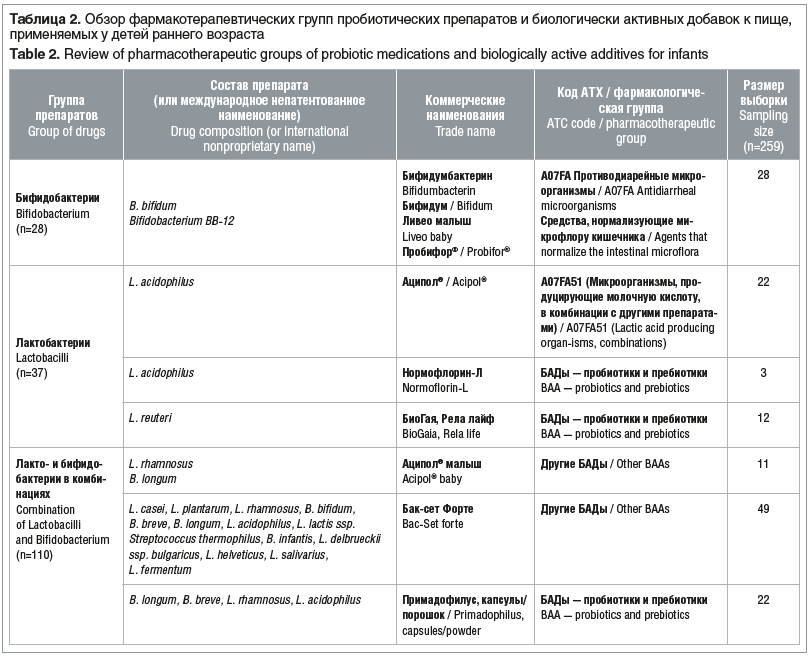
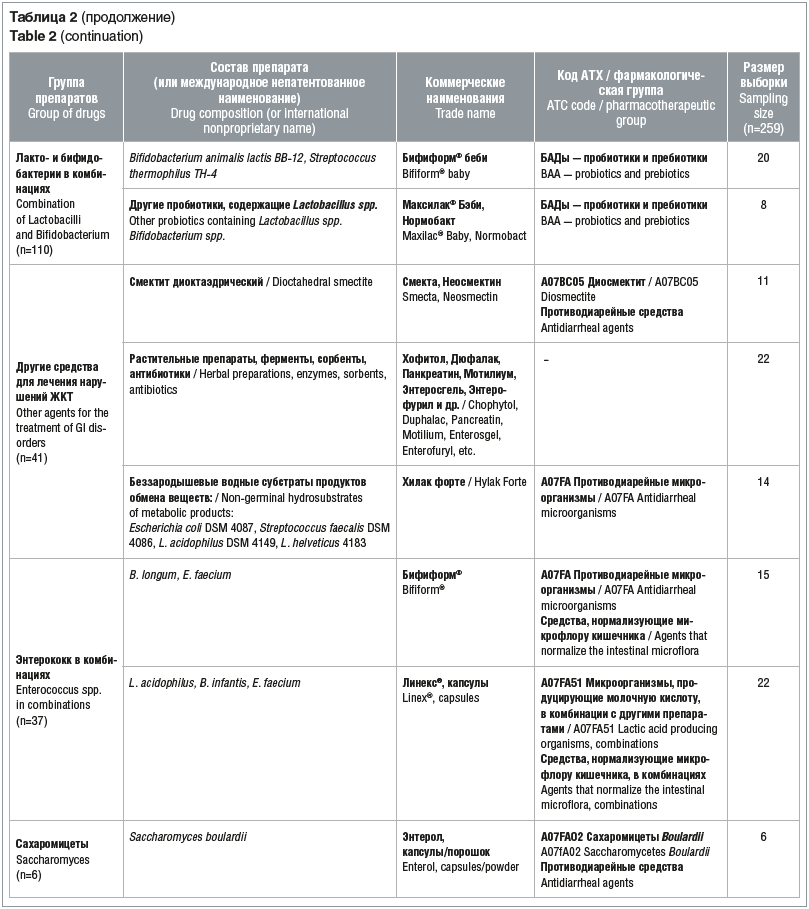
Наиболее частыми проявлениями нарушений со стороны ЖКТ были боли в животе, метеоризм, диарея и изменение консистенции стула (жидкий стул). У некоторых детей наблюдались атопические и аллергические реакции. Изменение продолжительности перечисленных симптомов рассматривалось в качестве основного показателя эффективности. Оценка эффективности различных пробиотиков представлена в таблице 3.

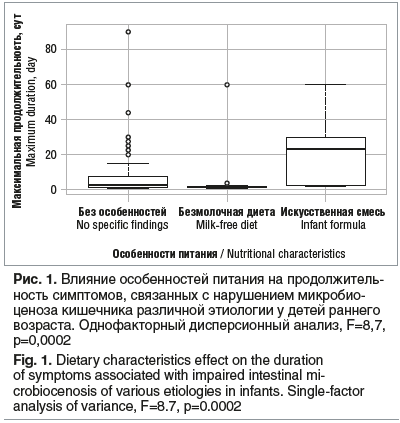
Оценка влияния характера питания на продолжительность симптомов, связанных с нарушением микробиоценоза кишечника, представлена на рисунке 1. Показано, что у младенцев на искусственном питании продолжительность симптомов была достоверно больше (p=0,0002).
Оценка эффективности пробиотиков в комплексной терапии различных состояний, связанных с дисбактериозом, не показала значимых различий по продолжительности основных симптомов между младенцами, принимавшими различные группы пробиотиков и другие средства для терапии нарушений ЖКТ. Однако по общей максимальной продолжительности симптомов наименьшее значение показали средства для лечения нарушений ЖКТ, не содержащие в своем составе пробиотических продуктов, продолжительность симптомов в этой группе отличалась от таковой в группе поликомпонентных пробиотических препаратов (p=0,0031), но не отличалась от таковой в группе одно- и двухкомпонентных пробиотических препаратов (p=0,15). При этом наблюдалась тенденция к различию между одно- и двухкомпонентными препаратами и поликомпонентными препаратами (p=0,08).
Обсуждение
Результаты ретроспективного исследования показали разнообразие субъективных и объективных симптомов заболеваний, связанных с нарушением микробиоты кишечника и требующих применения пробиотиков у детей. При этом первостепенную роль играет тип питания ребенка. Так, в данном исследовании показано, что питание детей, включающее сухие смеси, значительно увеличивает продолжительность симптомов функциональных нарушений ЖКТ.
Известно, что тип кормления играет определяющую роль при формировании микробиоты кишечника младенцев. Так, в исследовании Baђ ckhed et al. показано, что при грудном вскармливании в микробиоте кишечника младенца преобладают бактерии рода Bifidobacterium. Также отмечается, что к возрасту 4 мес. в кишечной микробиоте младенцев на естественном вскармливании преобладают Lactobacillus johnsonii, L. gasseri, L. paracasei, L. casei и B. longum, тогда как у детей на искусственном вскармливании повышено содержание условно-патогенных бактерий: Clostridium difficile, Granulicatella adiacens, Citrobacter spp., Enterobacter cloacae, Bilophila wadsworthia [17].
Последние исследования показывают терапевтическую эффективность пробиотиков при заболеваниях, ассоциированных с изменением микрофлоры и pH кишечника, при коликах у детей, находящихся преимущественно на грудном вскармливании [7]. Исследования свидетельствуют, что повышенная заселенность кишечника бактериями рода Lactobacillus и рода Bifidobacterium является фактором защиты от развития кишечных колик и связанного с ними плача у младенцев [18]. Подобный защитный эффект может быть обусловлен тем, что бактерии Lactobacillus способны индуцировать экспрессию противовоспалительных генов [19], улучшая тем самым моторику кишечника, что в итоге ведет к снижению боли [20, 21]. Помимо этого, бактерии рода Lactobacillus и рода Bifidobacterium могут предотвращать развитие колик посредством модуляции иммунного ответа [22]. Применение пробиотиков сокращает продолжительность плача у младенцев с коликами [23].
В функциональных нарушениях ЖКТ определенную роль играют ассоциированные со специфической микробиотой процессы альтерации кишечной моторики и состояния слизистой оболочки кишечника [24]. Это обусловливает необходимость проведения более специфической (таргетной) терапии детских колик определенными видами пробиотиков, что подтверждается руководящими рекомендациями Всемирной организации гастроэнтерологов [1].
В настоящее время на фармацевтическом рынке наблюдается тенденция к формированию пула пробиотиков, содержащих широкий спектр штаммов микроорганизмов. Считается, что использование полиштаммовых пробиотиков ассоциировано с рядом преимуществ по сравнению с моноштаммовыми продуктами: 1) больший шанс на успех положительного воздействия пробиотика; 2) более широкий спектр эффективности пробиотика; 3) создание условий для синергетического эффекта (повышение адгезивных свойств различных штаммов, создание благоприятной среды, снижение антагонизма эндогенной микробиоты). С другой стороны, негативным эффектом применения комплексных пробиотиков может стать явный антагонизм между комбинированными штаммами. Штаммы в таких пробиотических комплексах могут присутствовать в разном количестве, что с точки зрения контроля качества создает проблему адекватного учета количества жизнеспособных микроорганизмов на протяжении всего срока годности продукта [25].
Иногда применение пробиотиков не позволяет добиться эффективного результата проводимой терапии [26]. Это может быть связано с тем, что гетерогенность пробиотических бактерий для организма нового хозяина может служить препятствием к их включению в состав резидентной микрофлоры. Кроме того, отмечается рост числа побочных эффектов, особенно в сенсибилизированном организме, поскольку гетерогенная микробная масса препарата, а иногда и дополнительно включенные в его состав компоненты могут давать значительную антигенную нагрузку на организм [26].
В настоящее время изучается вопрос о возможности лабораторного прогнозирования результатов лечения пробиотиками. Известно, что пробиотические штаммы могут по-разному взаимодействовать с собственной микрофлорой кишечника. Известны механизмы, посредством которых пробиотические бактерии могут воздействовать на микробиоту человека. Эти механизмы включают: конкуренцию за питательные вещества в качестве субстратов для роста; биоконверсию; производство субстратов (например, витаминов) для роста других бактерий; прямой антагонизм (с помощью бактериоцинов); конкуренцию за связывание с кишечной стенкой; улучшение барьерной функции; уменьшение воспаления; стимуляцию врожденного иммунного ответа (механизмы до конца не известны) [27]. Индивидуальный подбор монокомпонентных пробиотиков путем тестирования упрощает прогнозирование результатов лечения. В случае же с поликомпонентным пробиотиком результат лечения трудно прогнозировать, так как суммировать взаимодействие штаммов препарата с аутохтонной флорой практически невозможно. Кроме того, в одном препарате положительное действие одних штаммов может сочетаться с угнетающим действием других штаммов на собственную микрофлору пациента.
Помимо этого, пробиотики могут вырабатывать биогенные амины (гистамин, тирамин, 2-фенилэтиламин, путресцин, кадаверин), высокие количества которых вызывают головную боль, учащенное сердцебиение, рвоту, диарею, гипертензивные кризы и другие негативные эффекты [28]. При этом чем больше в пробиотическом препарате штаммов, продуцирующих биогенные амины, тем больше вероятность возникновения побочных эффектов, которые при этом не всегда можно связать с приемом пробиотиков, но которые вызывают дискомфорт.
В недавнем систематическом обзоре и метаанализе сравнительной эффективности полиштаммовых и моноштаммовых пробиотиков было показано, что в большинстве случаев отдельные штаммы эквивалентны комбинациям [29]. Выбор подходящего пробиотика должен основываться не на количестве штаммов в продукте, а на результатах доказательных исследований препаратов.
Результаты нашего исследования согласуются с выводами, что одно- и двухкомпонентные пробиотики не уступают по эффективности и могут быть более предпочтительными по сравнению с комбинированными препаратами за счет тех недостатков у последних, которые перечислены выше.
Заключение
Комплексная терапия пробиотиками обоснована при широком спектре нозологий. Постоянно расширяется применение данных препаратов, открываются новые их возможности в терапии различных заболеваний. Однако, как было показано в данном исследовании, необходим рациональный подход к назначению таргетной терапии пробиотиками. Поликомпонентные пробиотические препараты не всегда обладают преимуществами по сравнению с монокомпонентными. Более того, они имеют ряд недостатков, таких как избыточная антигенная нагрузка на слизистую ЖКТ, конкурентное взаимодействие штаммов. В связи с этим при назначении пробиотической терапии функциональных нарушений ЖКТ у детей раннего возраста предпочтение следует отдавать монокомпонентным препаратам. В настоящее время наиболее эффективными при терапии функциональных нарушений ЖКТ у младенцев и других нарушений, связанных с дисбактериозом, считаются пробиотики, содержащие бактерии L. rhamnosus, L. reuteri, L. casei, L. bulgaricus, L. acidophilus, а также B. longum и B. animalis [30].
Благодарность
Авторы и редакция благодарят компанию АО «ОТИСИФАРМ» за предоставление полных текстов иностранных статей, требовавшихся для подготовки обзорной части данной публикации.
Acknowledgement
The authors and Editorial Board are grateful to «OTCPharm» JSC for providing full-text foreign articles required to write the review.
Сведения об авторах:
Блохин Борис Моисеевич — д.м.н., профессор, заведующий кафедрой поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-4762-5975.
Прохорова Анастасия Дмитриевна — ассистент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-9028-7791.
Лобушкова Ирина Павловна — к.м.н., доцент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-2690-676X.
Суюндукова Алия Сагитовна — к.м.н., доцент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-4369-4300.
Гордиенко Галина Иосифовна — к.м.н., доцент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-2966-6696.
Стешин Вадим Юрьевич — к.м.н., доцент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Мин-
здрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-2279-2577.
Кагирова Зарема Руслановна — ассистент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-9002-7909.
Мирзоев Тахир Ханафиевич — к.м.н., доцент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-3126-2380.
Мельникова Марина Анатольевна — к.м.н., ассистент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD ORCID iD 0000-0002-5342-622X.
Антипова Надежда Владимировна — ассистент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-6950-2584.
Контактная информация: Блохин Борис Моисеевич, e-mail: blokhinb@gmail.com. Конфликт интересов отсутствует. Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах. Статья поступила 14.09.2020, поступила после рецензирования 05.10.2020, принята в печать 19.10.2020.
About the authors:
Boris M. Blokhin — Dr. of Sci. (Med.), Professor, Head of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-4762-5975.
Anastasia D. Prokhorova — Assistant Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-9028-7791.
Irina P. Lobushkova — Cand. of Sci. (Med.), Associate Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-2690-676X.
Aliya S. Suyundukova — Cand. of Sci. (Med.), Associate Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-4369-4300.
Galina I. Gordiyenko — Cand. of Sci. (Med.), Associate Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-2966-6696.
Vadim Yu. Steshin — Cand. of Sci. (Med.), Associate Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-2279-2577.
Zarema R. Kagirova — Assistant Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-9002-7909.
Takhir Kh. Mirzoev — Cand. of Sci. (Med.), Associate Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-3126-2380.
Marina A. Melnikova — Cand. of Sci. (Med.), Assistant Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-5342-622X.
Nadezhda V. Antipova — Assistant Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-6950-2584.
Contact information: Boris M. Blokhin, e-mail: blokhinb@gmail.com. There is no conflict of interest. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. Received 14.09.2020, revised 05.10.2020, accepted 19.10.2020.
.
Информация с rmj.ru