Содержание статьи
Введение
Лечение ревматоидного артрита (РА) в XXI в. претерпело кардинальные изменения.. С внедрением в клиническую практику генно-инженерных биологических препаратов (ГИБП) реализуется основной принцип стратегии лечения РА — лечение до достижения цели (Treat to Target) [1]. Главной целью лечения в соответствии с этой стратегией является достижение ремиссии, а альтернативной целью — достижение низкой активности заболевания в течение 6 мес. у каждого больного. Без использования ГИБП поставить такую цель в лечении РА было невозможно. Хотя следует отметить, что при раннем назначении в соответствии с современными зарубежными и отечественными рекомендациями [2–4] классических синтетических базисных противовоспалительных препаратов (ксБПВП), якорным среди которых является метотрексат (МТ), и контроле лечения можно добиться ремиссии, но, как правило (по данным различных авторов, от 24% до 70% случаев), позже 6 мес. [5–7]. В таких случаях при лечении РА показана коррекция терапии: при отсутствии прогностически неблагоприятных факторов (стабильно умеренная или высокая активность заболевания, быстрое развитие нарушений функции суставов и их эрозии, большое число припухших суставов, появление системных поражений, устойчиво высокая концентрация ревматоидного фактора и антител к циклическому цитруллинированному пептиду) используются другие ксБПВП, а больным с неблагоприятным прогнозом показано назначение ГИБП или таргетных синтетических БПВП (тсБПВП).
Первыми ГИБП, используемыми в клинике, были ингибиторы фактора некроза опухоли-α (иФНО-α). Цитокин ФНО-α — один из наиболее изученных провоспалительных цитокинов [8, 9], связь его с мембранными рецепторами различного молекулярного веса (75 Kd и 55 Kd) вызывает активацию факторов транскрипции с последующим изменением активности ряда генов, что приводит к синтезу медиаторов воспаления [10]. В настоящее время зарегистрировано 5 иФНО-α (иФНО-α), 4 из которых являются моноклональными антителами (инфликсимаб, адалимумаб, голимумаб и цертолизумаб пэгол), тогда как этанерцепт не имеет Fab-фрагмента, вместо которого расположен рецептор ФНО, соединенный с Fc-фрагментом IgG1 человека [11]. Подобного рода изменение в структуре белка имеет важное клиническое значение, поскольку у рецептора и Fc-фрагмента практически нет антигенных детерминант, что объясняет крайне редкую сенсибилизацию организма к этанерцепту.. Fab-фрагмент классических моноклональных антител содержит гипервариабельные области, положение и происхождение которых стимулируют выработку антител к препарату (АТП).
Эффективность и безопасность этанерцепта при РА
Этанерцепт был первым ГИБП, одобренным в 1998 г.. для применения в клинической практике. Его эффективность при раннем и развернутом РА была доказана во множестве рандомизированных клинических исследований (РКИ), обобщена в многочисленных систематических обзорах и метаанализах [12–14]. Была определена оптимальная доза этанерцепта (25 мг 2 р/нед. или 50 мг 1 р/нед..), которая позволяет достичь оптимальной равновесной концентрации препарата, сохраняющейся в течение всего периода лечения [15]. В исследованиях TEMPO [16] и COMET [17] продемонстрирована более высокая эффективность этанерцепта в комбинации с МТ, чем в монотерапии, степень подавления активности и прогрессирования РА возрастает при использовании более высоких доз МТ [18]. По данным метаанализа 2019 г., обобщившего клинический опыт 27 клинических исследований по 10 препаратам активной терапии, среди которых 8 ГИБП (абатацепт, адалимумаб, анакинра, голимумаб, инфликсимаб, цертолизумаб пэгол, этанерцепт, тоцилизумаб) и 2 ингибитора JAK (барицитиниб, тофацитиниб), был проведен сравнительный анализ эффективности по критериям ACR50, выявивший наибольшее снижение активности РА на фоне применения этанерцепта [19].
Этанерцепт в комбинации с МТ надежно подавляет прогрессирование РА: количество больных без прогрессирования при лечении более года достигает 90% [17]. Частота достижения ремиссии, по данным РКИ, после года терапии комбинацией этанерцепта и МТ составляла 50% [17], продолжение комбинированного лечения более года позволило сохранить ремиссию у 85,2% больных, а при отмене МТ (монотерапия этанерцептом между 52-й и 104-й неделями) ремиссия сохранялась у 69,8% больных (р=0,077) [20]. При изучении безопасности терапии этанерцептом, по данным РКИ, национальных регистров и постмаркетинговых наблюдений, было показано, что он реже других иФНО-a способствует развитию инфекционных осложнений, особенно оппортунистических инфекций, и обладает в целом хорошей переносимостью [21–23]. При сравнительной оценке частоты случаев туберкулеза (ТБ) после внедрения рекомендаций по скринингу и контролю за ТБ-инфекцией было выявлено 10 (0,21%) случаев среди 4590 пациентов в 16 РКИ инфликсимаба, 9 (0,12%) случаев среди 7009 пациентов в 21 РКИ адалимумаба и 4 (0,05%) случая среди 7741 пациента в 26 РКИ этанерцепта [21].
Хотя иФНО-α не различаются по противовоспалительной эффективности, развитие вторичной неэффективности чаще отмечается при использовании моноклональных антител, особенно химерного препарата инфликсимаба.. По данным национальных регистров Дании (DANBIO) [24] и Италии (GISEA) [25], лечение этанерцептом сопровождалось меньшим риском отмены из-за неэффективности или непереносимости, чем лечение инфликсимабом или адалимумабом, а продолжительность лечения этанерцептом была достоверно большей (p<0,01). Отмечена стабильная эффективность этанерцепта в сроки до 10 лет как при раннем, так и при развернутом РА [26]. Иммуногенность при лечении иФНО-α, вызванная выработкой АТП, во многих случаях служит причиной прекращения лечения из-за неэффективности или развития нежелательных реакций (НР) (рис. 1) [27, 28]. Это объясняет высокую 12-летнюю выживаемость терапии, отмеченную в итальянском регистре, при применении этанерцепта — 60,2%, тогда как для моноклональных антител (инфликсимаба и адалимумаба) она не превышала 20% [29].
![Рис. 1. Ключевые направления последствий иммуногенности [27, 28] Рис. 1. Ключевые направления последствий иммуногенности [27, 28]](https://medblog.su/wp-content/uploads/2021/12/etanertsept-i-ego-bioanalog-v-lechenii-revmatoidnogo-artrita-effektivnost-i-bezopasnost-chichasova-n-v-lila-a-m.png)
В систематическом обзоре, включившем 394 исследования (443 публикации) [30], приводятся данные о том, что нейтрализующие АТП выявлялись нередко при лечении такими иФНО-α, как адалимумаб, инфликсимаб, голимумаб, цертолизумаб пэгол, но очень редко при использовании этанерцепта.. У пациентов с наличием АТП биологические концентрации ГИБП в сыворотке крови были ниже, чем у пациентов без АТП, для адалимумаба (гуманизированная молекула) и инфликсимаба (химерная молекула) эти различия были статистически значимыми. До 50% пациентов, получающих адалимумаб и инфликсимаб, имеют АТП [30]. Этанерцепт содержит только человеческий протеин — рецептор к ФНО вместо Fab-фрагмента с гипервариабельными областями, поэтому отличается низкой иммуногенностью [31]. Это, наряду с высокой клинической эффективностью, дает возможность применения препарата в монотерапии (без ксБПВП), что важно для больных, не переносящих ксБПВП. Безусловно, на иммуногенность, помимо молекулярной структуры препарата, могут оказывать влияние различные факторы: сопутствующее применение МТ или других иммуносупрессивных/антипролиферативных препаратов, профили гликозилирования, ферментации, очистки, рецептуры (образование агрегатов), режим введения (внутримышечно, подкожно и внутривенно), дозирование, продукты деградации и примеси, а также пол пациента, этническая принадлежность, сопутствующие заболевания [30, 32]. Частота образования АТП значительно различается при разных нозологических формах (табл. 1) [27, 30].
![Таблица 1. Частота образования АТП [27, 30] Таблица 1. Частота образования АТП [27, 30]](https://medblog.su/wp-content/uploads/2021/12/1639011252_776_etanertsept-i-ego-bioanalog-v-lechenii-revmatoidnogo-artrita-effektivnost-i-bezopasnost-chichasova-n-v-lila-a-m.png)
Наибольшая частота образования АТП выявляется при применении ГИБП у больных РА, исключение — инфликсимаб. Частота образования АТП к нему высока и при серонегативных артропатиях. Минимальная частота выработки АТП отмечена на фоне применения этанерцепта.. Фармакокинетические характеристики этанерцепта не зависят от пола и возраста пациентов, наличия сопутствующего нарушения функции почек или печеночной недостаточности, лекарственных взаимодействий [33], что определяет возможность применения его у большого контингента больных..
Весьма значимыми для клинической практики являются результаты исследования PRESERVE [34]. В этом исследовании были не только выделены предикторы статистически значимого (p<0,05) увеличения шанса достижения и удержания ремиссии в течение 36 мес. при лечении этанерцептом, но и показано, что уменьшение дозы этанерцепта вдвое позволяет сохранить ремиссию с такой же частотой, что при лечении полной дозой. Такие же данные получены в ряде других исследований [35]. Когортное исследование 2020 г., в которое помимо пациентов, получающих этанерцепт, были включены пациенты, получающие три других иФНО-α (адалимумаб, инфликсимаб или голимумаб), показало схожие результаты по частоте достижения ремиссии на этанерцепте — 77%, что оказалось лучшей терапевтической опцией. Этанерцепт в дозе 50 мг/нед. подкожно чаще других препаратов способствовал не только достижению ремиссии, но и снятию инвалидности (у 62% больных) при самой низкой частоте НР среди других иФНО-α [36].
Биоаналоги этанерцепта
Внедрение в клиническую практику биоаналогов ГИБП позволяет снизить стоимость лечения и увеличить доступность оптимальной терапии для больных ревматическими заболеваниями [37]. В соответствии с современными зарубежными и отечественными рекомендациями [2–4] биосимиляры, одобренные регуляторными органами, включены в класс ГИБП наравне с оригинальными препаратами и являются взаимозаменяемыми..
В 2020 г. в РФ был зарегистрирован биоаналог этанерцепта (первый европейского производства биоаналог в ревматологии) — Эрелзи® (регистрационный номер ЛП-006650). В исследовании с участием здоровых добровольцев (n=54) были оценены фармакокинетика и безопасность биосимиляра GP2015 (Эрелзи®) в сравнении с оригинальным этанерцептом [38]. Показатели фармакокинетики биосимиляра признаются аналогичными показателям оригинального препарата, если 90% доверительные интервалы (ДИ) для отношения геометрических средних их фармакокинетических параметров полностью находятся в пределах биоэквивалентности: 0,80–1,25. Фармакокинетические параметры Эрелзи® по отношению к оригинальному препарату находились в данных пределах: среднее соотношение геометрических средних для максимальной концентрации в сыворотке крови (Сmax) составило 1,11 (90% ДИ 1,05–1,17), площадь под фармакокинетической кривой «концентрация — время» от начального момента времени до последней определяемой концентрации в точке t (AUC0-t(last))— 0,98 (90% ДИ 0,94–1,02) и площадь под фармакокинетической кривой «концентрация — время» от начального момента времени до бесконечности (AUC0-∞) — 0,96 (90% ДИ 0,93–1,00) [38].
В многоцентровое рандомизированное двойное слепое клиническое исследование EQUIRA, в котором приняли участие 16 стран, в том числе Россия, было включено 376 пациентов с умеренной и высокой активностью РА (DAS28≥3,2) [39, 40]. Больные были рандомизированы в соотношении 1:1 для получения подкожных инъекций референсным препаратом или биоаналогом в дозе 50 мг 1 р/нед. в течение 24 нед. (период лечения 1). Пациенты из обеих групп, у которых на 24-й неделе отмечался по меньшей мере умеренный ответ по критериям Европейской лиги против ревматизма (The European Alliance of Associations for Rheumatology, EULAR), далее получали биоаналог до 48-й недели (период лечения 2) с целью сравнения эффективности, безопасности и иммуногенности между переключенными и продолжившими терапию больными. Все пациенты продолжали сопутствующее лечение МТ в стабильной дозе (10–25 мг/нед.) до конца исследования..
Группы больных были сопоставимы по демографическим, клиническим, лабораторным параметрам и вариантам предшествующей терапии (табл. 2).
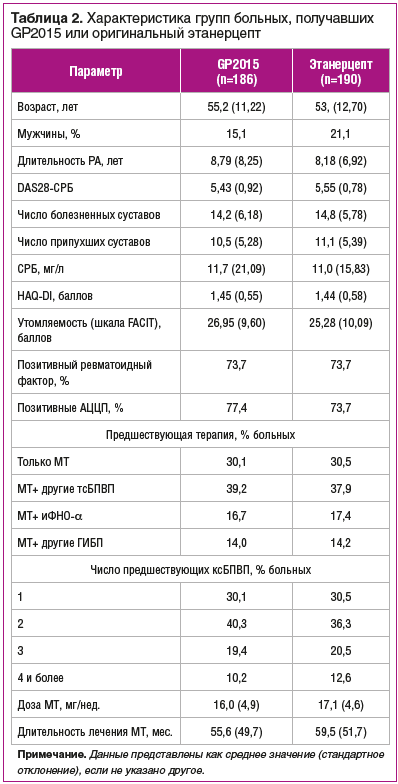
Маркером оценки первичной конечной точки было изменение DAS28-СРБ, дополнительные точки — частота ответа по критериям EULAR и частота достижения 20, 50 и 70% улучшения по критериям ACR. Оценка безопасности включала регистрацию НР и местной переносимости инъекций обоих препаратов. Оценка иммуногенности проводилась путем анализа АТП за 48 нед. с использованием подтвержденного скрининга, подтверждения и определения титра методом электрохемилюминесцентного анализа. За первые 24 нед.. исследования показана равная эффективность биоаналога Эрелзи® с оригинальным этанерцептом по динамике индекса активности DAS28-СРБ: уменьшение DAS28-СРБ через 4 нед. составило -1,62 на GP2015и -1,67 на этанерцепте; через 12 нед. — -2,27 и 2,17; через 24 нед. — -2,8 и -2,73 соответственно. Такие же результаты отмечены и по частоте достижения 20, 50, 70% улучшения по критериям ACR (рис. 2) [39, 41].
![Рис. 2. Частота достижения ACR20, ACR50 и ACR70 к 24-й неделе лечения препаратом Эрелзи® или оригинальным этанерцептом [39, 41] Рис. 2. Частота достижения ACR20, ACR50 и ACR70 к 24-й неделе лечения препаратом Эрелзи® или оригинальным этанерцептом [39, 41]](https://medblog.su/wp-content/uploads/2021/12/1639011252_411_etanertsept-i-ego-bioanalog-v-lechenii-revmatoidnogo-artrita-effektivnost-i-bezopasnost-chichasova-n-v-lila-a-m.png)
Закончили 24-недельное исследование 181 пациент, получавший исследуемый биоаналог, и 172 пациента, получавших этанерцепт.. Во втором периоде исследования пациенты, достигшие умеренного и хорошего ответа по критериям EULAR на фоне оригинального этанерцепта, были переведены на биоаналог и продолжили лечение до 48 нед. [40]. Проведен сравнительный анализ динамики DAS28-СРБ, частоты достижения эффекта по критериям EULAR и ACR в группе больных, продолжавших прием биоаналога, и больных, переведенных с оригинального этанерцепта на биоаналог. Перевод с этанерцепта на биоаналог не сопровождался снижением эффективности, так как уменьшение DAS28-СРБ за 48 нед. составило при продолжении лечения биоаналогом -2,9 балла, при переводе с этанерцепта на биоаналог — -2,78 балла (рис. 3); частота достижения хорошего/умеренного эффекта по критериям EULAR составила 54,4%/41,5% при продолжении приема биоаналога и 51,9%/44,2% в группе перевода с оригинального препарата на биоаналог; также сопоставимой была частота достижения 20, 50 и 70% улучшения по критериям ACR [39, 41].
![Рис. 3. Изменение DAS28-СРБ в обеих группах терапии этанерцептом [39, 41] Рис. 3. Изменение DAS28-СРБ в обеих группах терапии этанерцептом [39, 41]](https://medblog.su/wp-content/uploads/2021/12/1639011253_883_etanertsept-i-ego-bioanalog-v-lechenii-revmatoidnogo-artrita-effektivnost-i-bezopasnost-chichasova-n-v-lila-a-m.png)
Анализ безопасности показал сопоставимую переносимость биоаналога и оригинального этанерцепта за 24 нед. [39]. В группах биоаналога и оригинального препарата частота назофарингита составила 4,8% и 2,1%, повышения активности аминотрансфераз — 4,3% и 2,1%, инфекций мочевыводящих путей — 4,3% и 4,2%, респираторных инфекций — 3,2% и 3,7%, диареи — 1,6% и 2,1%, бронхита — 1,1% и 2,1%, цистита — 1,1% и 2,1% соответственно.. О реакциях в местах инъекций сообщалось у меньшего числа пациентов в группе биоаналога(13 [7,0%]) по сравнению с группой оригинального этанерцепта (35 [18,4%]), все они были легкими или умеренными по степени интенсивности и не относились к серьезным НР.
Перевод с оригинального этанерцепта на биоаналог не сопровождался нарастанием частоты НР или появлением новых НР. А иммуногенность биоаналога была значимо ниже, чем оригинального препарата: АТП на 2–12-й неделях лечения в низких титрах определялись на биоаналоге в 1,6% и на оригинальном этанерцепте в 22,7% случаев. Нейтрализующие АТП на фоне применения биоаналога не выявлялись, на фоне оригинального этанерцепта на 4-й и 12-й неделе были выявлены у 1,6% и 0,6% больных соответственно. Переключение с этанерцепта на Эрелзи® не сопровождалось появлением нейтрализующих АТП (как нейтрализующих, так и ненейтрализующих) [40].
Сопоставимая эффективность и безопасность Эрелзи® с оригинальным препаратом этанерцептом была показана также в РКИ EGALITY у 531 больного среднетяжелым псориазом в течение 52 нед. [42]. Исследование дает представление об эффективности и безопасности терапии у пациентов без сопутствующей терапии МТ. Помимо этого, интерес вызывает дизайн этого РКИ, включающий множественное (тройное) переключение с оригинального этанерцепта на биоаналог Эрелзи® и обратно, при этом никаких различий в безопасности или эффективности между группами исследования после таких переходов не отмечали. Спланированный множественный переход не отразился на частоте формирования АТП, при этом качественно антитела не были нейтрализующими.
Данные исследования EQUIRA (рандомизированного двойного слепого исследования III фазы) в параллельных группах продолжительностью 48 нед. показали равнозначную эффективность и переносимость биоаналога по сравнению с оригинальным этанерцептом. Хороший ответ по критериям EULAR на 4-й неделе исследования зарегистрирован у 15,6% больных на фоне применения биоаналога и у 13,6% больных на фоне применения оригинального этанерцепта.. Более половины больных, получавших биоаналог, достигли хорошего ответа по критериям EULAR к 24-й неделе, и этот эффект сохранялся при переключении с оригинального препарата на биоаналог. Применение биоаналога не сопровождается большей частотой развития НР, чем при лечении оригинальным этанерцептом, спектр НР при этом сопоставим. И оригинальный этанерцепт, и его биоаналог показали низкую иммуногенность, что предполагает возможность длительного лечения больных РА без «ускользания» эффекта. Исследования EQUIRA и EGALITY подтверждают, что простое переключение с оригинального препарата на его биоаналог является безопасным и эффективным, как это было сформулировано в основанных на мнении экспертов рекомендациях EULAR [37]. Более того, опубликованы данные анализа 477 случаев, которые показали, что пациенты, переключенные с референтного этанерцепта на биоаналоги, в целом чаще продолжали лечение по сравнению с бионаивными пациентами [43]. Выживаемость терапии за 12 мес. лечения составила 81,2% для пациентов, переключенных на биоаналоги этанерцепта с оригинального препарата, и значимо меньше (70,8%) у бионаивных пациентов (p=0,036). При этом общая частота удержания на препарате как в течение 6 мес., так и в течение 12 мес. была сопоставимой у биоаналогов и референтного этанерцепта.. Накопленный опыт использования биоаналогов за рубежом и в РФ свидетельствует о сохранении клинического эффекта после однократного переключения с оригинального ГИБП. В последнее время появляется все больше работ, целью которых является анализ выживаемости терапии после сценария множественных замен. Одна из наблюдательных программ показывает высокий уровень выживаемости терапии биоаналогом этанерцепта, через 6 мес. после второго переключения удержание на препарате составило 89% [44].
Заключение
Регистрация биоаналогов оргинальных ГИБП проводится после предоставления данных РКИ по идентичности биоаналога референтному препарату по физико-химическим свойствам, фармакокинетике и фармакодинамике, эффективности, безопасности и иммуногенности, что предполагает взаимозаменяемость оригинального ГИБП и его биоаналога. Апробация биоаналогов проводится с участием меньшего количества больных и в меньшие сроки, что позволяет дополнительно уменьшить стоимость препарата и, соответственно, увеличить доступность терапии для большего количества больных. Все более широкое внедрение в клиническую практику биоаналогов оригинальных ГИБП предполагает тщательный анализ течения болезни, а также доверительный контакт между врачом и пациентом при переключениях с одного препарата на другой и возрастание роли регистров больных.. Появление биоаналогов позволяет здравоохранению охватить большее количество пациентов за счет снижения затрат на терапию.
Благодарность
Редакция благодарит компанию «Сандоз» за оказанную помощь в технической редактуре настоящей публикации.
.
Информация с rmj.ru




