Введение
Биоценоз влагалища представляет собой микроэкосистему, особенности которой определяются как вагинальной микрофлорой, так и анатомическим строением, гистологической структурой слизистой оболочки, биологическими свойствами влагалищной жидкости [1]. Нормальная микрофлора влагалища включает облигатные, факультативные и транзиторные микроорганизмы; облигатные микроорганизмы препятствуют развитию патогенных микроорганизмов. В облигатной микрофлоре влагалища преобладают Lactobacillus, включая L. crispatus, L. gasseri, L. iners и L. jensenii. Менструация, беременность, половая жизнь, сахарный диабет, применение ряда лекарственных препаратов, в том числе антибиотиков, и спринцевание влагалища могут нарушать микрофлору влагалища [1–4].
Известно, что антибиотики широкого спектра действия подавляют не только патогенные бактерии, но и Lactobacillus микрофлоры влагалища, при этом возникают благоприятные условия для активного размножения Candida [5]. Частота возникновения вульвовагинального кандидоза после применения антибиотиков варьирует от 28% до 33% [4]. В исследовании J. Yano et al. [6] из 284 опрошенных женщин у 78% в анамнезе были эпизоды вульвовагинального кандидоза, у 34% женщин вульвовагинальный кандидоз имел рецидивирующий характер, при этом среди факторов риска вульвовагинального кандидоза на первом месте было применение антибиотиков (37,8%), а половой акт и гормональные изменения (беременность, прием оральных контрацептивов, гормональная заместительная терапия) находились на втором и третьем местах (21,6% и 13,7% соответственно).
Таким образом, представляется перспективным проведение профилактики возникновения нарушений микрофлоры влагалища при назначении системной антибактериальной терапии (АБТ).
Цель исследования: оценить эффективность и безопасность препарата Экофуцин® у пациенток, которым выполнялись плановые хирургические гинекологические вмешательства, на основании динамики состояния микробиоценоза влагалища по результатам клинических, микробиологических и молекулярно-генетических исследований на фоне применения системной АБТ.
Материал и методы
Проведено проспективное открытое рандомизированное сравнительное клиническое исследование в параллельных группах. Исследование проводилось в соответствии с принципами, изложенными в Хельсинкской декларации ВМА. Исследование было одобрено независимым этическим комитетом, пациентки подписывали информированное согласие.
Критерии включения: письменное информированное согласие на участие в исследовании; возраст женщин от 18 лет до 45 лет включительно; проведение плановых хирургических вмешательств (например, миомэктомии), при которых показана системная АБТ в течение не менее 6 дней; использование барьерных методов контрацепции партнером пациентки после проведения лечения для исключения реинфицирования в ходе исследования; способность к регулярному применению исследуемого препарата и препаратов АБТ и способность к следованию процедурам протокола; отсутствие клинических симптомов кандидозно-бактериального дисбиоза на скрининге.
Критерии невключения: беременность; непереносимость натамицина, лактулозы или любого из компонентов исследуемых препаратов; хронические воспалительные, атрофические либо онкологические заболевания женских половых органов; прием системной противогрибковой или антибактериальной терапии, включая натамицин, в течение 60 дней до включения в исследование; оперативные вмешательства на наружных либо внутренних половых органах, в результате которых невозможно применять исследуемый препарат; роды (естественные или оперативные) в течение 12 мес. до включения в исследование; аборты (спонтанные либо искусственные) в течение 6 мес. до включения в исследование; сахарный диабет; подтвержденный врожденный или приобретенный иммунодефицит; наличие любого онкологического заболевания в течение 3 лет до включения в исследование, за исключением полностью излеченного cancer in situ; наличие острой и/или хронической сопутствующей патологии, которая могла существенно повлиять на безопасность участия пациентки в исследовании; прием пробиотиков или пребиотиков на скрининге; участие в другом клиническом исследовании в течение последних 30 дней до скрининга.
По итогам скрининга и при подтверждении критериев включения и отсутствии критериев невключения 79 пациенток рандомизировали методом простых чисел в 2 группы. В 1-й группе (n=39) пациентки получали системную АБТ и применяли препарат Экофуцин®, во 2-й группе (n=40) — только системную АБТ.
Вагинальные суппозитории Экофуцин®, содержащие натамицина 100 мг и вспомогательное вещество лактулозу, вводили интравагинально 1 р/сут на ночь в течение 12 дней, начиная за 6 дней до плановой операции и начала АБТ. АБТ включала цефотаксим по 1 г в/м 3 р/сут в течение 6 дней и метронидазол по 500 мг в/в 3 р/сут в течение 3 дней.
Контроль излечения и дополнительные исследования проводили на следующий день после завершения АБТ и применения исследуемого препарата Экофуцин® (т. е. на 13-й день от начала применения исследуемого препарата) и через 30±2 дня от начала применения исследуемого препарата — для контроля возникновения рецидива.
Для оценки эффективности проводили сбор жалоб, физикальный и гинекологический осмотр (оценка общих и местных симптомов), а также микробиологический анализ отделяемого из влагалища. Состав биоценоза влагалища оценивали двумя методами: культуральным (посев) (содержание Candida, бифидобактерий и лактобацилл) и молекулярно-генетическим (проведение теста Фемофлор-13: Lactobacillus spp., Gardnerella vaginalis + Prevotella bivia + Porhyromonas spp., Mycoplasma hominis, Mycoplasma genitalium, Candida spр, Ureaplasma spp., вирус простого герпеса 1-го и 2-го типов, цитомегаловирус, Neisseria gonorrhoeae, Trichomonas vaginalis, Chlamidya trachomatis, общая бактериальная масса).
Основным параметром эффективности являлась частота возникновения клинических признаков дисбиоза влагалища через 30±2 дня после начала применения исследуемого препарата; дополнительными параметрами эффективности являлись частота возникновения клинических признаков дисбиоза влагалища на 13-й день после применения исследуемого препарата, т. е. по завершении АБТ, изменение содержания лакто- и бифидобактерий в вагинальном содержимом и степень чистоты влагалища на 13-й и 30±2 дня после начала терапии исследуемым препаратом.
Безопасность исследуемой терапии оценивали путем выявления и регистрации всех возможных нежелательных явлений (НЯ), развившихся у пациенток. Оценка безопасности включала в себя определение частоты развития любых НЯ, частоты развития НЯ на фоне местной терапии, частоты развития НЯ, потребовавших отмены и/или замены схемы лечения, частоты случаев неэффективности, потребовавших замены комбинированной схемы лечения.
Все данные, полученные в группах до начала применения исследуемого препарата (демографические, лабораторные данные, данные инструментальных и физикальных методов исследования, показатели жизнедеятельности и т. п.), сравнивались с целью определения сопоставимости групп для анализа.
Количественные переменные проверяли на соответствие нормальному распределению с помощью критерия Шапиро — Уилка. Для сравнения количественных данных использовали непараметрические критерии (U-критерий Манна — Уитни, T-критерий Вилкоксона для независимых выборок, критерий Фридмана для зависимых выборок). Сравнение частот показателей в группах лечения проводили c помощью точного критерия Фишера. Различия считали статистически значимыми при p<0,05.
Результаты исследования
В исследование включено 79 пациенток в возрасте от 22 до 43 лет (Me 35 [30, 37] лет). Во 2-й группе у 6 пациенток результаты ПЦР-теста Фемофлор-13 до начала лечения указывали на наличие дисбиотических нарушений среды влагалища при отсутствии клинических симптомов. У одной пациентки контрольные показатели качества забора материала для теста Фемофлор-13 показали непригодность биологических образцов для исследования. Таким образом, из анализа эффективности были исключены 7 пациенток 2-й группы. Эффективность терапии оценивали для 72 пациенток, безопасность — для 79 пациенток.
Сразу после завершения АБТ (день 13) и спустя 30 дней после ее начала (день 30±2) соответственно у 6 и 7 женщин из 2-й группы отмечались жалобы, характерные для кандидозно-бактериального дисбиоза влагалища (рис. 1). В 1-й группе ни у одной из пациенток указанных симптомов отмечено не было, т. е. симптомы статистически значимо чаще встречались у пациенток из 2-й группы (F=0,107, р=0,007).
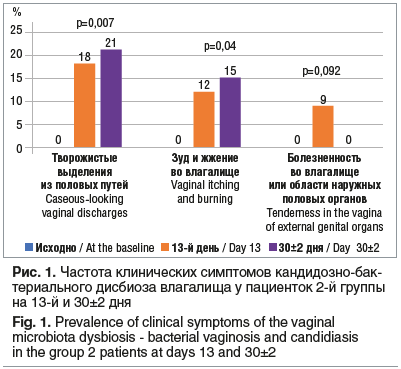
Исходно группы были однородны по результатам культурального исследования отделяемого из влагалища. В то же время у пациенток 2-й группы Candida spp. выявлялась в 22,5% случаев в дни 13 и 30±2 (в обоих случаях F=0,125; р=0,002 по сравнению с показателем в 1-й группе, в которой Candida spp. не определялась ни в одной из контрольных точек).
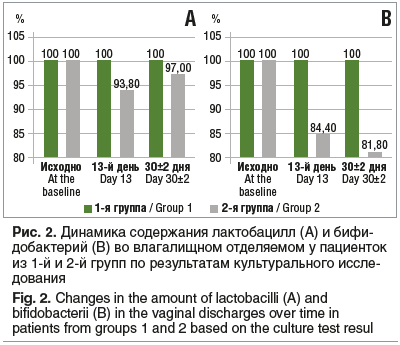
Динамика содержания лактобацилл во влагалищном отделяемом у пациенток из обеих групп представлена на рисунке 2. В 1-й группе у 100% пациенток во всех контрольных точках определялись и лактобациллы, и бифидобактерии. Во 2-й группе в дни 13 и 30±2 лактобациллы обнаруживали у 30 (93,8%) из 32 и 32 (97%) из 33 пациенток соответственно (F=0,035, p=0,2; F=0,017, p=0,458). Бифидобактерии обнаруживали у 27 (84,4%) из 32 и 27 (81,1%) из 33 пациенток из 2-й группы (F=0,092, р=0,016; F=0,107, р=0,007 соответственно); данные посева на 13-й день для 1 пациентки из 2-й группы отсутствовали.
По данным молекулярно-генетического исследования с применением теста Фемофлор-13 у женщин 1-й группы сохранялось высокое содержание лактобацилл в отделяемом влагалища, сопоставимое с исходным. У пациенток 2-й группы выявили статистически значимое влияние АБТ на содержание лактобацилл в отделяемом влагалища (р=0,014). Применение молекулярно-генетического метода исследования показало сходные с культуральным методом результаты по содержанию дрожжеподобных грибов рода Candida в отделяемом влагалища. В 1-й группе ни у одной пациентки в течение всего периода наблюдения не определялась ДНК Candida spp. во всех временных точках исследования. Во 2-й группе, начиная с 13-го дня, у 22,5% пациенток обнаруживалась Candida spp. (р=0,002 по сравнению с показателями в 1-й группе на обоих сроках). У женщин 1-й группы содержание облигатно-анаэробных микроорганизмов (Gardnerella vaginalis + Prevotella bivia + Porhyromonas spp.) имело тенденцию к уменьшению в процессе исследования, во 2-й группе — к увеличению.
Ни у кого из пациенток НЯ не зарегистрировано. Развитие кандидозно-бактериального дисбиоза влагалища не расценивалось как НЯ, так как являлось параметром эффективности. Ни в одном случае не потребовалось смены лечения, не возникало острых заболеваний или состояний, которые потребовали бы исключения пациентки из исследования.
Обсуждение
Таким образом, нами показана эффективность и безопасность применения лекарственного препарата Экофуцин® в виде вагинальных суппозиториев, содержащих натамицин и лактулозу. Натамицин — полиеновый амфотерный макролидный антибиотик с противогрибковыми свойствами. Важно, что резистентность к натамицину в клинической практике не встречается [7]. Он оказывает противогрибковое действие, связываясь со стеролами в мембране грибковой клетки, что ведет к увеличению проницаемости клеточной мембраны, нарушению ее целостности и функции и в итоге к гибели микроорганизма. Натамицин активен в отношении различных грибов, включая Candida, Aspergillus, Cephalosporium, Fusarium и Penicillium. Хотя активность против грибов зависит от дозы, натамицин обладает преимущественно фунгицидным действием. Натамицин in vitro не эффективен против грамположительных или грамотрицательных бактерий. Натамицин практически не всасывается через интактные слизистые оболочки [8] и в форме суппозиториев вагинальных широко применяется в гинекологии для лечения кандидозного вагинита/вульвовагинита [9].
Лактулоза — синтетический дисахарид, синтезированный из фруктозы и галактозы, применяется в клинической практике с 1957 г. Лактулоза используется для лечения запоров и заболеваний печени (печеночная энцефалопатия) [10, 11]. S.L. Collins et al. [12] продемонстрировали, что лактулоза избирательно стимулирует рост Lactobacillus, но не патогенных микроорганизмов, что способствует созданию здоровой кислой среды во влагалище.
В ряде исследований показана высокая эффективность суппозиториев вагинальных, содержащих комбинацию натамицина и лактулозы, по сравнению с суппозиториями, содержащими только натамицин. Так, в исследовании с участием беременных женщин (срок беременности от 18 до 31 нед.) достигнуты более надежная эрадикация грибов рода Candida и более быстрое купирование клинических проявлений кандидозного вагинита/вульвовагинита на фоне применения суппозиториев вагинальных, содержащих натамицин и лактулозу (Экофуцин®), по сравнению с показателями на фоне применения суппозиториев вагинальных, содержащих только натамицин. По окончании терапии у пациенток из группы натамицина и лактулозы содержание лактобактерий в отделяемом из цервикального канала увеличилось в среднем в 50 раз (до 100 раз максимально) по сравнению с исходным, в то время как у пациенток из группы натамицина на фоне лечения данный показатель увеличился в 2,5 раза (p<0,001) [13]. Схожие результаты получили и П.Н. Кротин и соавт. [14], которые показали, что комбинация натамицина и лактулозы в составе препарата Экофуцин® способствовала более быстрому достижению клинической ремиссии и полной элиминации возбудителя кандидозного вагинита/вульвовагинита, интенсивному росту лактобактерий, являющихся основными конкурентами дрожжеподобных грибов во влагалищном микробиоценозе.
Заключение
На основании динамики состояния микробиоценоза влагалища по результатам клинических, микробиологических и молекулярно-генетических исследований отделяемого влагалища установлено, что применение лекарственного препарата Экофуцин®, суппозитории вагинальные, содержащие 100 мг натамицина и вспомогательное вещество лактулозу, в периоперационном периоде на фоне АБТ оказывает профилактический эффект в отношении развития кандидозно-бактериального дисбиоза, подтвержденный данными лабораторных исследований. В исследовании показана безопасность и хорошая переносимость препарата.
Сведения об авторе:
Кузьмин Владимир Николаевич — д.м.н., профессор, профессор кафедры репродуктивной медицины и хирургии ФГБОУ ВО МГМСУ им А.И. Евдокимова Минздрава России; 127473, Россия, г. Москва, ул. Делегатская, д. 20, стр. 1; ORCID iD 0000-0003-4022-9814.
Контактная информация: Кузьмин Владимир Николаевич, e-mail: vnkuzmin@mail.ru.
Источник финансирования: исследование проведено при поддержке компании АО «АВВА РУС». Автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 05.10.2022.
Поступила после рецензирования 28.10.2022.
Принята в печать 23.11.2022.
About the author:
Vladimir N. Kuzmin — Dr. Sc. (Med.), Professor, Professor of the department of Reproductive Medicine and Surgery, A.I. Yevdokimov Moscow State University of Medicine and Dentistry; 20/1, Delegatskaya str., Moscow, 127473, Russian Federation; ORCID iD 0000-0003-4022-9814.
Contact information: Vladimir N. Kuzmin, e-mail: vnkuzmin@mail.ru.
Financial Disclosure: the study was supported by JSC AVVA RUS. The author has no a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 05.10.2022.
Revised 28.10.2022.
Accepted 23.11.2022.
Информация с rmj.ru






