Содержание статьи
Введение
Коллагены играют важную структурную роль и вносят вклад в механические свойства, организацию и форму тканей. Коллаген — это фибриллярный белок, составляющий основу соединительной ткани организма и обеспечивающий ее прочность и эластичность. Семейство коллагенов включает 28 типов, которые содержат по меньшей мере один домен с тройной спиралью [1]. Коллагены откладываются во внеклеточном матриксе, где большинство из них образуют супрамолекулярные сборки. У взрослых людей более 90% коллагена хрящевого матрикса представлено коллагеном II типа, который является основным структурным компонентом межклеточного матрикса хряща [2]. При заболеваниях опорно-двигательного аппарата (ОДА) в межклеточном матриксе хряща существенно уменьшается количество коллагена II типа [3]. Основой суставного хряща является гиалиновая хрящевая ткань, состоящая из хондроцитов, имеющих тканеспецифические антигены, которые индуцируют выработку антител у пациентов с остеоартритом (ОА). Именно деградация и уменьшение количества коллагена II типа ассоциируются с ОА.
Сегодня в терапии ОА для перорального и парентерального применения широко используются симптоматические лекарственные средства замедленного действия (СЛСЗД, SYSADOA — Symptomatic Slow Acting Drugs for Osteoarthritis), или хондропротекторы, такие как фармацевтически стандартизированные хондроитина сульфат (ХС) и глюкозамина сульфат (ГС), гиалуроновая кислота для внутрисуставного введения, имеющие наивысший уровень убедительности рекомендаций (А) и достоверности доказательств (1), которые могут эффективно влиять на симптомы при длительном (до 6 мес.) курсе лечения, проявляя низкую токсичность [4]. Наряду с указанными лекарственными препаратами (ЛП) также назначаются и другие средства из этой категории (биоактивный концентрат мелкой морской рыбы, гликозаминогликан-пептидный комплекс, неомыляемые соединения авокадо и сои, диацереин), которые имеют недостаточный уровень убедительности рекомендаций и достоверности доказательств.
В последнее время стало уделяться повышенное внимание новым подходам к терапии ОА, в частности препаратам, в основе которых лежит новая перспективная молекула коллагена II типа: неденатурированный, или нативный, коллаген (НК-II); денатурированный (гидролизованный) коллаген (ГлК-II), или пептиды коллагена. Коллаген способствует значимому уменьшению боли в суставах при проведении коротких (в течение недель) и средних (в течение месяцев) курсов лечения. Молекулярная масса НК-II высокая (300 кДа), ГлК-II — низкая (2–9 кДа) [5].
Молекулярные механизмы действия НК-II
Имеющиеся в литературе данные о молекулярных механизмах действия коллагенов II типа, в том числе НК-II, систематизированы посредством современных методов анализа больших объемов данных [6]. Действие стандартизированных экстрактов НК-II связано с модуляцией механизмов врожденного и приобретенного иммунитета, снижением активности провоспалительных цитокинов и простагландинов. Эпитопы нативного коллагена в структуре НК-II способствуют уменьшению активности аутоиммунных реакций, стимулирующих деградацию хряща. Взаимодействуя с дискоидиновыми рецепторами (Receptor Tyrosine Kinases, DDR1 и DDR2) [2, 7], НК-II ускоряет реконструкцию соединительной ткани хряща и тормозит провоспалительные эффекты эндогенных коллагенов.
Систематический анализ данных выявил, что молекулярная фармакология предполагает три механизма действия НК-II [6]:
При поступлении per os трехмерные эпитопы полипептидов НК-II воздействуют на Т- и В-лимфоциты в пейеровых бляшках тонкого кишечника, начинается выработка антител, которые образуют защитный слой вокруг волокон коллагена разрушающегося хряща, препятствуя избыточной продукции провоспалительных цитокинов Т-лимфоцитами, не сенсибилизированными к НК-II.
НК-II частично гидролизуется под действием ферментов желудочно-кишечного тракта, вследствие чего образуются полипептидные фрагменты, которые, взаимодействуя с DDR на поверхности хондроцитов, способствуют ускорению регенерации хрящевой ткани.
Полипептидные фрагменты НК-II могут блокировать аутоантитела, которые ускоряют гибель хондроцитов и деградацию хрящевой ткани, что способствует торможению деградации ткани хряща.
Молекулярные механизмы действия ГлК-II
Гидролизованный коллаген, или пептиды коллагена, — это группа пептидов с низкой молекулярной массой (в среднем 3–6 кДа), которые могут быть получены ферментативным действием в кислых или щелочных средах при определенной температуре инкубации [8]. Биодоступность ГлК-II in vitro демонстрирует высокие показатели абсорбции из-за его низкой молекулярной массы [9]. Гидролизованный коллаген содержит 8 из 9 незаменимых аминокислот, включая глицин (33%), пролин, гидроксипролин (22%) в триплексной спирали, которая образована тремя α-цепями [10]. Эти аминокислоты играют важную роль в формировании скелетных разновидностей соединительной ткани, а их дефицит может быть причиной болей в суставах, хрупкости ногтей, ломкости волос. Аминокислотный состав гидролизованного коллагена соответствует аминокислотному составу матрикса хрящевой ткани. Применение гидролизата коллагена стимулирует анаболические процессы в межклеточном веществе хрящевой ткани, приводящие к активизации регенерации и стабильности суставного хряща [11]. Топическое применение порошков коллагена способствует регенерации кожи и заживлению ран [12]: ускоряется переход от экссудативной фазы воспаления к пролиферативной, быстрее происходит эпителизация [13].
Согласно имеющимся данным действие пептидов коллагена опосредовано тремя различными механизмами: прямым воздействием на фибробласты, М2-подобные макрофаги и механизмами, связанными с оральной толерантностью [9].
Различия между НК-II и ГлК-II
Структура коллагена очень стабильна из-за внутримолекулярных водородных связей между глицином в соседних цепях. Молекула коллагена образуется из тройной спиральной области и двух негелевых областей на обоих концах спиральной структуры с молекулярной массой около 300 кДа, длиной 280 нм и диаметром 1,4 нм. Гидролизат коллагена представляет собой обрывки белковых нитей, которые представлены отдельными аминокислотами, дипептидами и трипептидами.
Молекулярная масса неденатурированного коллагена высокая (300 кДа), гидролизата коллагена — существенно ниже (2–9 кДа, в среднем 6 кДа) [5]. Полипептиды гидролизата коллагена легко всасываются, обладают анаболическим эффектом, ускоряют биосинтез коллагена и увеличивают синтез внеклеточного матрикса хондроцитами, улучшают минерализацию костей за счет дифференциации и пролиферации остеобластов.
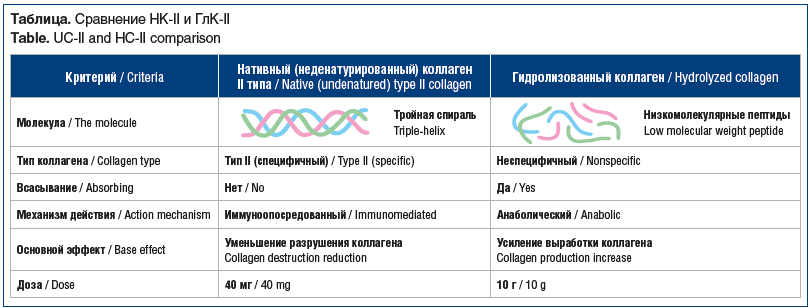
Таким образом, молекула неденатурированного коллагена содержит нативный коллаген (фибриллярный белок), тогда как денатурированный коллаген представляет собой полипептиды. ГлК-II легко всасывается из-за низкой молекулярной массы [14, 15], тогда как НК-II не всасывается при приеме per os. Основной эффект НК-II — уменьшение деструкции коллагена, тогда как ГлК-II повышает синтез коллагена. Механизм действия НК-II — иммуноопосредованный, ГлК-II — анаболический (см. таблицу). Механизм действия разных видов коллагена (неденатурированного и денатурированного) обусловливает их клиническое применение: НК-II назначается в основном при заболеваниях ОДА [16, 17], в частности ОА; основная область применения ГлК-II — косметология, при инволюционных процессах в коже [18, 19], назначается также и при заболеваниях ОДА [20, 21].
Терапевтическая эффективность коллагена
Нативный коллаген II является основной частью коллагеновых фибрилл гиалинового хряща суставов, он также присутствует в пульпозном ядре межпозвонкового диска. НК-II, полученный из хряща куриной грудины, назначается при ОА коленного сустава [22]. Показано, что добавление коллагеновых пептидов способствует восстановлению соединительной ткани и уменьшает боль за счет увеличения выработки коллагена [23].
Метаанализ рандомизированных плацебо-контролируемых исследований подтвердил эффективность приема НК-II при ОА. Отмечено статистически значимое снижение показателей по шкале WOMAC, в том числе по подшкале «скованность суставов», уменьшение выраженности боли по ВАШ [16].
В ряде исследований дана сравнительная оценка эффективности коллагена и анальгетиков (ацетаминофена). Сравнивались результаты симптоматического лечения пациентов с ОА коленного сустава (n=20; средний возраст 57,7 года) НК-II (10 мг/сут, курс 3 мес.) в сочетании с ацетаминофеном (1500 мг/сут) и лечения только ацетаминофеном (n=19; средний возраст 58,8 года). Прием НК-II был статистически значимо ассоциирован с заметным снижением боли в суставах по ВАШ, уменьшением выраженности дисфункции суставов по WOMAC и улучшением качества жизни по шкале SF-36, чего не наблюдалось в группе контроля [24].
В рандомизированном контролируемом исследовании [25] клиническая эффективность НК-II оценена у 60 пациентов в возрасте 40–75 лет с ОА II–III стадии. Пациенты первой группы (n=30) получали ацетаминофен (1500 мг/сут), второй (n=30) — НК-II (10 мг/сут) в течение 3 мес. Более выраженное статистически значимое снижение ночной боли и боли в покое отмечено в группе НК-II. В обеих группах отмечено улучшение показателей при подъеме по лестнице, при ходьбе по ровной поверхности. Положительная динамика по показателям ВАШ и WOMAC на 30% в обеих группах позволила сделать вывод о сопоставимой эффективности препаратов.
В большинство ЛП наряду с коллагеном включен комплекс лекарственных трав (босвеллия, куркумин и др.) или других хорошо изученных SYSADOA (ХС, ГС, гиалуроновая кислота). В сравнительном многоцентровом рандомизированном исследовании [17] с участием 191 пациента в возрасте от 40 до 75 лет с ОА коленных суставов (крепитация, наросты на костях, припухлость суставов и т. д.) наблюдались три группы: первая группа получала НК-II (40 мг/с), вторая — глюкозамина гидрохлорид (1500 мг) + ХС (1200 мг), третья — плацебо. Курс лечения составил 180 дней. В группе НК-II в сравнении с группой плацебо получено статистически значимое снижение показателей по шкале WOMAC, включая существенное достоверное уменьшение баллов по подшкалам WOMAC «боль», «скованность» и «физическая функция». Показатели безопасности в группах не различались [17].
В работе [20] показана эффективность БАД (ГлК + босвеллия + куркумин + гиалуроновая кислота + пиперин) у пациентов (n=30; средний возраст 54,4 года) с ОА коленного и тазобедренного суставов, болями в нижней части спины, с невыраженным болевым синдромом (4–5 баллов по численно-рейтинговой шкале). БАД назначалась per os в комплексе с физическими упражнениями в течение 30 дней. Терапевтический эффект проявлялся в уменьшении выраженности болевого синдрома более чем на 50% (в среднем на 77,2%), на 7–10-й день от начала приема пациенты сообщали об ощущении гибкости и «эластичности» в суставах. За период наблюдения нежелательных явлений (НЯ) не наблюдалось.
В пилотном исследовании [26] продемонстрировано влияние перорального препарата, содержащего гиалуроновую кислоту, ХС, ГлК-II и гидролизованный кератин, на характеристики синовиальной жидкости и клинические показатели у 30 пациентов (средний возраст 63,1 года) с ОА коленного сустава. Изменения в синовиальной жидкости оценивали путем измерения индексов местного воспаления, уровня цитокинов IL-1β, -8, -6, -10 и GM-CSF. В группе пациентов, получавших пероральную добавку, наблюдалось статистически значимое улучшение клинических показателей по WOMAC, шкале Лекена, ВАШ боли, тогда как в контрольной группе существенных изменений обнаружено не было.
В наблюдательном открытом многоцентровом клиническом исследовании REDART [27] дана оценка эффективности пищевой добавки, содержащей гидролизованный желатин, ХС, ГС, ГлК-II и экстракты лекарственных растений, относительно уменьшения боли и улучшения функциональных возможностей у пациентов (n=130) с ОА коленного и тазобедренного суставов в течение 6 мес. В ходе исследования получено статистически значимое уменьшение выраженности боли, положительная динамика по WOMAC и шкале Лекена. НЯ не наблюдалось. Сделан вывод, что лечение пищевой добавкой значительно уменьшает боль и улучшает двигательную функцию у пациентов с ОА.
В экспериментальном исследовании [28] по внутрисуставному введению бычьего ГлК-II (массой менее 3 кДа) пациентам с ОА коленного сустава было показано, что используемый внутрисуставно ГлК-II способен индуцировать хондроциты вырабатывать гиалиновый хрящ, нормализовать репаративную функцию, препятствовать образованию фиброзной ткани. НЯ при внутрисуставном использовании ГлК-II не выявлено.
Заключение
Экспериментальные и клинические исследования подтверждают эффективность использования стандартизированных субстанций НК-II для ускорения регенерации хряща и уменьшения боли при ОА и субклинической дисфункции суставов. Проанализированные результаты исследований являются чрезвычайно многообещающими и подчеркивают необходимость проведения дальнейших контролируемых проспективных исследований для изучения всех положительных эффектов ЛП, содержащих коллаген, для лечения ОА.
Сведения об авторах:
Шавловская Ольга Александровна — д.м.н., профессор кафедры восстановительной медицины и реабилитации АНО ВО «МУВМ»; 105062, Россия, г. Москва, Фурманный пер., д. 8, стр. 2; ORCID iD 0000-0003-3726-0730.
Бокова Ирина Анатольевна — к.м.н., доцент кафедры восстановительной медицины, реабилитации и курортологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России; 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-1640-1605.
Романов Игорь Дмитриевич — врач-невролог, руководитель по научной и консультативной неврологической помощи ООО «МД Клиник»; 111674, Россия, г. Москва, ул. Дмитриевского, д. 11; ORCID iD 0000-0002-0756-7961.
Шавловский Никита Игоревич — ординатор 1-го года кафедры неврологии с курсом рефлексологии и мануальной терапии ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2; ORCID iD 0000-0002-8673-3146.
Контактная информация: Шавловская Ольга Александровна, e-mail: shavlovskaya@1msmu.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 11.08.2022.
Поступила после рецензирования 05.09.2022.
Принята в печать 28.09.2022.
About the authors:
Olga A. Shavlovskaya — Dr. Sc. (Med.), Professor of the Department of Restorative Medicine and Rehabilitation, International University of Rehabilitation Medicine; 8/2, Furmanny lane, Moscow, 105062, Russian Federation; ORCID iD 0000-0003-3726-0730.
Irina A. Bokova — C. Sc. (Med.), Associate Professor of the Department of Restorative Medicine, Rehabilitation and Balneology, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8/2, Trubetskaya, Moscow, 119991, Russian Federation; ORCID iD 0000-0002-1640-1605.
Igor D. Romanov — neurologist, Head of Scientific and Advisory Neurological Care, MD Clinic LLC; 11, Dmitrievsky str., Moscow, 111674, Russian Federation; ORCID iD 0000-0002-0756-7961.
Nikita I. Shavlovsky — 1st year resident of the Department of Neurology with a Faculty of Reflexology and Manual Therapy, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002-8673-3146.
Contact information: Olga A. Shavlovskaya, e-mail: shavlovskaya@1msmu.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 11.08.2022.
Revised 05.09.2022.
Accepted 28.09.2022.
Информация с rmj.ru



