Содержание статьи
Эффективность и безопасность применения макролидов в терапии
внебольничных пневмоний у детей
О. И. Пикуза*, доктор медицинских наук, профессор
А. М. Закирова*, кандидат медицинских наук
Ж. Р. Ибрагимова**
А. В. Пикуза*, кандидат медицинских наук
Л. Ф. Рашитов*, кандидат медицинских наук
* ГБОУ ВПО КГМУ МЗ РФ, Казань
** ГАУЗ ЦГКБ № 18, Казань
Внебольничная пневмония (ВП) сохраняет свою высокую распространенность в
России. Ежегодно более полутора миллионов детей наблюдается врачами по поводу ВП,
что приблизительно составляет 1% от многочисленной группы детей, переносящих
острую респираторную инфекцию [1]. Внимание исследователей многих стран обращено
на трансформацию этиологической роли возбудителей заболеваний респираторного
тракта с возрастающей значимостью атипичных патогенов, в частности
Mycoplasma pneumoniae и Chlamydia pneumoniae [2–4]. Своеобразие течения
воспалительных поражений органов дыхания, инициируемых атипичной флорой,
характеризуется склонностью к торпидности, рецидивам, скудными физикальными
изменениями в легочной ткани. Кроме того, внебольничные пневмонии, обусловленные
хламидийной инфекцией, нередко протекают с наличием труднокупируемого
бронхообструктивного синдрома [5–7]. В связи с этим диагноз ставится в
относительно поздние сроки — на 5–7 день заболевания, что приводит к более
тяжелому течению болезни, часто осложненному и с исходами в хронические
инфекционные легочные заболевания.
Одной из важных клинических проблем последних лет является проведение
рациональной антибактериальной терапии, что связано с широким распространением
резистентных к антибактериальным препаратам штаммов возбудителей, большим числом
больных с иммунодефицитными состояниями, высокой частотой смешанных инфекций.
Немаловажным следует считать и высокий риск многочисленных осложнений и побочных
эффектов подобной терапии, что заставляет искать новые возможности лечения
больных [8].
Известно, что M. pneumoniae и C. pneumoniae обладают высоким
тропизмом к эпителиальным клеткам очагов поражения и персистируют в особых
мембраноограниченных зонах эпителия, что является предпосылкой для устойчивости
возбудителей к лекарственной терапии и, нередко, причиной ее неудачи [9].
Поэтому лечение микоплазменной и хламидийной инфекций у детей представляется
сложной проблемой, и, несмотря на достигнутые успехи, по-прежнему актуален выбор
препарата макролидного ряда, отвечающего всем требованиям доказательной
медицины, оправдывающего ожидания родителей. Это в полной мере относится к
зарегистрированному в Российской Федерации препарату джозамицину (Вильпрафен
Cолютаб).
Целью настоящей работы было оценить эффективность и безопасность макролидов в
терапии внебольничных пневмоний у детей, а также удовлетворенность родителей
проводимыми терапевтическими режимами.
Критерии включения в исследование:
- дети в возрасте от 5 до 17 лет с этиологически подтвержденным диагнозом
«внебольничная пневмония» микоплазменной и хламидийной этиологии.
Критерии исключения:
- участие в другом клиническом исследовании в данный момент или в течение
последних 4 недель; - при подборе были исключены дети с сопутствующими хроническими
заболеваниями в стадии обострения; - пациенты с аллергией к антибиотикам в анамнезе;
- группа пациентов со слабоположительным результатом IgG-антительного
ответа к С. рneumoniae и микоплазменному антигену.
Пациенты и методы исследования
Работа выполнена на клинических базах кафедры пропедевтики детских болезней и
факультетской педиатрии с курсом детских болезней лечебного факультета ГБОУ ВПО
КГМУ МЗ РФ (Казань): педиатрическое отделение клиники медицинского университета
и детский стационар ГАУЗ ЦГКБ № 18 (Казань), радиус обслуживания которых
включает детское население города Казани, а также ООО «Клинико-диагностическая
лаборатория».
В ходе работы было проведено комплексное клинико-лабораторное и
инструментальное обследование 65 пациентов в возрасте от 6 до 17 лет из общего
количества госпитализированных детей в пульмонологическое отделение за период
2010–2014 гг. с подтвержденным диагнозом «внебольничная пневмония», вызванной
М. рneumoniae и С. рneumoniae. В соответствии с целью исследования дети
были рандомизированы на две группы с разными режимами фармакотерапии. В 1-ю
(основную) группу численностью 36 пациентов наряду с общепринятой терапией ВП,
вызванной М. рneumoniae и С. рneumoniae, в качестве антибактериального
препарата применялся джозамицин (Вильпрафен в виде диспергируемых таблеток
Солютаб) в дозе 40–50 мг/кг/сут в 2 приема в течение 10 дней в виде раствора
(суспензии, полученной при растворении диспергируемой таблетки), не содержащего
сахара, красителей и обладающего приятным вкусом. Пациентам 2-й группы (n = 29)
— группы сравнения — назначали кларитромицин в дозе 7,5 мг/кг каждые 12 часов в
течение 10 дней.
Соматическое исследование включало тщательное изучение анамнеза
(медико-биологического, генеалогического, социально-гигиенического,
аллергологического и респираторного) и оценку симптомов болезни. По показаниям
дети были осмотрены специалистами, всем пациентам неоднократно проводились
общепринятые параклинические методы обследования. Исследования дыхательной
системы включали обзорную и боковую рентгенографию органов грудной клетки,
оценку функции внешнего дыхания, степень дыхательной недостаточности оценивалась
путем регистрации показателей сатурации кислорода на аппарате «Пульсоксиметр
МД300К». Все полученные результаты фиксировались в специально разработанной
индивидуальной карте и медицинской карте стационарного больного.
Наличие атипичной флоры подтверждали методом полимеразной цепной реакции (ПЦР),
а также путем динамической регистрации уровня IgG-антител к вышеуказанным
возбудителям на иммуноферментном анализаторе с использованием тест-систем,
разработанных в лаборатории иммунохимической диагностики ГУ НИИВС им И. И.
Мечникова РАМН и ЗАО «Вектор-Бест». Диагностически значимое нарастание титра
антител к микоплазмам и хламидиям в 3 и более раза (1:20) в соответствии с
критериями G. T. Grayston и соавт. [10] нами расценивалось как положительный
результат, в то время как при наличии титра 1:10 (слабоположительный результат)
дети не включались в исследование.
Безопасность изучавшихся терапевтических режимов оценивалась по следующим
критериям: переносимость, возникновение аллергических реакций, по
частоте/количеству нежелательных явлений. При анализе переносимости препарата
использовали градации: очень хорошая, хорошая, удовлетворительная,
неудовлетворительная. С целью получения информации со стороны родителей об
эффективности препарата в лечении их детей нами была разработана анкета, которую
они заполняли по окончании лечебного процесса. Удовлетворенность результатами
лечения джозамицином родители пациентов оценивали по интегральной шкале IMPSS (Integrative
Medicine Patient Satisfaction Scale):
- полностью удовлетворен;
- удовлетворен;
- отношусь нейтрально;
- неудовлетворен;
- крайне неудовлетворен.
Как дополнительные показатели эффективности оценивались:
- доля родителей, оценивших использовавшийся терапевтический режим как
удобный и простой; - доля родителей, уверенных («полностью удовлетворен» и «удовлетворен») в
безопасности и эффективности терапии своих детей к окончанию лечебного
периода; - средняя выраженность симптомов пневмонии (оценка родителями по 4-балльной
шкале) в ходе исследования и к окончанию лечебного периода:
а) динамика типичных симптомов (кашель, учащение дыхания, катаральные явления,
повышение температуры тела) для данного заболевания: 0 — симптомы отсутствуют,
1 — выражены незначительно, 2 — выражены умеренно, 3 — выражены значительно;
б) динамика общих симптомов (головная боль, снижение аппетита, вялость,
утомляемость): 0 — симптомы отсутствуют, 1 — выражены незначительно, 2 —
выражены умеренно, 3 — выражены значительно. - общая продолжительность пребывания пациентов в стационаре;
- успешность терапии джозамицином либо необходимость замены антибиотика;
- комплаентность.
В качестве конечной цели в исследовании определялась доля родителей,
уверенных в безопасности и эффективности лечения своих детей к окончанию
лечебного периода.
Статистическая обработка проводилась при помощи пакета программ Statistica
for Windows 6.0 (StatSoft, США). Качественные данные представлены в виде
абсолютных или относительных (%) частот. При проведении клинической
характеристики пациентов количественные данные представлены в виде среднего
арифметического и среднеквадратичного отклонения, при сравнении средних — в виде
среднего арифметического и 95% доверительного интервала. Разницу значений
считали статистически значимой при р < 0,05.
Результаты исследования
Нами проведен детальный клинический анализ детей с ВП, обусловленной
микоплазменной и хламидийной инфекцией. С этой целью были изучены данные из
историй развития детей (форма № 112/у). Выявлена высокая частота отягощающих
факторов и фоновых состояний среди больных ВП. Так, отягощенный наследственный
анамнез был отмечен у 47,7% (n = 31) пациентов, осложненный антенатальный период
в 43,1% (n = 28) случаях, перинатальную травму ЦНС перенесли 33,8% (n = 22)
детей. Среди всех обследованных с воспалительным процессом в легочной ткани
75,4% (n = 49) имели сопутствующую хроническую патологию в стадии ремиссии. К
группе часто болеющих относились 64,6% (n = 42) детей.
Клинически дебют ВП, обусловленной атипичной микрофлорой, у обследованных
детей изначально напоминал симптоматику острого респираторного заболевания
(например, фарингит, аденоидит). Заболевание начиналось остро, с подъема
температуры тела до фебрильных цифр и недомогания, в ряде случаев — 63,1% (n =
41) отмечалась головная и мышечные боли, слабость, вялость и другие симптомы
интоксикации, который купировался на ранних сроках пребывания в стационаре (2–4
день). Возникало першение, охриплость и боль в горле, заложенность носа,
выделения из носовых ходов, конъюнктивит. При этом, несмотря на гипертермию и
сохранения лихорадки более длительно на фебрильном уровне, симптомы интоксикации
у большинства детей на фоне микоплазменного инфицирования были не столь
выражены, что служит, вероятно, одним из немногих специфических признаков, в
частности, микоплазменной инфекции. Через несколько дней от начала заболевания
отмечался сухой, навязчивый или приступообразный кашель. У 33,8% (n = 22)
пациентов отмечался бронхообструктивный синдром, причем в подавляющем
большинстве они имели этиологически доказанную хламидийную инфекцию. Как
правило, на 4–5 день заболевания после короткого периода улучшения общего
состояния у детей данной группы вновь отмечался подъем температуры, изменялся
характер кашля: с сухого и малопродуктивного он становился продуктивным с
отхождением слизисто-гнойной мокроты.
Следует подчеркнуть несоответствие физикальных и рентгенологических данных.
Аускультативные изменения в легких носили скудный характер, лишь у части больных
на фоне жесткого или ослабленного дыхания выслушивались рассеянные сухие и
разнокалиберные влажные хрипы. При этом рентгенологически выявлялись
двусторонние очаги негомогенной инфильтрации. Гематологические сдвиги
характеризовались увеличением скорости оседания эритроцитов (СОЭ) (32,3%, n =
21), умеренным лейкоцитозом (16,9%, n = 11), причем в половине случаев
показатель СОЭ возрастал на фоне нормального общего количества лейкоцитов в
крови. В лейкоцитарной формуле у 61,5% (n = 40) больных регистрировались
изменения в виде нейтрофилеза (7,7%, n = 5), палочкоядерного сдвига влево (9,2%,
n = 6), умеренного лимфоцитоза (13,8%, n = 9) и анэозинофилии (10,8%, n = 7).
Следовательно, примерно у половины детей с ВП, вызванной М. pneumoniae и С.
pneumoniae, воспалительный процесс протекал на фоне ареактивных показателей
крови, что указывает, по всей вероятности, на гипорезистентное состояние
организма.
Сводные данные по клинической характеристике ВП представлены в табл. 1.

Из приведенных данных видно, что пациенты обеих изучаемых групп имели схожую
исходную клиническую картину и половозрастную характеристику, без достоверных
различий в каком-либо из изучавшихся показателей.
Выбор метода лечения выполнялся путем соблюдения следующих правил:
этиологического фактора и возраста пациентов, обеспечения надежного излечения от
инфекции, отсутствия нежелательных лекарственных реакций. Известно, что
16-членный макролидный антибиотик выгодно отличается от своих предшественников
(14-членных и 15-членных). Препарат джозамицин оказывает менее выраженное
влияние на метаболизм печеночных ферментов, надежно защищен от воздействия
желудочного сока, не проявляет прокинетического действия, обладает высокой
биодоступностью и минимальным взаимодействием с другими лекарственными
препаратами, в отличие от его предшественника — 14-членного макролида —
кларитромицина.
Терапевтическая эффективность назначаемых макролидов наблюдаемым пациентам не
имела существенных различий, тем не менее, можно отметить более ранние сроки
купирования симптомов интоксикации и меньшую продолжительность лихорадки при
лечении джозамицином (табл. 2).
Нами было установлено, что при применении джозамицина практически все
родители 1-й группы были уверены в безопасности лечения детей, причем во 2-й
группе пациентов, которые получали кларитромицин, таких родителей оказалось
меньше (рис. 1–3).
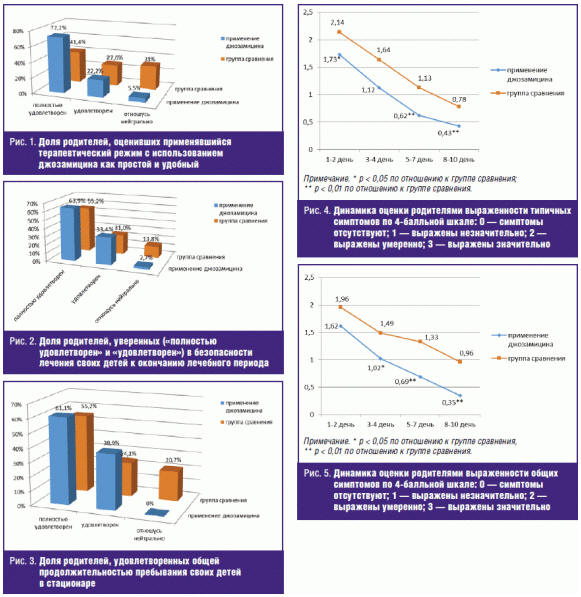
Существенные различия нами были установлены в показателях, характеризующих
клиническую эффективность изучаемых терапевтических режимов с точки зрения
родителей. Выявленные различия оставались статистически значимыми на всем
протяжении наблюдения за детьми (рис. 4–5).
В ходе исследования также были установлены причины неудовлетворенности
родителей терапией ВП, которую получают их дети. Так, во второй группе с
использованием кларитромицина 34,4% родителей отметили причины
неудовлетворенности используемого препарата, тогда как среди родителей, чьи дети
получали джозамицин, таких было всего лишь 5,5% (р < 0,001; рис. 6).
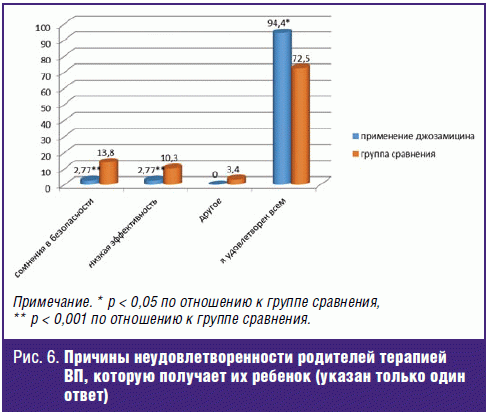
Одна из наиболее частых причин неудовлетворенности родителей была связана с
развитием нежелательных лекарственных реакций (аллергическая реакция, диспепсия,
рвота) у 13,8% детей из группы сравнения, тогда как в основной группе мы
наблюдали всего один случай появления аллергической сыпи. Неуверенность в
безопасности применяемых препаратов может стать причиной низкой приверженности
населения к лечению 14-членными макролидами.
Таким образом, препарат джозамицин обладает хорошей переносимостью, серьезных
нежелательных явлений зарегистрировано не было. В проведенном исследовании было
установлено, что практически все родители пациентов (94,4%), получавших
терапевтический режим на основе джозамицина, уверены в эффективности и
безопасности лечения.
Заключение
Макролидные антибиотики по-прежнему остаются основными препаратами для
лечения респираторного микоплазмоза и хламидиоза у детей. Данное исследование
впервые проведено с позиций изучения клинической эффективности и
удовлетворенности родителей лечением ВП с использованием разных терапевтических
режимов: назначение джозамицина и кларитромицина. В ходе исследования нами
оценивалась безопасность, эффективность, удобство применения данных
лекарственных средств и количество дней госпитализации с учетом мнения
родителей. Джозамицин создает наиболее высокие внутриклеточные концентрации,
благодаря чему, по-видимому, он проявляет более высокий бактерицидный эффект в
отношении микоплазменной и хламидийной инфекции.
Таким образом, как показали наши исследования, терапевтический режим на
основе назначения джозамицина, по мнению родителей пациентов, является более
удобным и простым при практическом отсутствии нежелательных реакций.
Литература
-
Куценко М. А., Чучалин А. Г. Внебольничные инфекции нижних
дыхательных путей: роль и место респираторных фторхинолонов // Русский
медицинский журнал. 2013. Т. 21. № 5. С. 242–248. -
Defilippi A., Silvestri M., Tacchella A. et al. Epidemiology and
clinical features of Mycoplasma pneumoniae infection in children // Respir.
Med. 2008; 102 (12): 1762–1768. -
Marguet C. Bronchopulmonary infections in the infant and the
child // Rev. Prat. 2005; 57 (11): 1237–1244. -
Tjhie J. H., Dorigo-Zetsma J. W., Roosendaal R. Chlamydia
pneumoniae and Mycoplasma pneumoniae in children with acute respiratory
infection in general practices in The Netherlands // Scand. J. Infect. Dis.
2000; 32 (1): 13–17. -
Таточенко В. К. Джозамицин в педиатрической практике //
Педиатрия. 2011. Т. 90. № 5. С. 124–128. - Хламидийные инфекции. Материалы 4-го Европейского конгресса по хламидиям
Европейского общества по изучению хламидий, 20–23 августа 2000, Хельсинки,
Финляндия. ИППП. 2001. V. 2. С. 32–36. -
Зайцева О. И., Щербакова М. Ю., Самсыгина Г. В. «Новая»
хламидийная инфекция. Медицинская библиотека сервера MedLinks.ru, опубликована
11–12 2006. - Рациональная фармакотерапия заболеваний органов дыхания: Рук. Для практ.
врачей / Под общ. ред. А. Г. Чучалина. М.: Литтера, 2004. 874 с. - «Внебольничная пневмония у детей: распространенность, диагностика, лечение
и профилактика». Научно-практическая программа. Российское респираторное
общество. М., 2011. -
Grayston J. T., Campbell L. A., Kuo C. C. et al. // J. Infect.
Dis. 1990. V. 161. P. 618–625.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru







