Материал и методы: в исследование включены 172 пациентки с эндометриомами яичников. После лапароскопической цистэктомии большая часть из них прошла гормономодулирующее лечение: 82 пациентки получали агонист гонадотропин-рилизинг-гормона (АГтРГ) — трипторелин, 52 пациентки — гестаген (диеногест), 21 — комбинированные оральные контрацептивы (КОК), и 17 пациенток контрольной группы не получали гормономодулирующего лечения. Всем пациенткам перед началом лечения и через 6 мес. после окончания лечения проводили исследование уровней АМГ, фолликулостимулирующего гормона (ФСГ), определяли число фолликулов в яичниках. Оценена частота наступления беременности в течение 12 мес. после лечения.
Результаты исследования: наименьшее снижение уровня АМГ после лечения отмечено в группе трипторелина, больше — в группе диеногеста, еще более выраженное — в группе КОК и наибольшее – в группе, не получавшей гормономодулирующего лечения. В группе получавших трипторелин уровень АМГ снизился по сравнению с дооперационным в среднем с 3,95 до 2,08 нг/мл (р
Заключение: по результатам проведенного исследования для комплексного лечения эндометриоза у пациенток с бесплодием наиболее эффективными являются препараты АГтРГ и прогестины, в то время как КОК не могут являться препаратами выбора с целью гормономодулирующей терапии при лечении бесплодия.
Ключевые слова: бесплодие, ВРТ, ЭКО, трипторелин, диеногест, комбинированные оральные контрацептивы, антимюллеров гормон.
Для цитирования: Кузьмина Н.С., Беженарь В.Ф., Калугина А.С. Дифференцированный подход к послеоперационной гормономодулирующей терапии больных с эндометриозом // РМЖ. Мать и дитя. 2018. №2(I). С. 65-69
Kuzmina N.S.1,2, Bezhenar V.F.1, Kalugina A.S.1,2
1 Pavlov First Saint Petersburg State Medical University
2 AVA-PETER clinic, St.- Petersburg
Aim: to compare the effectiveness of the use of various groups of medications for the treatment of infertility by the level of anti-Mullerian hormone (AMH), the number of follicles in the ovaries and the frequency of pregnancy.
Patients and Methods: the study enrolled 172 patients with ovarian endometriomas who received hormone-modulating therapy after laparoscopic cystectomy: 82 patients received GNRH agonist — tryptorelin, 52 patients received gestagenes (dienogest), 21 patients received COCs and 17 patients did not receive hormone-modulating therapy and made up a control group. The levels of AMH, FSH in the blood serum, the number of follicles in the ovaries were determined in all patients before the start of the treatment and 6 months after the end of treatment. The frequency of pregnancy in all groups was estimated within 12 months after the treatment.
Results: the least decrease in the level of AMH after treatment was observed in the group of patients receiving tryptorelin, a slightly larger difference was in the group of patients with dienogest, a more pronounced decrease of AMH in the COC group, and significantly more in the untreated group. In the group of patients who received tryptorelin, the level of AMH decreased less significantly among all 4 groups, on average from 3.95 to 2.08 ng / ml (p <0.0001), the level of FSH increased from 6.0 to 7.88 IU / l (p <0.0001), the number of follicles in the operated and intact ovaries decreased from 6.23 to 4.4 (p <0.0001) and from 8.44 to 7.55 (p = 0.0000005), respectively. In patients of all the study groups pregnancy occurred in 27.4% of cases. In the group of patients receiving triptorelin, pregnancy occurred in 36%, dienogest — 32.5%, COC - 5.26%, in the group of patients who did not receive treatment, the pregnancy occurred in 5.9%.
Conclusion: GNRH-agonist drugs and progestins are the most effective groups of drugs for the complex treatment of endometriosis in patients with infertility, while COC, according to the study, can not be a drug of choice for the purpose of hormone-modulating therapy in the treatment of infertility.
Key words: infertility, ART, IVF, tryptorelin, dienogest, combined oral contraceptives, anti-Mullerian hormone.
For citation: Kuzmina N.S., Bezhenar V.F., Kalugina A.S. A differentiated approach to postoperative hormone-modulating therapy of patients with endometriosis // RMJ. 2018. № 2(I). P. 65–69.
Статья посвящена послеоперационной гормономодулирующей терапии больных с эндометриозом. Представлены результаты исследования сравнительной эффективности применения различных групп медикаментозных препаратов для лечения бесплодия до и после лечения и частоте наступления беременности после лечения.
Содержание статьи
Введение
Известно, что эндометриоз — это хроническое эстрогенозависимое, воспалительное заболевание с разрастанием ткани, подобной эндометрию, за пределами полости матки. По различным данным, эндометриоз поражает 610% женщин репродуктивного возраста и встречается с частотой до 50% среди женщин с бесплодием [1]. На сегодняшний день не существует методов, позволяющих радикально излечить генитальный эндометриоз [2]. Как правило, лечение чаще всего направлено на уменьшение боли и сохранение или восстановление фертильности при бесплодии [3]. В настоящее время существуют различные подходы к преодолению бесплодия при эндометриозе, при этом наиболее часто используются методы вспомогательных репродуктивных технологий (ВРТ), значительно увеличивающие шансы наступления беременности при данной патологии. Многочисленными исследованиями доказано, что присутствие эндометриомы неблагоприятно влияет на исходы ВРТ [4–7] и что без хирургического лечения в сочетании с адектватной гормономодулирующей терапией увеличивается риск невынашивания беременности. На сегодняшний день известно, что для успешного преодоления бесплодия при эндометриозе необходимо использовать сочетанный подход к лечению, включающий и хирургическое, и гормономодулирующее лечение, и методы ВРТ. В гормономодулирующей терапии используются различные группы препаратов, наиболее известные из них — агонисты гонадотропин-рилизинг-гормона (АГтРГ), гестагены, комбинированные оральные контрацептивы (КОК). Ни одна из этих групп не гарантирует излечение и отсутствие в будущем рецидивов заболевания.
Цель данного исследования: сравнить эффективность различных групп медикаментозных препаратов для лечения бесплодия по уровню антимюллерова гормона (АМГ) как основного показателя овариального резерва, числу фолликулов в яичниках до и после лечения и частоте наступления беременности после лечения.
Материал и методы
Данное исследование было проведено в отделении гинекологии ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова» Минздрава России и в отделении оперативной гинекологии клиники «АВА-Петер» с мая 2015 по декабрь 2017 г. В исследование включено 172 пациентки с бесплодием, которым была выполнена лапароскопическая цистэктомия по поводу эндометриоидных кист яичников. Во всех случаях операции выполнены лапароскопическим доступом с использованием двух способов интраоперационного гемостаза: в 64 случаях с использованием гемостатических матриц, в 108 случаях — биполярной коагуляции (контроль).
Из 172 пациенток 17 — не получали гормономодулирующей терапии (группа 0), 82 пациентки получали АГтРГ — трипторелин 3,75 мг (группа 1), 52 пациентки получали диеногест 2 мг (группа 2), 21 пациентка получала КОК (группа 3). Длительность терапии составляла 4–6 мес.
Все исследуемые группы не имели значимых различий по возрасту, диаметру эндометриомы, уровню АМГ и фолликулостимулирующего гормона (ФСГ) до операции. Возраст пациенток (от 22,7 до 40 лет) составил в среднем 33,3 года, средний уровень АМГ — 3,11 нг/мл, средний уровень ФСГ на 2–3-й день менструального цикла после операции — 6,75 МЕ/л.
У всех 172 (100%) пациенток был установлен диагноз «бесплодие» (длительностью от 1 до 12 лет) и по данным ультразвукового исследования (УЗИ) диагностирована киста яичника диаметром больше 2 см (2–9 см).
Клинические данные пациенток, участвующих в исследовании, представлены в таблице 1.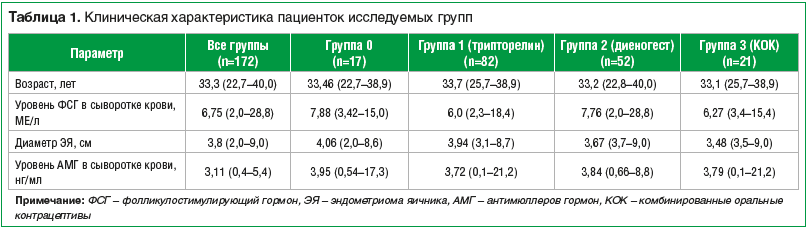
В исследование были включены пациентки с регулярным менструальным циклом, не имеющие эндокринных или тяжелых соматических заболеваний, не принимавшие в течение 6 мес. до исследования лекарственных препаратов, снижающих овариальную функцию. Помимо стандартного предоперационного общеклинического обследования у всех пациенток определялся овариальный резерв: перед операцией на 2–5-й день менструального цикла измерялся уровень ФСГ, АМГ, проводилось УЗИ объема и количества антральных фолликулов в яичниках и уточнялся диаметр кисты яичника. Оперативное лечение (цистэктомия) во всех случаях, в целях уменьшения вероятности рецидивов заболевания, проведено в плановом порядке, в первую фазу менструального цикла, лапароскопическим доступом, методом стриппинга. Гемостаз восстанавливался двумя методами: точечной биполярной коагуляцией у 108 пациенток и современными гемостатическими матрицами у 64 пациенток. Послеоперационных осложнений ни в одном случае не было. После каждой цистэктомии проводилась гистологическая верификация диагноза с подтверждением эндометриоза. В послеоперационном периоде, с 1–3-го дня следующего менструального цикла была назначена гормональная терапия на срок 24 нед. Трипторелин в дозе 3,75 мг внутримышечно 1 раз в 28 дней получали 82 пациентки; диеногест в дозе 10 мг ежедневно в непрерывном режиме — 62 пациентки, КОК по схеме: 21 день приема, 7 дней перерыв — 21 пациентка; не принимали гормономодулирующей терапии 17 пациенток (контрольная группа 0). После окончания лечения, а у пациенток из группы контроля через 6 мес. после операции, на 2–5-й день следующего менструального цикла измеряли уровень АМГ, ФСГ, количество фолликулов в яичниках. В дальнейшем пациентки планировали беременность самостоятельно или по программе ВРТ. Было проанализировано количество наступивших беременностей (при наличии плодного яйца в полости матки методом УЗИ).
Статистический анализ. Качественные данные описывались с помощью частот и процентов. Анализ качественных данных проводился с помощью таблиц сопряженности и критерия хи-квадрат, или точного критерия Фишера в случае малого числа наблюдений. Количественные данные представлены с помощью среднего и ошибки среднего (М±m), а также медианы и квантилей (Me (Q1:Q3)). Для проверки нормальности распределения количественных данных использовался критерий Шапиро–Уилкса, который показал, что все исследуемые показатели имеют распределение, отличное от нормального. Поэтому для анализа количественных данных применялись методы непараметрической статистики: критерий Краскела–Уоллиса для сравнения групп и критерий Вилкоксона для оценки динамики исследуемых показателей. Используемый уровень значимости: р=0,05.
Результаты исследования
Группы были однородны по типу проведенных операций (р=0,08). Данные по типу интраоперационного гемостаза и последующего гормономодулирующего лечения представлены в таблице 2.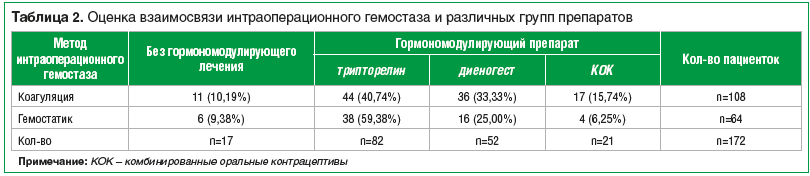
Оценен овариальный резерв до и после лечения по уровням АМГ, ФСГ в сыворотке крови и подсчету количества фолликулов в яичниках по данным УЗИ. При анализе динамики исследуемых показателей обнаружено, что в контрольной группе больных отмечается наиболее выраженное среди всех групп снижение уровня АМГ, в среднем с 3,11 до 1,3 нг/мл (р=0,0003), ФСГ увеличился с 7,01 до 9,4 МЕ/л (р=0,0008), количество фолликулов в оперированном и интактном яичниках уменьшилось в среднем с 5,76 до 4,35 (р=0,009) и с 7,47 до 6,94 (р=0,22) соответственно. В группе трипторелина уровень АМГ снизился наименее значимо среди всех 4-х групп, в среднем с 3,95 до 2,08 нг/мл (р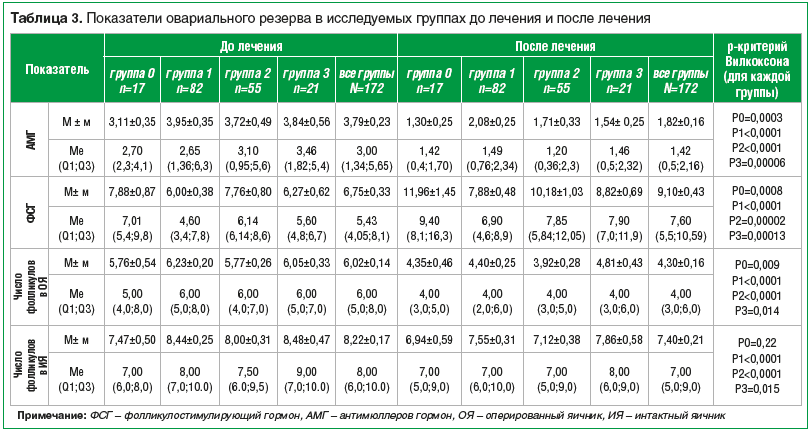
Менее значимое снижение уровня АМГ после лечения отмечено в группе трипторелина, большее — в группе диеногеста, еще более выраженное — в группе КОК и наибольшее —
в группе пацинеток, не получавших гормономодулирующей терапии. Средний уровень АМГ при различных видах гормономодулирующей терапии представлен на рисунке 1.
Практически по всем наблюдаемым параметрам, за исключением числа фолликулов в интактном яичнике, наблюдалась высокозначимая динамика. По количеству фолликулов в интактном яичнике исследуемые группы значимо не различались.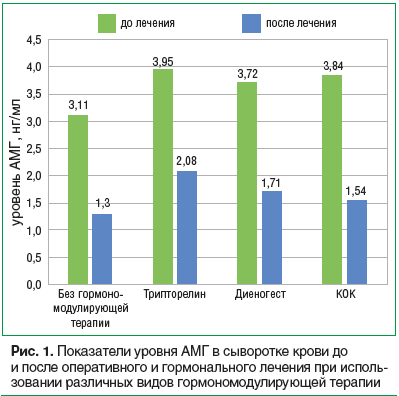
Из всех исследованных групп беременность (самостоятельная и после экстракорпорального оплодотворения (ЭКО)) наступила в 27,4% случаев, в 72,6% — беременность не наступила. При сравнении данных пациенток, получавших различные гормономодулирующие препараты и не получавших гормономодулирующей терапии, были обнаружены статистически значимые различия. Из 65 пациенток, получавших трипторелин, беременность наступила у 23 (35%) (из них у 16 — с применением ЭКО). Из 17 пациенток, не получавших гормономодулирующей терапии, беременность наступила у 1 (5,9%) пациентки после ЭКО. Между этими группами обнаружено статистически значимое различие: р=0,03 (точный двусторонний критерий Фишера). Из 40 пациенток, получавших диеногест, беременность наступила у 13 (32,5%), при сравнении этой группы с группой не получавших гормономодулирующей терапии выявлена тенденция к различию между группами (р=0,08). Из 19 пациенток, получавших КОК, беременность наступила у 1 (5,26%), при сравнении этой группы с группой не получавших гормономодулирующей терапии выявлено, что группы не различаются (р=1,0) (табл. 4).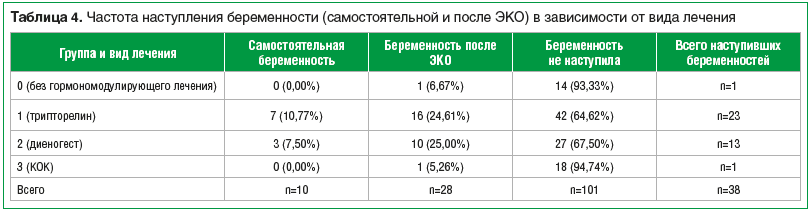
Среди 38 пациенток с наступившей беременностью (27,4% от всех участвующих в исследовании) большинство принимали трипторелин (60,5%), меньшее число пациенток принимали диеногест (34,21%). У пациенток, принимавших КОК, была самая низкая частота наступления беременности — 2,63%, что сравнимо с группой не получавших гормонального лечения в послеоперационном периоде — 2,63% (рис. 2).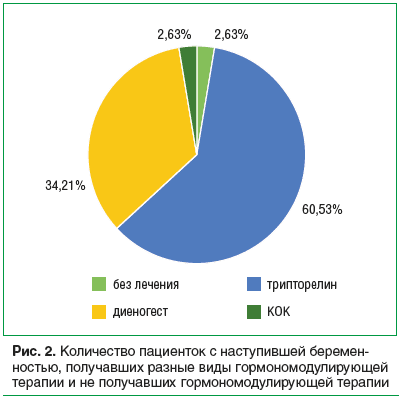
Проведен количественный анализ наступивших беременностей в зависимости от метода интраоперационного гемостаза и гормономодулирующей терапии. При использовании коагуляции во всех исследуемых группах беременность наступила в 27 (25%) случаях (в т. ч. с применением ВРТ —
в 21 (77,7%) случае), при использовании гемостатических матриц — в 13 (20,3%) случаях (в т. ч. с применением ВРТ — в 8 (61,5%) случаях) (табл. 5).
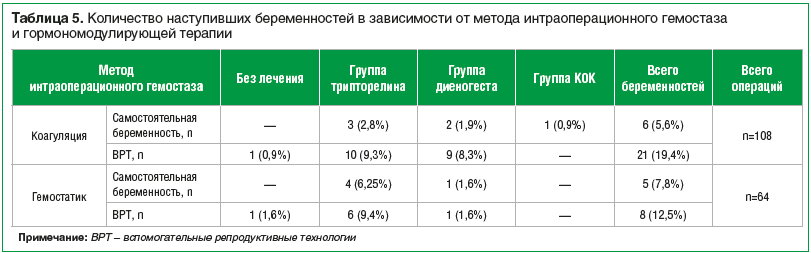
Из таблицы видно, что наибольшее количество беременностей наступило при использовании препаратов АГтРГ и гестагенов. Значительно меньше беременностей наступило при использовании КОК (0,9%) — так же, как в группе пациенток, у которых гормональное лечение не проводилось.
Заключение
По результатам исследования можно заключить, что наиболее эффективными группами препаратов для комплексного лечения эндометриоза у пациенток с бесплодием являются препараты АГтРГ и прогестины. КОК не показали себя как препараты выбора при лечении бесплодия. Хотя КОК, эффективность которых была подтверждена исследованиями, многие годы использовались для лечения эндометриоза (особенно у женщин, не планирующих беременность [8]) и для уменьшения болевого синдрома [9], в современных условиях их нельзя рекомендовать в качестве препаратов выбора при лечении больных эндометриозом. Из группы гестагенов — производных 19-нортестостерона препарат 4-го поколения диеногест значительно уменьшает болевой синдром, связанный с эндометриозом [10–12]. Мультицентровое рандомизированное контролируемое исследование, сравнивающее группу препаратов АГтРГ с диеногестом в сочетании с эстрадиолом в постхирургической терапии, сообщает, что обе группы увеличивают показатели качества жизни [13]. Известно, что для лечения эндометриоза при бесплодии препараты группы АГтРГ наиболее эффективны, но вызывают серьезный побочный эффект — снижают минеральную плотность костной ткани. Поэтому для профилактики остеопороза дополнительно необходимо использовать эстрогены [8, 14]. Эффективность АГтРГ в лечении бесплодия подтверждена рядом рандомизированных контролируемых исследований: у 165 женщин с эндометриозом показатели наступления беременности в циклах ЭКО увеличились в 4 раза при предварительном лечении препаратами АГтРГ в течение 3–6 мес. [15].
Литература
1. Giudice L.C., Kao L.C. Endometriosis // Lancet. 2004. Vol. 364(9447). P. 1789–1799.
2. Ярмолинская М.И., Беженарь В.Ф. Опыт применения диеногеста в комбинированном лечении генитального эндометриоза // Фарматека. 2013. № 3(256). С. 48–51 [Jarmolinskaja M.I, Bezhenar’ V.F. Opyt primenenija dienogesta v kombinirovannom lechenii genital’nogo jendometrioza // Farmateka. 2013. № 3(256). S. 48–51 (in Russian)].
3. Francisco J., Ruis-Flores., Juan A. Garcia-Velasco. Modern menegement of endometrioma-associated infertility: in favor of ART // J of Endometriosis and Pelvic Pain Disord. 2016. Vol. 8 P. 33–80.
4. Vercellini P., Chapron C., De Giorgi O. et al. Coagulation or excision of ovarian endometriomas? // Am J Obstet Gynecol. 2003. Vol. 188(3). Р. 606–610.
5. Periman S., Kjer J.J. Ovarian damage due to removal: a comparison of endometriomas and dermoid cyst // Acta Obstet Gynecol Scand. 2016. Vol. 95(3). P. 285–290.
6. Somigliana E., Benaglia L., Vigano P. et al. Surgical measures for endometriosis-related infertility, a plea for research // Placenta. 2011. Vol. 32(Suppl 3). P. 238–242.
7. Somigliana E., Berlanda N., Benaglia L. et al. Surgical excision of endometriomas and ovarian reserve: a systematic review on serum antimullerian hormone level modifications // Fertil Steril. 2012. Vol. 98. P. 1531–1538.
8. Zito G., Luppy S., Giolo E. et al. Medical treatments for endometriosis-assotiated pelvic pain // Biomed Research International. 2014. Vol. 19. P. 1967. doi:10.1155/2014/191967
9. Harada T., Momoeda M., Taketani Y. et al. Low-dose oral contraceptive pill for dysmenorrhea associated with endometrosis: a placebo-controlled, double-blind, randomized trial // Fertility and Sterility. 2008. Vol. 95. P. 1295–1301.
10. Angioni S., Cofelice V., Pontis A. et al. New trends of progestins treatment of endometriosis // Gynecological Endocrinilogy. 2014. Vol. 95. P. 2477–2480.
11. Andres Mde P., Lopes L.A., Baracat E.C., Podgaec S. Dienogest in the treatment of endometriosis: systematic review // Archives of Gynecological and Obstetrics. 2015. Vol. 292. P. 523–529.
12. Strowitzki T., Faustmann T., Gerlinger C. et al. Safety and tolerability of dienogest in endometriosis: pooled analysis from the European clinical study program // International Journal of Womens Health. 2015. Vol. 7. P. 393–401.
13. Granese R., Perino A., Calagna G. et al. Gonadotropin-releasing hormone analogue or dienogest plus estradiol valerate to prevent pain reccurence after laparoscopic surgery for endometriosis: a multy-center randomized trial // Acta Obstetricia et Gynecologica Scandinavica. 2015. Vol. 94. P. 637–645.
14. Leone Roberti Maggiore U., Scala C., Remorgida V. et al. Triptorelin for the treatment of endometriosis // Expert Opinion on Pharmacotherapy. 2014. Vol. 15. P. 1153–1149.
15. Sallam H.N., Garsia-Velasco J.A., Diass S., Arici A. Long-term pituitary down.regulation before in vitro fertilization (IVF) for women with endometriosis // Cochrane Database Syst Rev. 2006. 1. CD004635.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru




