Введение
Распространенность аутоиммунного гастрита (АИГ) во взрослой популяции варьирует от 1 до 8%, чаще встречается у женщин (соотношение женщин и мужчин составляет 3:1) и в возрастной группе от 35 до 45 лет [1, 2]. Характерной особенностью пациентов с АИГ является его частое сочетание с другими аутоиммунными патологиями, что значительно снижает качество жизни пациентов. Согласно эпидемиологическим данным частота сопутствующих аутоиммунных заболеваний при АИГ достигает 40%. Прежде всего для данной когорты пациентов характерно наличие таких сопутствующих аутоиммунных заболеваний, как аутоиммунный тиреоидит, сахарный диабет 1 типа, гемолитическая анемия, витилиго, алопеция, ревматоидный артрит, псориаз, аутоиммунный гепатит, миастения и болезнь Шегрена [3].
Известно, что АИГ приводит к атрофии слизистой оболочки желудка (СОЖ) с поражением кислотопродуцирующей зоны — тела и свода желудка, где сосредоточена основная масса париетальных клеток, против которых направлены аутоантитела. Известно, что хронический атрофический гастрит (ХАГ) чаще всего является результатом длительной персистенции инфекции Helicobacter pylori (НР) [4], при этом характерно первоначальное поражение муцинпродуцирующей зоны (антральный отдел) с последующим распространением атрофии на тело желудка. Причинами формирования тотального ХАГ при инфекции НР могут быть сопутствующий АИГ и изменение топографии колонизации бактерии при длительном приеме ингибиторов протонной помпы [5]. Ведение больных ХАГ, у которых в патологический процесс вовлечены оба отдела желудка, является сложной задачей для клинициста как в отношении установления этиологии на этапе диагностического поиска, так и в выборе тактики лечения и наблюдения.
Важно подчеркнуть, что согласно современным представлениям проканцерогенный потенциал при АИГ увеличивается в случае предшествующей либо текущей инфекции НР [6]. По данным I. Kato et al. [7], риск рака желудка (РЖ) повышается пропорционально увеличению стадии атрофии СОЖ и более выражен при ее локализации по малой кривизне, при этом к группе высокого риска следует относить пациентов с тяжелой атрофией (стадии III–IV по OLGA/OLGIM) [8]. При так называемом «чистом» АИГ, когда у пациента отмечается лишь аутоиммунное воспаление СОЖ, возрастает риск формирования нейроэндокринных опухолей (НЭО) 1 типа [9]. Это связано со стойкой гипергастринемией на фоне снижения кислотопродуцирующей функции желез тела желудка, которая приводит к компенсаторной гиперплазии энтерохромаффиноподобных клеток с постепенной прогрессий в НЭО 1 типа. Механизм образования НЭО 1 типа объясняет частые рецидивы опухоли после эндоскопической резекции (средний интервал 24 мес.), при этом прогноз для пациента в целом благоприятный, 5-летняя выживаемость достигает 100%, а риск метастазирования оценивается как низкий [10–12].
Согласно действующим клиническим рекомендациям Российской гастроэнтерологической ассоциации ключевым этапом диагностики гастрита является проведение эзофагогастродуоденоскопии (ЭГДС) с забором гастробиоптатов по Сиднейской системе и последующим морфологическим исследованием по OLGA. Показаниями для направления пациента с симптомами диспепсии на ЭГДС являются возраст старше 50 лет либо наличие симптомов тревоги, которые могут указывать на органическую патологию: отягощенный наследственный анамнез в отношении РЖ, необъяснимая потеря веса, признаки кровотечения из пищеварительного тракта, изменение лабораторных показателей, прежде всего наличие анемии [13, 14].
Синдром диспепсии при АИГ имеет свои особенности. Более чем 55% пациентов с ХАГ беспокоят проявления диспепсии по типу постпрандиального дистресс-синдрома ввиду замедления моторной активности [15]. Предполагают, что, с одной стороны, это обусловлено воспалением и повреждением зоны пейсмейкерной активности (убыль клеток Кахаля), преимущественно расположенной в теле желудка [16, 17], а с другой — задержкой эвакуации желудочного содержимого как следствием гипохлоргидрии [18]. У части больных может наблюдаться длительное бессимптомное течение, а клинический дебют проявляется анемическим синдромом, неврологическими нарушениями, в том числе в виде фуникулярного миелоза, которые развиваются на фоне дефицита витамина B12 и/или железа [19–21]. Кроме того, в последние годы при АИГ описывается дефицит других витаминов и микронутриентов, включая витамин С, витамин D, фолиевую кислоту и кальций [20].
Собственные данные (серия клинических наблюдений)
На основании наблюдения за пациентами на базе нашего исследовательского центра с подтвержденным диагнозом АИГ мы провели систематизацию данных с целью поиска морфологических предикторов заболевания и информирования клиницистов о возможных трудностях диагностического поиска АИГ.
Нами сформирована база данных 91 пациента с АИГ, среди которых 14 (15,4%) мужчин (средний возраст 55,8±10,28 года) и 77 (84,6%) женщин (средний возраст 55,56±12,32 года). Диспептический синдром выявлен у 40 (43,96%) больных, главным образом постпрандиальный дистресс-синдром. Среди сопутствующих заболеваний аутоиммунный тиреоидит встречался у 41 (45,05%), сахарный диабет 1 типа — у 7 (7,69%) пациентов.
В ходе динамического наблюдения за пациентами нами отмечено, что уровень гемоглобина соответствовал нормальным значениям и в группе мужчин, и в группе женщин. Вместе с тем у подавляющего большинства женщин было отмечено снижение уровня ферритина, отражающее латентный дефицит железа, тогда как среди мужчин выявлена тенденция к снижению содержания витамина B12. У 26 (28,57%) пациентов диагностирована инфекция НР.
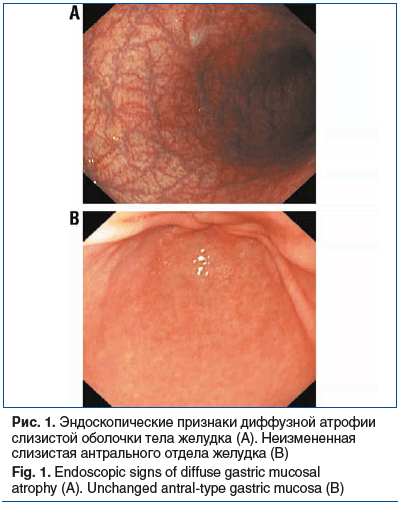
При ЭГДС был определен ряд характерных визуальных признаков, которые позволяют предположить аутоиммунный генез атрофии СОЖ. Ведущим признаком АИГ были выраженные атрофические изменения с преимущественной локализацией в теле желудка, однако у 23 (25,27%) пациентов мы зафиксировали тотальный гастрит, вероятно, обусловленный сопутствующей НР-инфекцией. Изменения в антральном отделе варьировали от практически неизмененной слизистой до отчетливо визуально различимой атрофии и/или кишечной метаплазии (рис. 1).
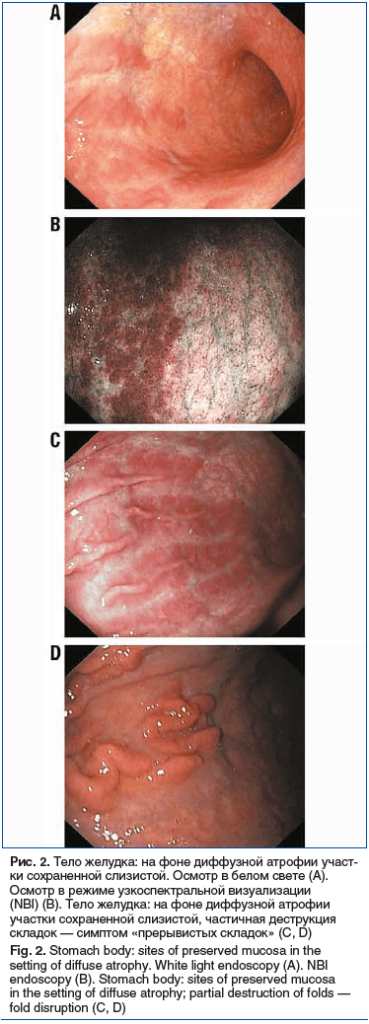
У 26 (28,57%) обследованных на фоне атрофических изменений СОЖ определялись островки сохранившейся кислотопродуцирующей зоны в теле желудка, в виде ярко-красных слегка возвышающихся участков. Одной из форм указанного признака служит симптом «прерывающихся складок», при котором складки приобретают характерный пунктирный вид (рис. 2).
К числу характерных эндоскопических признаков АИГ следует отнести особенности секрета желудка. Так, у наших пациентов обнаруживалась вязкая, густая слизь, плотно фиксированная к СОЖ, отмывание которой было возможно только при форсированной подаче воды или при использовании муколитиков (рис. 3A). У 6 (6,59%) пациентов выявлен симптом «белых сфер», представляющий собой множественные слегка приподнятые круглые белесоватые образования, расположенные в своде и теле желудка (рис. 3B).
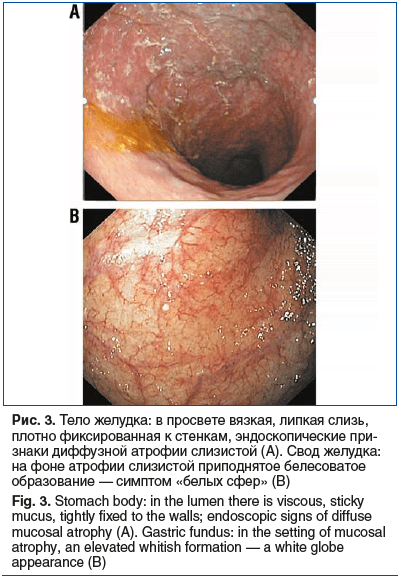
По данным литературы, эндоскопический признак «белые сферы» встречается в 32% случаев АИГ, его значение и механизмы образования до конца не изучены. Ранее «белые сферы» наблюдали только при РЖ [22–24], в более поздних исследованиях признак описан и при доброкачественных изменениях СОЖ. При этом установлено, что патоморфологические особенности различаются в случаях со злокачественными поражениями и без них [25]. В гастробиоптатах СОЖ с «белыми сферами» при злокачественном процессе в просвете расширенных желез обнаруживается эозинофильный материал с некротическими фрагментами эпителия [22, 23, 26]. В СОЖ с «белыми сферами» без РЖ наблюдается кистозное расширение фундальных желез желудка и не выявляется эозинофильный материал с некротическими фрагментами эпителия [25]. M. Iwamuro et al. [27] предложили две гипотезы образования «белых сфер» при АИГ. Согласно первой, основной механизм — это обструкция оттока секрета желез СОЖ: при АИГ на фоне воспаления происходит сужение или коллапс протоков, что в конечном итоге приводит к кистозной трансформации желез. Согласно второй гипотезе образование «белых сфер» может быть связано с гипергастринемией, однако конкретные механизмы такой взаимосвязи не выяснены.
У 26 (28,57%) обследованных выявлены одиночные или множественные гиперпластические полипы (ГП) с преимущественной локализацией в теле желудка, реже в антральном отделе (рис. 4). По Парижской эндоскопической классификации поверхностных опухолевых поражений ГП у 19 (73,08%) пациентов соответствовали типу 0–Is, у 4 (15,38%) — 0–Ip, размеры образований варьировали от 0,2 до 0,9 см.
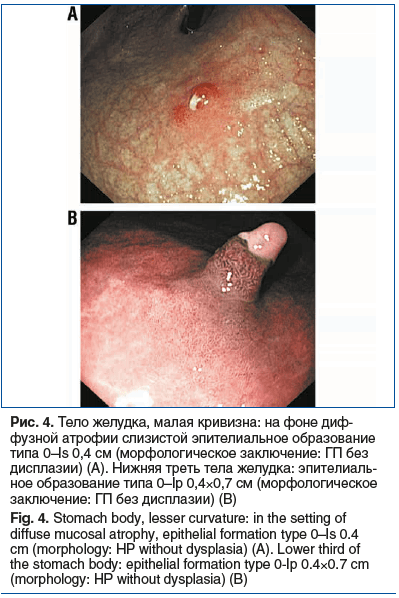
Сообщается, что ГП желудка обнаруживаются более чем в 20% случаев АИГ [28], однако, имея достаточно низкий потенциал злокачественной трансформации, рассматриваются, скорее, как индикатор наличия патологического процесса в СОЖ, а не как фактор риска РЖ. Частота развития дисплазии в ГП варьирует в пределах от 1,9 до 19%, чаще встречается при ГП размером более 1 см и типе «на ножке» (0-Ip) [29, 30].
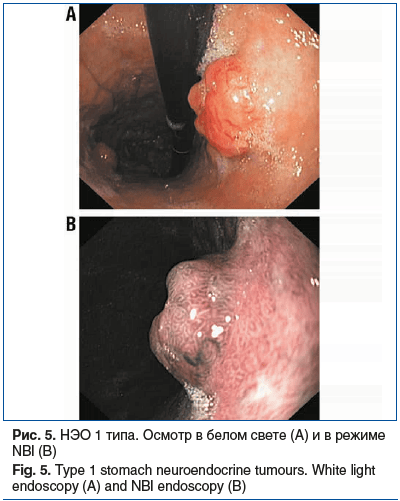
У 5 (5,49%) обследованных обнаружены НЭО 1 типа, которые представляли собой небольшие множественные образования, расположенные в теле или своде желудка, размерами от 0,5 до 3,5 см. При осмотре в режиме узкоспектральной визуалазации (NBI) характерными признаками НЭО 1 типа были извитые расширенные субэпителиальные сосуды, извитая архитектоника ямок (рис. 5).
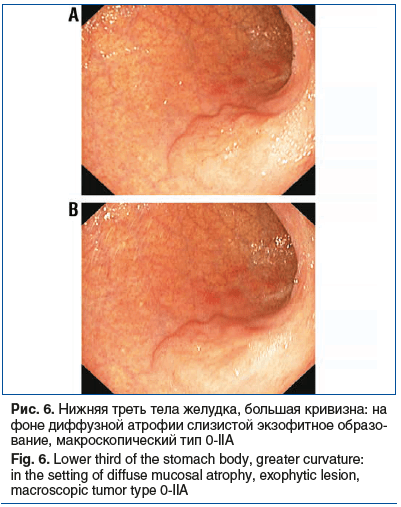
У 1 (1,1%) пациента на фоне АИГ и инфекции НР в нижней трети тела желудка выявлен аденоматозный полип с дисплазией low grade (рис. 6).
Подходы к диагностике и лечению АИГ
Гистологическое исследование биопсийного материала СОЖ является важным этапом верификации диагноза хронического гастрита. Оно позволяет установить степень воспаления и стадию атрофии по системе OLGА, что необходимо для понимания риска развития РЖ у конкретного пациента и разработки индивидуальной программы ведения. При ХАГ обнаруживается морфологическая трансформация СОЖ, которая осуществляется в три стадии. При начальной (первой) стадии характерно обнаружение диффузной или мультифокальной инфильтрации пластинки, воспаления слизистой оболочки лимфоцитами и плазматическими клетками, часто с примесью эозинофилов и тучных клеток. Вследствие гипергастринемии для данной стадии характерна и гиперплазия париетальных клеток. В развернутую (вторую) стадию формируются выраженные атрофические изменения париетальных желез, диффузная лимфоплазмоцитарная инфильтрация собственной пластинки, которая сопровождается уменьшением высоты желез и увеличением соотношения высоты покровно-ямочного слоя к железистому эпителию, формируется псевдопилорическая метаплазия. На конечной (третьей) стадии, помимо выраженной атрофии кислотопродуцирующих желез, наблюдается фовеолярная гиперплазия, а в ряде случаев — формирование ГП [31, 32].
По нашим данным, у пациентов с АИГ I и II стадии по OLGA встречались с частотой 65%, III и IV — с частотой 35%. Все случаи НЭО 1 типа и аденома желудка были выявлены у пациентов с тяжелой атрофией СОЖ. Вместе с тем более тяжелая стадия атрофии отмечалась среди пациентов, инфицированных НР. Полученные данные согласуются с результатами опубликованных ранее исследований. Так, в ретроспективном исследовании (n=562 набора биопсий) среди пациентов с изолированным течением АИГ преобладали стадии легкой атрофии (91,8%), тогда как тяжелые (III–IV) стадии атрофии и неоплазии желудка были ассоциированы с сопутствующей инфекцией НР [33].
Актуальным методом первичной диагностики ХАГ остается и «серологическая биопсия», т. е. оценка уровней сывороточных пепсиногенов с расчетом индекса пепсиноген I / пепсиноген II и гастрина-17, что особенно актуально для молодых пациентов без симптомов тревоги и факторов риска, отказавшихся от проведения ЭГДС. Для ХАГ характерно снижение уровня пепсиногена I менее 30 мкг/л и соотношение пепсиногена I и пепсиногена II <3 в сочетании с повышением уровня гастрина-17 более чем на 30 пмоль/л [34].
В настоящее время не существует средств этиотропной терапии АИГ. Пациентам с АИГ прежде всего рекомендуется ограничение употребления поваренной соли и обогащение рациона свежими овощами и фруктами. Исследования демонстрируют, что преобладание в рационе маринованных, ферментированных, обработанных или копченых продуктов с высоким содержанием нитритов и нитрозаминов [35], в том числе приготовленных с помощью гриля, жарки или фритюра [36, 37], а также избыточное использование соли в процессе готовки и частое употребление красного мяса [38] повышают риск развития РЖ, в том числе у пациентов с ХАГ [39], что диктует необходимость ограничения этих продуктов у пациентов с АИГ.
Помимо прочего, тактика ведения пациентов с АИГ должна включать в себя использование всего доступного арсенала тестов для диагностики HР, а в случае положительных результатов тестирования — проведение эрадикационной терапии в соответствии с действующими клиническими рекомендациями по диагностике и лечению инфекции HР у взрослых [13, 40].
С учетом отсутствия принципиально новых препаратов для лечения инфекции HP особую актуальность приобретает оптимизация существующих схем эрадикации [41].
Первый метаанализ эффективности добавления ребамипида в схемы эрадикации, опубликованный японскими исследователями, включал 611 пациентов. Отношение шансов (ОШ) успешнойэрадикации при назначении ребамипида составило 1,74 (95% доверительный интервал (ДИ) 1,19–2,53), частота развития побочных эффектов в обеих группах не отличалась (ОШ 0,69, 95% ДИ 0,376–1,300, р=0,329) [42]. По данным недавно опубликованного метаанализа, добавление ребамипида в схемы эрадикации достоверно улучшает результаты лечения. Проанализированы данные 531 пациента (в группах с ребамипидом (Ребагит®) — 273, в группах без ребамипида — 258). Обобщенная эффективность схем эрадикации с ребамипидом составила 90,4% (95% ДИ 86,3–93,6), без ребамипида — 81,6% (95% ДИ 76,5–86,1). Добавление ребамипида в схемы эрадикации повышает эффективность лечения — ОШ 2,162 (95% ДИ 1,268–3,685, p=0,005). У пациентов, принимавших ребамипид, отмечено снижение частоты побочных явлений — ОШ 0,569 (95% ДИ 0,333–0,970, p=0,038) [43]. Устранение сопутствующей НР-инфекции крайне важно для пациентов, страдающих АИГ, с патогенетической точки зрения и с учетом ведущей роли инфекции в канцерогенезе. Данные об эффективности ребамипида в лечении атрофии при АИГ накапливаются. В настоящее время убедительной выглядит рекомендация по пролонгации приема ребамипида у данной когорты пациентов как с целью устранения синдрома повышенной эпителиальной проницаемости, так и для уменьшения выраженности воспалительного ответа. Особо следует отметить, что отсутствует необходимость отмены ребамипида перед проведением тестирования на НР как для первичной диагностики, так и для контроля эффективности эрадикации [44].
Ребамипид способен усиливать защиту СОЖ за счет увеличения продукции эндогенных простагландинов и ингибирования образования свободных радикалов, кроме того, он оказывает противовоспалительное действие, ингибируя цитокины и препятствуя активации нейтрофилов [45, 46]. На сегодня ребамипид является единственным гастропротектором, который может улучшать гистологическую картину ХАГ, что представляет особый интерес в рамках стратегии канцеропревенции. Так, в корейском исследовании было показано, что прием ребамипида ассоциирован с уменьшением частоты случаев РЖ у пациентов с высоким риском его развития. Была продемонстрирована дозозависимость канцеропревентивного действия ребамипида. При этом исследователи не отметили влияния длительности приема ребамипида на появление нежелательных явлений [47]. Ребамипид упоминается в Европейских рекомендациях по лечению предраковых состояний и изменений эпителия желудка 2019 г. (MAPS II) [48].
Безусловно, пациенты с АИГ нуждаются в восполнении дефицита микронутриентов и витаминов при их дефиците (витамины B12, С и D, фолиевая кислота, кальций, железо), в том числе проведении профилактических курсов терапии препаратами железа и цианокобаламином для предотвращения формирования гематологических (железодефицитная анемия, B12-дефицитная анемия) и неврологических (фуникулярный миелоз) проявлений заболевания [49, 50].
Заключение
Сложности диагностики АИГ обусловлены отсутствием типичных жалоб, доступных в широкой клинической практике лабораторных маркеров заболевания, недостаточной осведомленностью врачей-эндоскопистов и морфологов о признаках АИГ. К категории риска АИГ должны быть отнесены пациенты с симптомами диспепсии и сопутствующими аутоиммунными заболеваниями, проявлениями явного или скрытого железо- и/или B12-дефицита. Пациентам из группы риска обязательно выполнение ЭГДС с мультифокальной биопсией по Сиднейскому протоколу и оценкой гастробиоптатов по системе OLGA. Дополнительным критерием диагноза может быть определение уровней гастрина-17, пепсиногенов I и II с расчетом индекса пепсиноген I / пепсиноген II. Подтверждает диагноз АИГ выявление антител к париетальным клеткам и/или внутреннему фактору Касла. У больных АИГ должна быть исключена или вылечена НР-инфекция.
В качестве основных эндоскопических признаков АИГ рассматриваются мозаичность изменений с наличием участков сохраненной слизистой, наличие вязкого, липкого секрета в просвете желудка, обнаружение «белых сфер», ГП и НЭО 1 типа. Возможности современной эндоскопии существенно улучшают диагностику, позволяют своевременно выявлять и проводить малоинвазивное лечение осложнений АИГ. Ребамипид является привлекательной молекулой, продемонстрировавшей свою эффективность в улучшении морфологической картины у пациентов с ХАГ, а добавление ребамипида в схемы эрадикации НР повышает ее эффективность.
СВЕДЕНИЯ ОБ АВТОРАХ:
Щелоченков Сергей Владимирович — к.м.н., доцент кафедры терапии «Института медицины и наук о жизни» ФГАОУ ВО «Балтийский федеральный университет имени Иммануила Канта»; 236016, Россия, г. Калининград, ул. А. Невского, д. 14; ассистент кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0002-3811-2492.
Бордин Дмитрий Станиславович — д.м.н., заведующий отделом патологии поджелудочной железы, желчных путей и верхних отделов пищеварительного тракта ГБУЗ МКНЦ имени А.С. Логинова ДЗМ; 111123, Россия, г. Москва, ш. Энтузиастов, д. 86, стр. 6; профессор кафедры пропедевтики внутренних болезней и гастроэнтерологии ФГБОУ ВО «Российский университет медицины» Минздрава России; 127473, Россия, г. Москва, ул. Делегатская, д. 20, стр. 1; профессор кафедры общей врачебной практики и семейной медицины ФГБОУ ВО Тверской ГМУ Минздрава России; 170100, Россия, г. Тверь, ул. Советская, д. 4; ORCID iD 0000-0003-2815-3992.
Чеботарева Маргарита Викторовна — специалист организационно-методического отдела по гастроэнтерологии ДЗМ, младший научный сотрудник лаборатории функциональной диагностики заболеваний пищевода и желудка ГБУЗ МКНЦ имени А.С. Логинова ДЗМ; 111123, Россия, г. Москва, ш. Энтузиастов, д. 86, стр. 6.
Лисовский Максим Андреевич — ординатор кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12; ORCID iD 0000-0001-9674-0545.
Губанова Анастасия Викторовна — гастроэнтеролог, ассистент кафедры факультетской терапии и гастроэнтерологии ФГБОУ ВО ОмГМУ Минздрава России; 644099, Россия, г. Омск, ул. Ленина, д. 12.
Гуськова Оксана Николаевна — к.м.н., заведующая кафедрой патологической анатомии ФГБОУ ВО Тверской ГМУ Минздрава России; 170100, Россия, г. Тверь, ул. Советская, д. 4; ORCID iD 0000-0003-1635-7533.
Контактная информация: Щелоченков Сергей Владимирович, e-mail: workmedbox@gmail.com.
Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 05.04.2024.
Поступила после рецензирования 30.04.2024.
Принята в печать 28.05.2024.
ABOUT THE AUTHORS:
Sergey V. Shchelochenkov — C. Sc. (Med.), Associate Professor of the Department of Therapy of the Institute of Medicine and Life Sciences, Immanuel Kant Baltic Federal University; 14, A. Nevskii str., Kaliningrad, 236016, Russian Federation; Associate Professor of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-3811-2492.
Dmitry S. Bordin — Dr. Sc. (Mеd.), Head of the Department of Pathology of the Pancreas, Biliary Tract and Upper Digestive Tract, A.S. Loginov Moscow Clinical Research Center; 86, Entuziastov road, Moscow, 111123, Russian Federation; Professor of the Department of Propaedeutics of Internal Diseases and Gastroenterology, Russian University of Medicine; 20, build. 1, Delegatskaya str., Moscow, 127473, Russian Federation; Professor of the Department of General Medical Practice and Family Medicine, Tver State Medical University; 4, Sovetskaya str., Tver, 170100, Russian Federation; ORCID iD 0000-0003-2815-3992.
Margarita V. Chebotareva — specialist of the Organizational and Methodological Department of Gastroenterology Moscow Health Department, Junior Researcher at the Laboratory of Functional Diagnostics of the Esophagus and Stomach Diseases, A.S. Loginov Moscow Clinical Research Center; 86, Entuziastov road, Moscow, 111123, Russian Federation.
Maxim M. Lisovskiy — resident of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-9674-0545.
Anastasia V. Gubanova — gastroenterologist, Assistant Professor of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation.
Oksana N. Guskova — C. Sc. (Med.), Head of the Department of Pathological Anatomy, Tver State Medical University; 4, Sovetskaya str., Tver, 170100, Russian Federation; ORCID iD 0000-0003-1635-7533.
Contact information: Sergey V. Shchelochenkov, e-mail: workmedbox@gmail.com.
Financial Disclosure: the authors have no financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 05.04.2024.
Revised 30.04.2024.
Accepted 28.05.2024.
Информация с rmj.ru






