Введение
Болезнь Хираяма (БХ), или мономелическая амиотрофия, — редкое неврологическое заболевание, относящееся к доброкачественным поражениям двигательных нейронов. Это заболевание впервые было описано японским неврологом Keizo Hirayama и соавт. в 1959 г. по результатам обследования 12 пациентов с односторонней мышечной атрофией верхней конечности [1].
Выдвинуто множество теорий, объясняющих этиопатогенез БХ. Теория «контактного давления», представленная в 1960 г., предполагает, что спинной мозг натягивается над аномальными костными структурами (спондилофиты) в спинномозговом канале в положении сгибания, что приводит к его травматизации. Теория «плотного дурального канала при сгибании» была предложена в 1987 г. Эта наиболее распространенная теория описывает повышенную растяжимость твердой мозговой оболочки (от верхних участков ее прикрепления на дорсальных поверхностях позвонков C2 и C3), которая в норме препятствует движению спинного мозга вперед при сгибании шейного отдела. Повышенная «дряблость» твердой мозговой оболочки позволяет спинному мозгу смещаться вперед, вызывая многочисленные эпизоды субклинической травмы шейного отдела и приводя к ишемии передних рогов спинного мозга во время сгибания шейного отдела позвоночника. В конечном итоге это приводит к миелопатии и дегенерации тканей нервной системы [2]. Кроме того, K. Hirayama предположил, что смещение твердой мозговой оболочки кпереди создает отрицательное давление в зад-нем эпидуральном пространстве, затрудняя венозный возврат при сгибании шеи. Это приводит к оттоку крови в заднее эпидуральное сплетение, что вызывает ишемию клеток передних рогов и вентральных нервных корешков шейного отдела спинного мозга.
Некоторые исследования показали, что иммунологические факторы также способствуют развитию патологического процесса. J. Kira et al. [3] сообщили о высокой частоте сопутствующих атопических расстройств, увеличении содержания в крови как общего IgE, так и специфического IgE к антигенам клещей, а также о семейном анамнезе аллергических заболеваний у пациентов. В исследовании S. Ito et al. [4] показано, что увеличение концентрации IgE связано с тяжелой инвалидизацией пациентов с БХ, существует прямая корреляция между уровнем IgE и продолжительностью прогрессирования заболевания.
Болезнь Хираяма — редкое заболевание. С момента его первого упоминания и до 2014 г. было описано менее 1500 случаев. Наиболее распространено заболевание среди азиатской популяции. На сегодняшний день наибольшее число случаев БХ зарегистрировано в Японии (n=333) [5], Индии (n=279) [6] и Китае (n=179) [7]. Заболевание чаще отмечается у мужчин, тем не менее описаны случаи развития БХ у женщин [8]. Дебют заболевания приходится на подростковый возраст и начало полового созревания.
Классическая клиническая картина включает 5 основных симптомов:
-
слабость в дистальных отделах одной или асимметрично — обеих верхних конечностей, преимущественно на локтевой стороне, более выраженная атрофия мышц на локтевой стороне («синдром обратной расщепленной руки») наблюдается у большинства пациентов; чаще отмечается более выраженное поражение правой руки (соотношение 2,8:1), независимо от доминирования руки;
-
незаметное начало и прогрессирование в течение 3–5 лет, за которым следует стабилизация или регресс симптомов;
-
нерегулярный, грубый кинетический тремор пальцев пораженной руки / рук;
-
легкое ухудшение симптомов при воздействии холода;
-
отсутствие сенсорных нарушений.
К атипичным признакам заболевания относят признаки пирамидной недостаточности (особенно признак Гоффмана), атрофию проксимальных отделов одной или обеих конечностей, постоянное прогрессирование и ухудшение симптомов, выраженные сенсорные нарушения. Наличие этих признаков ассоциировано с более тяжелым течением БХ и менее благоприятным прогнозом [9].
Среди инструментальных методов исследования для диагностики БХ наиболее часто используют магнитно-резонансную томографию (МРТ) и электронейромиографию (ЭНМГ).
По данным МРТ обычно визуализируется серповидное поражение заднего эпидурального пространства нижнего шейного отдела или атрофичный спинной мозг, легкое асимметричное уплощение корешков и повышенная интенсивность сигнала. Подтвердить диагноз можно только с помощью МРТ в специальном положении со сгибанием в шейном отделе позвоночника. В таком положении можно увидеть отчетливые изменения расположения мягкотканных структур, в частности переднее смещение шейного дурального мешка от пластинки в области C4–C7, что позволяет говорить о хронической микротравме, а также постконтрастное усиление заднего эпидурального венозного сплетения вследствие расширения эпидуральных вен, что указывает на ишемию [10].
Одним из специфических признаков БХ служит симптом «змеиных глаз», характеризующийся возникновением симметричных двусторонних небольших гиперинтенсивных очагов, похожих на морду змеи, в аксиальной проекции Т2-взвешенной последовательности (Т2ВИ) МРТ. В литературе его также называют «симптомом совиных глаз» или «симптомом жареных яиц». Патологоанатомически он представляет собой кистозный некроз на стыке центрального серого вещества вблизи вентролатерального зад-него столба [11].
Данные ЭНМГ указывают на значительные изменения в мышцах, иннервируемых сегментами C7, C8 и Th1. Исследование нервной проводимости демонстрирует снижение амплитуды комплексного мышечного потенциала действия (КМПД), наиболее выраженное в срединном нерве. При проведении ЭНМГ выявляются признаки хронической денервации в виде высокой амплитуды потенциала действия с большой продолжительностью и отсутствие фасцикуляций в состоянии покоя в мышцах, иннервируемых C7, C8 и Th1. Необходимо отметить, что эти изменения усиливаются при снижении температуры.
Отсутствие КПМД или снижение его амплитуды в мышце, отводящей мизинец, при сохранности в короткой мышце, отводящей большой палец кисти, характерно для синдрома «обратной расщепленной руки». Этот синдром наблюдается при БХ и помогает отличить ее от бокового амиотрофического склероза, при котором наблюдается «синдром обратной руки». Развитие поражения связано с прогрессирующим снижением и последующим исчезновением F-волны [9].
Критерии, позволяющие диагностировать БХ, представлены в таблице.
![Таблица. Диагностические критерии БХ [12] Table. Diagnostic criteria for HD [12] Таблица. Диагностические критерии БХ [12] Table. Diagnostic criteria for HD [12]](https://medblog.su/wp-content/uploads/2025/01/Atipichnaya-forma-bolezni-Hirayama-klinicheskoe-nablyudenie-Kondratov-AA-Kotov.png)
Хотя БХ считают самоограничивающимся состоянием, его долгосрочные последствия требуют лечения.
В 2021 г. предложена система классификации Хуашань, определяющая тактику лечения БХ в зависимости от ее клинических проявлений [12, 13]:
-
I тип — атрофия мышц кисти и предплечья или асимметричная двусторонняя атрофия мышц верхних конечностей с подтипами Ia (стабильная) и Ib (прогрессирующая);
-
II тип — односторонняя атрофия внутренних мышц кисти и мышц предплечья или асимметричная двусторонняя атрофия мышц верхней конечности в сочетании с признаками поражения пирамидных трактов;
-
III тип — атипичный вариант с атрофией проксимальных мышц верхних конечностей или сенсорными нарушениями.
-
При заболевании I и III типов первоначально рекомендуется консервативный подход, при заболевании II типа — хирургическое вмешательство.
Основной метод консервативного лечения — использование шейного воротника для уменьшения подвижности шейного отдела позвоночника и предотвращения чрезмерного сгибания шеи. Согласно проведенным исследованиям воротник необходимо носить в течение 3–4 лет, пока не наступит ожидаемое плато в течении заболевания. Кроме того, применяют физиотерапевтическое лечение, направленное на увеличение силы задних шейных разгибателей, что улучшает сагиттальное выравнивание шейного отдела позвоночника [14].
Хирургическое вмешательство может быть рекомендовано при запущенных, тяжелых или рефрактерных формах заболевания. Наиболее распространенный вариант хирургического лечения — дуропластика с ламинопластикой и фиксацией шейного отдела позвоночника путем артродеза либо без таковой. Непосредственный эффект от процедуры можно определить с помощью интраоперационного УЗИ, демонстрирующего снижение пульсации спинного мозга, и по увеличению амплитуды проводящих потенциалов спинного мозга, отмечаемому после рассечения дурального мешка [15].
Клиническое наблюдение
Пациент С., 1950 г. р., в октябре 2022 г. поступил в неврологическое отделение ГБУЗ МО МОНИКИ им. М.Ф. Владимирского с жалобами на слабость в обеих руках, онемение кистей, судороги в правой ноге, боль по задней поверхности шеи. Со слов пациента, данные симптомы медленно прогрессируют в течение 30 лет.
По данным МРТ шейного отдела спинного мозга, выполненного до госпитализации, выявлена его атрофия на уровне С2–С6, в его структуре на уровне С2–С5 определяется кистозная полость неправильной формы. Начиная с уровня С3 и далее вниз до уровня Th7 в переднем и заднем эпидуральных пространствах определяются эпидуральные гигромы, которые оттесняют твердую мозговую оболочку, не сдавливая при этом спинной мозг.
Амбулаторно выполнена стимуляционная и игольчатая ЭНМГ с верхних конечностей, данные которой соответствуют частичному аксональному поражению корешков С5, С6 больше справа, С7 и С8 больше слева, с косвенными признаками миелопатии на уровне шейного утолщения.
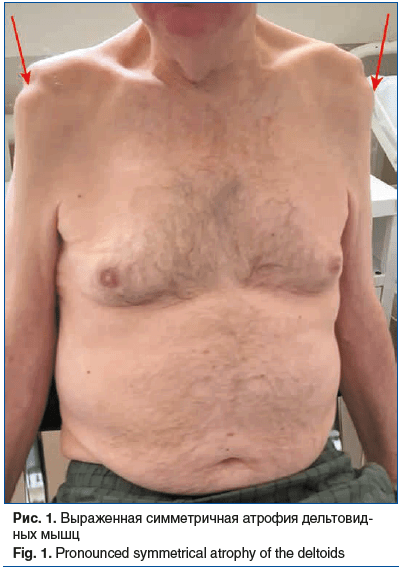
При оценке неврологического статуса обращает на себя внимание выраженная атрофия мышц плечевого пояса (рис. 1); симметричное снижение мышечной силы в верхних конечностях проксимально до 1 балла, дистально до 4 баллов; равномерное снижение мышечного тонуса и сухожильных рефлексов в верхних конечностях; снижение вибрационной чувствительности в верхних конечностях до 6 градиентных единиц.
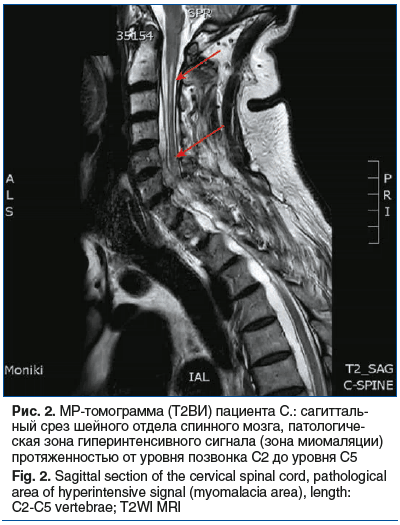
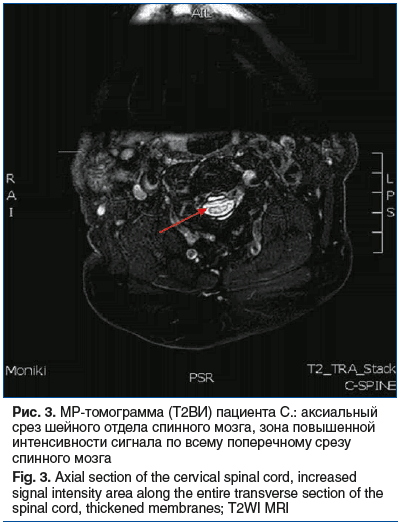
В неврологическом отделении выполнена МРТ шейного отдела спинного мозга с контрастным усилением, по данным которой выявлены патологические зоны повышенной интенсивности сигнала на T2ВИ, протяженностью от уровня С2 до уровня С5, без четких контуров и границ; неравномерная деформация ликворопроводящих путей за счет формирования «дополнительных» перегородок; утолщение оболочек (рис. 2, 3).
Лабораторные исследования: клинический и биохимический анализы крови, общий анализ мочи, анализ на инфекции, анализ электролитов крови — в пределах референтных значений. Уровень креатинкиназы составил 53 Ед/л (норма 24–190).
У пациента проводилась дифференциальная диагностика между мономелической амиотрофией (БХ), болезнью двигательного нейрона, спинально-мышечными атрофиями, миодистрофией.
На основании анамнестических данных (длительное течение заболевания у мужчины с минимальными признаками прогрессирования), клинической картины в виде ограниченного поражения верхних конечностей (симметричная слабость и атрофия мышц плечевого пояса, умеренный сенсорный дефицит в дистальных отделах верхних конечностей), специфической картины по данным МРТ (атрофические изменения в шейном отделе спинного мозга), результатов стимуляционной и игольчатой ЭНМГ, с учетом отсутствия признаков одновременного поражения верхнего и нижнего мотонейронов и клинически значимых изменений в лабораторных анализах пациенту установлен диагноз БХ.
Заключение
В мире накопилось достаточное количество информации об этиопатогенезе, клинической картине и диагностике классической формы БХ, хотя заболевание встречается редко. Несмотря на то, что название заболевания «мономелическая амиотрофия» предполагает поражение преимущественно одной конечности, необходимо всегда помнить об атипичных проявлениях заболевания, что было продемонстрировано в данном клиническом наблюдении. Дальнейшее изучение патогенеза БХ позволит лучше понять течение заболевания и разработать более эффективные методы его лечения. Выбор этих методов должен основываться на индивидуальных особенностях пациента и степени выраженности симптомов. Современные хирургические способы лечения остаются спорными, поэтому перспективы исследований широки.
Сведения об авторах:
Кондратов Андрей Александрович — невролог ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0009-0007-4634-4684
Котов Алексей Сергеевич — д.м.н., профессор, заведующий кафедрой неврологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского; 129110, Россия, г. Москва, ул. Щепкина, д. 61/2; ORCID iD 0000-0003-2988-5706
Контактная информация: Кондратов Андрей Александрович, e-mail: mrandrewkon@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах и методах.
Конфликт интересов отсутствует.
Статья поступила 12.08.2024.
Поступила после рецензирования 04.09.2024.
Принята в печать 27.09.2024.
About the authors:
Andrey A. Kondratov — neurologist, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0009-0007-4634-4684
Alexey S. Kotov — Dr. Sc. (Med.), Professor, Head of the Department of Neurology, M.F. Vladimirskiy Moscow Regional Research and Clinical Institute; 61/2, Shchepkin str., Moscow, 129110, Russian Federation; ORCID iD 0000-0003-2988-5706
Contact information: Andrey A. Kondratov, e-mail: mrandrewkon@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 12.08.2024.
Revised 04.09.2024.
Accepted 27.09.2024.
Информация с rmj.ru




