Содержание статьи
Введение
Болезни системы кровообращения, вызванные атеросклеротическим поражением сосудов, являются лидерами в группе хронических неинфекционных заболеваний по влиянию на летальность, продолжительность и качество жизни в данной нозологической группе [1]. Согласно прогнозам к 2030 г. общая сердечно-сосудистая смертность приблизится к порогу в 24 млн случаев ежегодно, при этом практически половина в структуре летальности будет принадлежать заболеваниям, вызванным атеросклеротическим поражением сосудов [2].
С другой стороны, важной тенденцией современной демографии является увеличение продолжительности жизни и глобальное старение населения. По прогнозам экспертов Организации объединенных наций, число людей в возрастной категории старше 65 лет к середине текущего столетия возрастет до 30% от общего населения планеты и составит практически 2 млрд человек [3]. В этой связи особую значимость для современной медицины приобретает развитие гериатрической медицинской помощи, основным объектом воздействия которой являются гериатрические синдромы — сложные многофакторные состояния, формирующиеся в ответ на возраст-ассоциированное снижение функционирования органов и систем [4]. Из более чем трех десятков описанных в литературе гериатрических синдромов одна из ведущих ролей принадлежит 2 синдрому саркопении. Показано, что его развитие ассоциируется со снижением качества жизни и повышенным риском летального исхода. Согласно данным Американского центра по контролю заболеваемости (Center for Disease Control and Prevention, CDC) саркопения входит в пятерку основных факторов риска заболеваемости и смертности среди лиц старше 65 лет [4, 5].
В настоящее время чрезвычайно актуальными являются вопросы взаимосвязи различных состояний, в том числе атеросклероза и различных нарушений композиционного состава тела, с целью персонализации терапии.
Исследования последних лет демонстрируют широкую распространенность феномена саркопении при различных сердечно-сосудистых заболеваниях. За последнее десятиле тие опубликованы результаты множества исследовательских работ, свидетельствующие, что заболевания атеросклеротического генеза и нарушения композиционного состава тела имеют сходные факторы риска и общие патогенетические механизмы развития [6–11], а сочетание этих состояний объясняется не только возраст-ассоциированными дегенеративными изменениями в ор ганизме.
Пациенты с остеоартритом (ОА) подвержены высокому риску развития саркопении. Доказано, что мышечная слабость является важным фактором, определяющим боль и инвалидность при ОА. Снижение мышечной массы нижних конечностей часто наблюдается у пациентов с ОА, что приводит к увеличению риска падений [12]. Прогрессирующая мышечная слабость при ОА также связана с атрофией мышечных волокон, при этом результаты иссле e4ований демонстрируют уменьшение площади поперечного сечения мышц на 12–19% у пациентов с ОА коленного и тазобедренного суставов [13]. В ряде работ установлено, что пациенты 60 лет и старше с ОА имели меньшую мышечную массу или объем мышц, чем пациенты контрольных групп [14, 15].
Исследования, посвященные изучению ассоциации саркопении и атеросклероза разных локализаций у больных пожилого и старческого возраста с ОА коленного сустава, единичны, а их результаты разноречивы, что и обусловило актуальность настоящей работы.
Цель исследования: оценить ассоциацию саркопении и атеросклероза сонных артерий у больных мужского пола пожилого возраста с ОА коленного сустава.
Материал и методы
В одномоментное исследование включены 36 больных мужского пола в возрасте 60 лет и старше с диагнозом ОА коленного сустава II или III рентгенологической стадии по Kellgren — Lawrence в соответствии с критериями ACR (1991).
Критерии невключения: внутрисуставное введение препаратов в течение последних 6 нед., прием глюкокортикоидов более 3 мес. до исследования, перенесенные травмы и/или операции на коленном суставе, наличие у пациента состояний, отрицательно влияющих на мышечную силу и функцию конечностей.
Исследование было одобрено этическим комитетом ФГБОУ ВО КемГМУ Минздрава России. Все пациенты подписали добровольное согласие на участие в исследовании.
Согласно рекомендациям EWGSOP (2010) [4] измеряли мышечную массу, мышечную силу и функцию скелетных мышц. Мышечную функцию оценивали с использованием батареи коротких тестов, снижением мышечной функции считали итоговый результат ≤8 баллов. Мышечную силу исследовали с использованием кистевого динамометра, учитывали наилучший из двух результатов. Мышечную массу оценивали с помо f9ью мультиспиральной компьютерной томографии на 64-срезовом компьютерном томографе Somatom Sensation 64 (Siemens AG Medical Solution, ФРГ). Пресаркопению устанавливали при снижении мышечной массы, саркопению — при снижении мышечной силы в сочетании со снижением мышечной массы. Всем пациентам выполняли дуплексное сканирование на аппарате Sonos 2500 (США) с измерением толщины комплекса интима-медиа (ТИМ) и оценкой наличия атеросклеротических бляшек и степени стеноза артерии.
Для оценки структурного состояния сосудистой стенки сонных артерий использовали классификацию Российского кардиологического научно-производственного комплекса (РКНПК): 0 — без атеросклеротического поражения, 1 — единичная атеросклеротическая бляшка (АСБ) со стенозом <50%, 2 — множественные АСБ со стенозом <50%, 3 — единичная АСБ со стенозом ≥50%, 4 — множественные АСБ со стенозом ≥50% [16].
В соответствии с рекомендациями EWGSOP (2010) [4] больные ОА были разделены на 3 группы: 1-я группа (n=10) — без саркопении, 2-я группа (n=12) — с пресаркопенией, 3-я группа (n=14) — с саркопенией.
Как видно в таблице, у больных пожилого возраста с ОА коленного сустава ведущее место в структуре коморбидной патологии занимали кардиоваскулярные заболевания: артериальная гипертензия — у 21 (58,3%) человека, ишемическая болезнь сердца — у 17 (47,2%). У большинства больных в изучаемых группах стабильная стенокардия напряжения соответствовала функциональному классу (ФК) II. Хроническая сердечная недостаточность (ХСН) I стадии чаще регистрировалась в группах пациентов без саркопении и с пресаркопенией по сравнению с пациентами с саркопенией, а ХСН II стадии — у пациентов с пресаркопенией. У большинства больных в каждой из групп ХСН соответствовала ФК II.
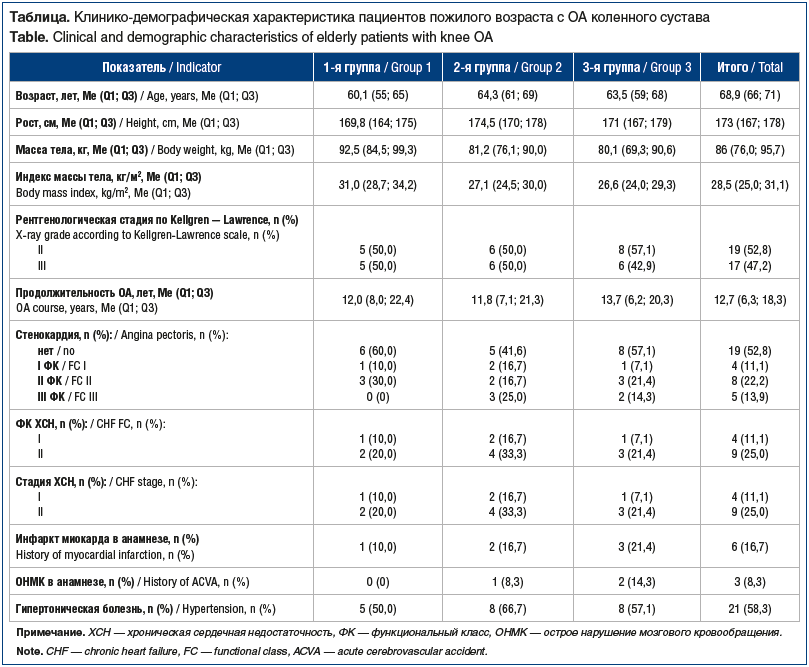
На втором месте в структуре коморбидной патологии регистрировались хроническая обструктивная болезнь легких — у 13 (36,1%) пациентов и заболевания пищеварительной си f1темы: хронический холецистит — у 11 (30,6%), хронический панкреатит — у 10 (27,8%), желчнокаменная болезнь — у 8 (22,2%). Реже выявлялись заболевания почек: хронический пиелонефрит — у 8 (22,2%), мочекаменная болезнь — у 6 (16,7%).
Статистический анализ проводили с использованием пакета прикладных программ Statistica версии 6.1.478.0 (StatSoft Inc., США). Все непараметрические показатели представлены в виде медианы и 1-го и 3-го квартилей (Me (Q1; Q3)). Качественные показатели представляли в абсолютных и относительных (%) величинах. Сравнение двух групп по количественным показателям выполняли с помощью критерия Манна — Уитни. Для сравнения номинальных переменных использовали точный критерий Фишера. Направление и тесноту корреляционной связи оценивали с помощью коэффициента корреляции Спирмена и множественной линейной регрессии. Различия считали статистически значимыми при p<0,05.
Результаты исследования
Установлено, что большинство включенных в исследование пациентов (28, 77,8%) имели величину ТИМ, превышающую рекомендованное Американским союзом эхокардиографии (2008) пороговое значение ТИМ для мужчин старше 50 лет — 0,9 мм.
По результатам изучения ТИМ в зависимости от состояния мышечного аппарата показано, что абсолютная величина ТИМ у мужчин без саркопении составила 1,2 (1,1; 1,2) мм (р<0,001), с пресаркопенией — 1,2 (1,1; 1,2) мм (р<0,001), с саркопенией — 1,2 (1,2; 1,3) мм (р<0,001). Установлено, что ТИМ в группе больных с саркопенией была выше ТИМ мужчин без саркопении (р=0,005) и ТИМ пациентов с пресаркопенией, однако в последнем случае различия не достигали уровня статистической значимости (р=0,067).
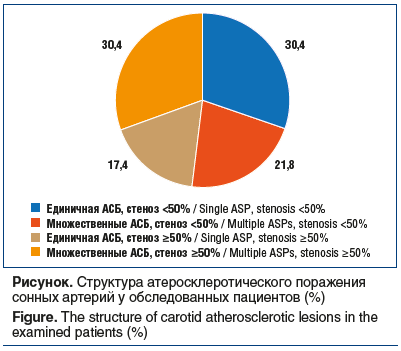
У большинства включенных в исследование больных (23, 63,9%) зарегистрировано атеросклеротическое поражение сонных артерий (см. рисунок). Около трети пациентов (13, 36,1%), включенных в исследование, не имели признаков атеросклероза сонных артерий. При изучении вариантов поражения сонных артерий (в соответствии с классификацией РКНПК) в зависимости от состояния мышечного аппарата установлено, что АСБ в сонных артериях отсутствовали в группе пациентов без саркопении — у 3 (30,0%) и определялись у больных с пресаркопенией и саркопенией — у 3 (25,0%) и 3 (21,4%) соответственно. При сравнительном анализе частоты отсутствия АСБ значимых различий между изучаемыми группами не выявлен о (р>0,05).
Единичная АСБ со стенозом <50% выявлена у 2 (20,0%), 3 (25,0%) и 2 (14,3%) пациентов в 1, 2 и 3-й группах соответственно, без значимых различий между ними (p>0,05).
Множественные АСБ со стенозом <50% зарегистрированы у 1 (10,0%) пациента без саркопении, у 3 (25,0%) — с пресаркопенией и у 1 (7,1%) — с саркопенией. Значимых различий по частоте при данном варианте поражения сонных артерий не установлено (p>0,05). Единичная АСБ со стенозом 50% и более выявлена у 2 (20,0%) пациентов без саркопении против 1 (8,3%) и 1 (7,1%) в группах больных с пресаркопенией и саркопенией, однако достоверных различий между изучаемыми группами не обнаружено (p>0,05).Поражение сонных артерий с множественными АСБ и стенозом 50% имело место у мужчин с саркопенией по сравнению с группой больных с пресаркопенЦ 8ей (35,7% против 8,3%, р=0,015) и без саркопении (35,7% против 10,0%, р=0,013). Группы пациентов без саркопении и с пресаркопенией по частоте данного варианта поражения сонных артерий были сопоставимы.Несмотря на наличие АСБ в сонных артериях пациентов всех 3 групп, необходимо отметить, что наиболее тяжелые формы атеросклеротического поражения сонных артерий (множественные АСБ, стенозы 50% и более) чаще регистрировались у мужчин с саркопенией. По результатам корреляционного анализа установлена достоверная отрицательная взаимосвязь между ТИМ и общей площадью скелетной мускулатуры на уровне LIII(r=-0,311, р=0,005), ТИМ и скелетно-мышечным индексом (r=-0,282, p=0,012). Аналогичная корреляционная зависимость определена между ТИМ и показателями кистевой динамометрии правой и левой руки (r=-0,297, р=0,008 и r=-0,245, р=0,029). Значимых взаимосвязей между ТИМ и показателями мышечной функции не выявлено (p>0,05).Для оценки влияния параметров состояния мышечного оппарата на ТИМ была выполнена множественная регрессия с пошаговым включением предикторов, где ТИМ была основной исследуемой переменной, а параметры мышечной массы, силы и функции — влияющими переменными. По результатам линейного регрессионного анализа была получена модель без достоверности β-параметров (tрасч.
Обсуждение
Несмотря на «молодость» проблемы вторичной саркопении, результаты ряда исследований свидетельствуют о повышенном риске развития инфаркта миокарда, фибрилляции предсердий и кальцификации аорты и коронарных артерий у лиц с саркопенией [8, 10]. На сегодняшний день имеется д eeстаточное количество исследований, подтверждающих более тяжелое течение атеросклеротического процесса у лиц с саркопенией не только в сонных [6, 8, 17, 18], но и в коронарных и периферических артериях [19, 20].
Так, по данным Датского регистра больных с ангиографически верифицированным коронарным атеросклерозом, за 11 лет наблюдения погибли 15,6% пациентов, при этом в группе с дефицитом массы тела отмечалось двукратное увеличение риска летального исхода [21]. Полученные авторами данные подтверждают имеющееся мнение о том, что показатель индекса массы тела с возрастом в большей степени являются маркером не ожирения, а белковых резервов организма и имеет непосредственное влияние на состояние мышечной массы. В обзоре и метаанализе 11 клинических исследований Y. Zhang et al. [22], опубликованном в 2021 г., установлена широкая распространенность саркопении среди лиц, страдающих сердечной недостаточностью. Так, общая частота выявления данного феномена варьировала в диапазоне от 10% до 69%, встречаясь при этом более чем у половины пациентов на стационарном этапе лечения (55%, 95% доверительный интервал (ДИ) 43–66%) и у четверти — на амбулаторном этапе (26%, 95% ДИ 16–37%).
В настоящей работе установлено, что величина ТИМ у больных с саркопенией значимо превышала аналогичный показатель у пациентов без саркопении, что согласуется с данными J.E. Heo et al. [17], которые при обследовании 595 мужчин и 1274 женщин в возрасте 30–64 лет установили, что ТИМ сонных артерий значимо увеличивалась по мере снижения индекса аппендикулярной тощей массы. Аналогичная закономерность получена в исследованиях M. Arnold et al. [6] и Y. Cao et al. [8], продемонстрировавших достоверную ассоциацию снижения мышечной массы с увеличением ТИМ, и M. Ochi et al. [18], установивших значимую ассоциацию повышенной жесткости артериальной стенки с мышечной массой нижних конечностей.
Наличие АСБ в сонных артериях во всех группах было сопоставимо, что весьма закономерно, поскольку основной причиной возникновения стенозов является именно на ebичие АСБ у всех больных независимо от состояния мышечного аппарата, однако наиболее тяжелые формы атеросклероза сонных артерий регистрировались у больных с саркопенией. Данные результаты согласуются с результатами работ M. Arnold et al. [6], где также не выявлено значимых ассоциаций между наличием АСБ и изменением параметров мышечной массы, и J.E. Heo et al. [17], установивших, что частота встречаемости АСБ в сонных артериях была сопоставима у пациентов как с низкой, так и с нормальной мышечной массой.
Отдельный интерес представляет выявленная инверсивная взаимосвязь между величиной ТИМ и показателями мышечной силы. К настоящему моменту имеются сведения о способности мышечной массы выступать в роли наиболее раннего предиктора атеросклеротического поражения корон арного русла. В исследовании X. Melo et al. [23] при обследовании 191 девочки в возрасте 11–12 лет установлено, что дети с низкой мышечной силой имели достоверно наиболее высокие показатели ТИМ и артериального давления, что свидетельствует о взаимосвязи мышечной силы с кардиоваскулярным риском уже в детском возрасте. Анологичная закономерность в популяции мужчин пожилого возраста продемонстрирована в проспективном исследовании M.E. den Ouden et al. [24]. Авторами установлено, что исходно низкая мышечная сила верхних конечностей была ассоциирована с достоверным увеличением ТИМ по истечении 4-летнего периода наблюдения. Сходные данные в мужской когорте пациентов получили H. Yamanashi et al. [11].
Заключение
Таким образом, взаимосвязь атеросклероза сонных артерий и нарушения композиционного состава тела у мужчин с ОА коленного сустава позволяет рассматривать атеросклероз и саркопению как два состояния, имеющих общие патогенетические механизмы и потенциально усилива ющих риск возникновения неблагоприятных исходов. Одним из направлений последующих исследований может стать изучение этой взаимосвязи при различных клинических вариантах ОА.
Сведения об авторах:
Алексеева Людмила Ивановна — д.м.н., начальник отдела метаболических заболеваний костей и суставов ФГБНУ НИИР им. В.А. Насоновой; 115522, Россия, г. Москва, Каширское ш., д. 34А; профессор кафедры ревматологии ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1.
Таскина Елена Александровна — к.м.н., старший научный сотрудник отдела метаболических заболеваний костей и суставов ФГБНУ НИИР им. В.А. Насоновой; 115522, Россия, г. Москва, Каширское ш., д. 34А; ORCID iD 0000-0001-8218-3223.
Раскина Татьяна Алексеевна — д.м.н., профессор, заведующая кафедрой пропедевтики внутренних болезней ФГБОУ ВО КемГМУ Минздрава России; 650056, Россия, г. Кемерово, ул. Ворошилова, д. 22А.
Летаева Марина Васильевна — к.м.н., доцент кафедры пропедевтики внутренних болезней ФГБОУ ВО КемГМУ Минздрава России; 650056, Россия, г. Кемерово, ул. Ворошилова, д. 22А; ORCID iD 0000-0003-3907-7120.
Малышенко Ольга Степановна — к.м.н., доцент кафедры пропедевтики внутренних болезней ФГБОУ ВО КемГМУ Минздрава России; 650056, Россия, г. Кемерово, ул. Ворошилова, д. 22А; ORCID iD 0000-0001-8272-3736.
Королева Марина Валерьевна — к.м.н., ассистент кафедры пропедевтики внутренних болезней ФГБОУ ВО КемГМУ Минздрава России; 650056, Россия, г. Кемерово, ул. Ворошилова, д. 22А; ORCID iD 0000-0002-0184-7997.
Аверкиева Юлия Валерьевна — к.м.н., ассистент кафедры пропедевтики внутренних болезней ФГБОУ ВО КемГМУ Минздрава России; 650056, Россия, г. Кемерово, ул. Ворошилова, д. 22А; ORCID iD 0000-0001-8020-4545.
Григорьева Инесса Игоревна — врач-ревматолог ГАУЗ «КГКБ № 4»; 650024, Россия, г. Кемерово, ул. Базовая, д. 12А.
Контактная информация: Летаева Марина Васильевна, e-mail: letaeva@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.03.2022.
Поступила после рецензирования 29.03.2022.
Принята в печать 21.04.2022.
About the authors:
Lyudmila I. Alekseeva — Dr. Sc. (Med.), Head of the Department of Metabolic Bone and Joint Diseases, Research Institute of Rheumatology named after V.A. Nasonova; 34A, Kashirskoye road, Moscow, 115522, Russian Federation; Professor of the Department of Rheumatology, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation.
Elena A. Taskina — C. Sc. (Med.), Senior Researcher of the Department of Metabolic Bone and Joint Diseases, Research Institute of Rheumatology named after V.A. Nasonova; 34A, Kashirskoye road, Moscow, 115522, Russian Federation; ORCID iD 0000-0001-8218-3223.
Tatiana A. Raskina — Dr. Sc. (Med.), Professor, Head of the Department of Propaedeutics of Internal Diseases, Kemerovo State Medical University; 22A, Voroshilova str., Kemerovo, 650056, Russian Federation.
Marina V. Letaeva — C. Sc. (Med.), Associate Professor of the Department of Propaedeutics of Internal Diseases, Kemerovo State Medical University; 22A, Voroshilova str., Kemerovo, 650056, Russian Federation; ORCID iD 0000-0003-3907-7120.
Olga S. Malyshenko — C. Sc. (Med.), Associate Professor of the Department of Propaedeutics of Internal Diseases, Kemerovo State Medical University; 22A, Voroshilova str., Kemerovo, 650056, Russian Federation; ORCID iD 0000-0001-8272-3736.
Marina V. Koroleva — C. Sc. (Med.), Assistant of the Department of Propaedeutics of Internal Diseases, Kemerovo State Medical University; 22A, Voroshilova str., Kemerovo, 650056, Russian Federation; ORCID iD 0000-0002-0184-7997.
Yulia V. Averkieva — C. Sc. (Med.), Assistant of the Department of Propaedeutics of Internal Diseases, Kemerovo State Medical University; 22A, Voroshilova str., Kemerovo, 650056, Russian Federation; ORCID iD 0000-0001-8020-4545.
Inessa I. Grigorieva — rheumatologist, Kemerovo City Clinical Hospital No. 4; 12A, Bazovaya str., Kemerovo, 650024, Russian Federation.
Contact information: Marina V. Letaeva, e-mail: letaeva@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 02.03.2022.
Revised 29.03.2022.
Accepted 21.04.2022.
.
Информация с rmj.ru






