Содержание статьи
Ассоциация полиморфизма гена ICAM-1 с прогрессирующим
течением хронического гепатита С
К. Р. Дудина*, доктор медицинских наук
К. А. Царук**
С. А. Шутько*, кандидат медицинских наук
О. О. Знойко*, доктор медицинских наук
Д. Д. Абрамов***, кандидат биологических наук
Н. О. Бокова*, кандидат медицинских наук
К. С. Скрупский*
Н. Д. Ющук*, доктор медицинских наук, профессор, академик РАМН
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
**ГКУЗ ИКБ № 1 ДЗМ, Москва
***ФГБУ ГНЦ Институт иммунологии ФМБА России, Москва
Несмотря на большое количество исследований, посвященных оценке генетически
детерминированных рисков развития фиброза и цирроза печени (ЦП) у больных
хроническим гепатитом С (ХГС), до настоящего времени не выявлено определенной
взаимосвязи между конкретными генетическими маркерами неблагоприятного исхода
данного заболевания. Поскольку фиброз печени наиболее быстрыми темпами
прогрессирует у пациентов с выраженным воспалением в печени, проявляющимся
высоким индексом гистологической активности, особый интерес вызывают
генетические детерминанты, предопределяющие ход иммунологических реакций.
Как известно, в патогенезе развития воспаления при хронических вирусных
гепатитах ключевую роль играют клеточные иммунные реакции. При инфицировании
вирусом гепатита В (HBV) и вирусом гепатита С (HCV) регистрируется повышенная
экспрессия на гепатоцитах детерминант МНС 1-го класса, необходимых для
адекватного представления антигенов, а также — межклеточных адгезивных молекул,
которые играют важную роль в активации Т-клеток и их миграции в ткани-мишени
[1].
В инициации иммунологических реакций важную роль играет система межклеточной
адгезии ICAM-1 (CD54)/LFA-1 (CD11a/CD18). ICAM-1 (intercellular adhesion
molecule-1, молекула межклеточной адгезии 1-го типа, принадлежащая к
суперсемейству иммуноглобулинов) инициирует движение иммунорегуляторных клеток и
взаимодействие иммунокомпетентных клеток между собой [2, 3]. Лигандами для
ICAM-1 являются лейкоцитарный интегрин LFA-1 (Lymphocyte Function-Associated
Antigen-1), опосредующий адгезию между клетками и клеткой к экстрацеллюлярному
матриксу, и Мас-1, опосредующий адгезию гранулоцитов [4, 5]. Сигналом для
активации адгезивных молекул, в частности, ICAM-1/LFA-1, является распознавание
детерминант МНС на поверхности антиген-презентирующих клеток наивными
Т-клетками. В последующем эффекторные Т-клетки (Т-хелперы и цитотоксические
лимфоциты) мигрируют в очаг воспаления и взаимодействуют с клетками-мишенями
[3].
Экспрессия ICAM-1 постоянна и регистрируется на различных клетках (лимфоциты,
моноциты, эозинофилы, тканевые макрофаги, фибробласты, эндотелий, тимусный
эпителий, скелетные миоциты и др.). При возникновении воспалительного процесса в
ответ на действие цитокинов (ИЛ-1, ИФН-γ) их экспрессия становится избыточной в
клетках-мишенях [2, 6, 7]. Изменения уровня экспрессии молекулы ICAM-1 на
мембране клеток наблюдаются при активации иммунной системы при воспалительных
процессах. Экспрессия ICAM-1 повышается при различных патологических процессах.
Так, в 2014 г. показана связь полиморфизмов rs5491, rs281432, и rs281437 гена
ICAM-1 с развитием атеросклероза коронарных сосудов, а также с повышенными
уровнями триглицеридов, аполипопротеина A и В в китайской популяции больных [8].
Выявлена связь полиморфизмов rs5491 (K56M) и rs5498 (K469E) гена ICAM-1 с
развитием у детей астмы и повышенной экспрессией белка ICAM-1 [9, 10]. В
различных этнических группах выявлена связь полиморфизмов rs5498 (К469E) и
rs1799969 (R241G) гена ICAM-1 с болезнью Бехчета [11]. В 2013 году был показан
значимый вклад SNP R241 G в сочетании с SNP K469E гена ICAM-1 в развитие
первичных опухолей головного мозга у населения Турции [12]. Кроме того, показана
ассоциация полиморфизмов гена ICAM-1 с тяжестью течения малярии [13] и афтозного
стоматита [14].
В доступной научной литературе имеются единичные исследования, касающиеся
ассоциативных связей полиморфного гена ICAM-1 с течением хронических вирусных
гепатитов. Так, при хронической HBV-инфекции показано, что полиморфизмы rs5498
(К469E) и rs1799969 (R241G) гена ICAM-1 ассоциировались с восприимчивостью к HBV
и формированию ЦП в исходе хронического гепатита В [15]. Ранее было показано,
что при ХГС значительно увеличиваются сывороточные концентрации и экспрессия
ICAM-1 на гепатоцитах [16, 17].
В 2013 г. опубликована работа, показавшая ассоциацию rs281437 гена ICAM-1 с
тяжелым фиброзом печени у больных ХГС, инфицированных 4-м генотипом HCV, в то же
время не было выявлено связи полиморфизмов rs5498 и rs12979860 данного гена со
степенью выраженности фиброза печени. Показано, что у пациентов с Т-аллелью
rs281437 риск развития тяжелого фиброза приблизительно в 13 раз выше по
сравнению с пациентами с C-аллелью (OR = 13,0; CI: 1,32–128,11, P = 0,028) [18].
Учитывая актуальность поиска генетических предикторов неблагоприятного
течения заболевания, наличие патогенетической взаимосвязи хронического вирусного
гепатита С с особенностями экспрессии ICAM-1, целью настоящего исследования была
оценка роли полиморфизма rs281437 гена ICAM-1 в развитии прогрессирующего
течения ХГС у представителей московской популяции (европеоидной расы).
Материалы и методы исследования
В исследование, проведенное методом «случай-контроль», включены 297 больных
ХГС с различными стадиями фиброза печени (F0-F3) и сроком наблюдения пациентов
от 1 года и выше. Средний возраст больных — 38 ± 1 год, мужчины/женщины = 175
(59%)/122 (41%). Для последующего анализа из группы больных ХГС были выделены
пациенты с известной стадией фиброза печени:
- 93 взрослых больных ХГС со стадиями фиброза печени F0-F1 (мужчины/женщины
— 56/37, средний возраст — 37 ± 1 год); - 124 взрослых больных ХГС со стадиями фиброза печени F2-F3 (мужчины/женщины
— 81/45, средний возраст — 39 ± 1 год).
Кроме того, в исследование включены 11 спонтанных реконвалесцентов HCV
(мужчины/женщины — 7/4, средний возраст — 41 ± 6 лет) и 271 больной ЦП различной
этиологии: 146 больных ЦП HCV-этиологии (ЦП HCV, мужчины/женщины — 90/56,
средний возраст — 51 ± 1 год); 55 больных ЦП HBV-этиологии (ЦП HBV,
мужчины/женщины — 38/17, средний возраст — 51 ± 2 года); 36 больных алкогольным
ЦП (ЦП А, мужчины/женщины — 32/4, средний возраст — 48 ± 2 года); 34 больных
криптогенным ЦП (ЦП кр, мужчины/женщины — 22/12, средний возраст — 52 ± 2 года).
В группу больных ЦП HBV-этиологии включены пациенты с моноинфекцией HBV и 24
(44%) пациента с ЦП смешанной этиологии (HBV + HCV, HBV + HDV, HBV + HCV + HDV).
Для проведения популяционно-генетического анализа в группу контроля включено 202
здоровых донора (мужчины/женщины — 109/93, средний возраст — 56 ± 2 года).
Критериями невключения в исследование были наличие ВИЧ-инфекции, психических
заболеваний и тяжелой соматической патологии. Проведение генетического анализа
пациентам выполнялось после подписания информированного согласия.
Всем пациентам проведено определение серологических маркеров вирусных
гепатитов методом иммуноферментного анализа (ИФА) и генетического материала HCV
методом полимеразной цепной реакции (ПЦР). Стадии фиброза печени определялись с
применением пункционной биопсии печени и/или транзиентной фиброэластометрии.
Биоматериалом для выделения дезоксирибонуклеиновой кислоты (ДНК) человека была
кровь, которую собирали в вакуумные пробирки, содержащие
этилендиаминтетрауксусную кислоту (ЭДТА). Выделение ДНК из образцов
периферической крови проводили с использованием комплекта реагентов «ПРОБА-ГС-ГЕНЕТИКА»
(ЗАО «НПФ ДНК-Технология»), согласно инструкции к комплекту. Генотипирование
образцов ДНК человека проведено с помощью модифицированного метода «примыкающих
проб». Для определения однонуклеотидных замен rs281437 гена ICAM-1 использовали
метод «примыкающих проб» (adjacent probes, kissing probes).
Набор биоматериала от пациентов проводился в период с 2006 по 2014 гг. в ГКУЗ
ИКБ № 1 ДЗМ г. Москвы, Главном клиническом госпитале МВД России, ГКБ № 20 ДЗ г.
Москвы, ЦКБ № 1 ОАО «РЖД».
Статистический анализ включал в себя сравнение частот аллелей и генотипов
между различными группами с использованием критерия χ2 Пирсона и
оценку OШ с расчетом для него 95%-го ДИ.
Результаты исследования
Впервые проведен анализ распространения аллелей и генотипов rs281437 гена
ICAM-1 в московской популяции больных с хронической HCV-инфекцией (F0-F4). На
первом этапе проанализирована частота встречаемости носительства аллелей и
генотипов rs281437 гена ICAM-1 у больных ХГС с различными стадиями фиброза
печени с учетом (F0-F4) и без учета больных (F0-F3) с формированием ЦП в
сопоставлении с группой контроля (рис. 1).
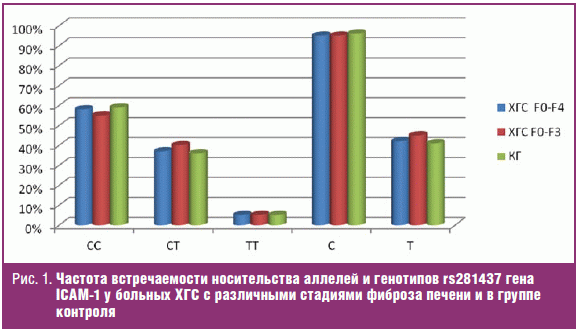
Как показано на рисунке, в московской популяции больных ХГС и здоровых
доноров встречаются, преимущественно, носители аллели С и генотипов СС/СТ
исследуемого полиморфизма. Сравнительный анализ не выявил достоверных различий в
частоте встречаемости аллелей и генотипов rs281437 гена ICAM-1 у больных ХГС
F0-F3 и ХГС F0-F4 при сопоставлении с группой контроля здоровых лиц (p > 0,05).
Следующим этапом исследования был анализ частоты встречаемости носительства
аллелей и генотипов rs281437 гена ICAM-1 у больных ЦП различной этиологии в
сопоставлении с группой контроля (рис. 2).
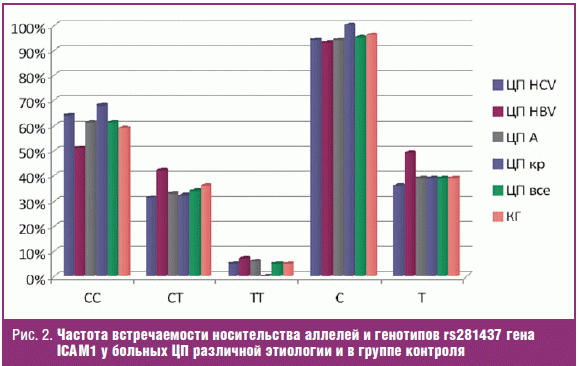
Как и в группах больных ХГС с различными стадиями фиброза печени, контрольной
группе, так и в группах больных ЦП вне зависимости от этиологии заболевания
более 90% пациентов являются носителями аллели С rs281437 гена ICAM-1 и,
соответственно, носителями генотипов СС/СТ rs281437 гена ICAM-1. Проведенный
анализ не выявил различий в частоте встречаемости аллелей и генотипов rs281437
гена ICAM-1 между больными ЦП различной этиологии и группой контроля (как в
целом между группой с ЦП и группой контроля, так и в сравнении с группами с
различной этиологией заболевания).
В настоящее время известны неблагоприятные факторы прогрессирующего течения
ХГС, а именно длительность инфицирования, мужской пол, наличие стеатоза печени,
злоупотребление алкоголем. Учитывая отсутствие достоверных различий в
распределении аллелей и генотипов исследуемого полиморфизма среди больных ХГС и
ЦП различной этиологии при сравнении с группой контроля, в дальнейшем анализ был
проведен в группах больных с хронической HCV-инфекцией, разделенных с учетом
наличия или отсутствия неблагоприятного фактора, а также — в группах больных с
различными исходами заболевания (спонтанные реконвалесценты и больные ЦП в
исходе ХГС), а также с минимальным и выраженным фиброзом печени (табл. 1 и 2).

При сравнении частоты носителей аллелей и генотипов rs281437 гена ICAM-1 у
спонтанных реконвалесцентов HCV достоверно чаще регистрировалась аллель Т и
гетерозиготный генотип СТ по сравнению с больными ЦП в исходе ХГС (табл. 1).
Напротив, у больных ЦП HCV-этиологии значимо чаще регистрируется генотип СС
исследуемого полиморфизма гена ICAM-1. Генотип ТТ выявлялся только у больных ЦП
в исходе ХГС. В то же время гомозиготы ТТ rs281437 гена ICAM-1 значимо чаще
выявлены в группе больных ХГС с минимальным фиброзом (F0-F1) по сравнению с
группой больных с фиброзом печени ≥ 2 по шкале METAVIR. Учитывая полученные
результаты, в группе больных ХГС F0-F1 были выделены пациенты с давностью
наблюдения более 10 лет (n = 20) и проведено сравнение частоты встречаемости
носителей аллелей и генотипов rs281437 гена ICAM-1 в этой подгруппе с группой
больных ЦП HCV-этиологии: генотип СС — 93 (64%) и 13 (65%), генотип СТ — 45
(31%) и 6 (30%), генотип ТТ — 8 (5%) и 1 (5%), аллель С — 138 (94%) и 19 (95%),
аллель Т — 53 (36%) и 7 (35%) соответственно, р > 0,05, что демонстрирует
отсутствие достоверных различий.
В исследуемых группах больных как с ХГС, так и с ЦП различной этиологии
достоверно чаще регистрировался мужской пол больных (p < 0,05), который является
фактором прогрессирующего течения ХГС. При разделении группы больных ХГС с
исходом в ЦП в зависимости от пола, были получены данные, что у лиц женского
пола по сравнению с мужчинами была выше частота встречаемости Т-аллели и
достоверно ниже генотипа СС rs281437 гена ICAM-1 (табл. 2).
При выделении пациентов со стеатозом печени в группе больных ХГС F0-F3
достоверно чаще выявлялась Т-аллель rs281437 гена ICAM1 по сравнению с
контрольной группой. Кроме того, гетерозиготы достоверно чаще выявлялись в
группе больных ХГС со стеатозом печени, а гомозиготы СС — в группе спонтанных
реконвалесцентов HCV (табл. 2). Группа больных ХГС со стеатозом печени
представлена преимущественно лицами мужского пола (61%, 14/23). Таким образом,
носительство аллеля Т rs281437 гена ICAM-1 можно считать аллелем риска развития
стеатоза печени при хронической HCV-инфекции (табл. 2). В то же время гомозиготы
СС данного полиморфизма имеют более высокие шансы спонтанной реконвалесценции.
Сопоставление частот встречаемости носительства аллелей и генотипов rs281437
гена ICAM-1 у больных ЦП в исходе ХГС, злоупотребляющих и не злоупотребляющих
алкоголем, а также инфицированных различными генотипами HCV, представлено на
рис. 3.
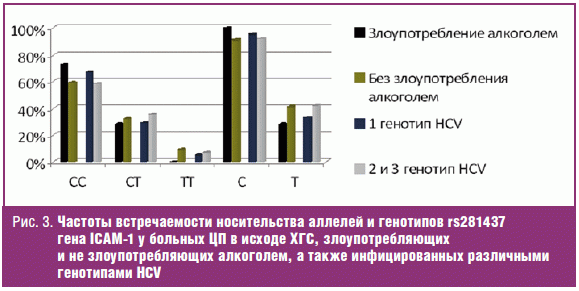
Сравнительный анализ не выявил достоверных различий в частоте встречаемости
аллелей и генотипов rs281437 гена ICAM-1 в группах больных ХГС, инфицированных
генотипом 1 HCV и инфицированных 2-м и 3-м генотипами HCV, а также
злоупотребляющих и не злоупотребляющих алкоголем (p > 0,05).
Противоречие с исследованием N. M. Rizk, 2013 г., которое показало значимость
аллели Т rs281437 гена ICAM-1 у больных ХГС, инфицированных 4-м генотипом, с
тяжестью фиброза печени, возможно, обусловлено проведением нашего исследования
на популяции больных, инфицированных 1-м, 2-м и 3-м генотипами HCV.
Заключение
Исследование продемонстрировало, что в московской популяции преобладают
носители аллели С и генотипов СТ/ТТ rs281437 гена ICAM-1. Аллель Т исследуемого
полиморфизма достоверно ассоциировался только со стеатозом печени у больных ХГС
и с женским полом больных ЦП HCV-этиологии. Полученные результаты требуют
дальнейшего уточнения клинической роли выявленных различий, поскольку стеатоз
печени является независимым фактором прогрессии как воспаления, так и фиброза
печени при ХГС. Кроме того, отдельно необходимо в дальнейшем детально оценить
влияние аллели Т rs281437 гена ICAM-1 на формирование ЦП у больных ХГС женского
пола.
Работа выполнена в рамках гранта Президента
Российской Федерации для поддержки молодых российских ученых — докторов наук (конкурс
— МД-2013).
Литература
-
Monzón G. C., Buey G. L., Sánchez G. A. et al. Tissue expression
of antigenic recognition and intercellular adhesion molecules in chronic viral
hepatitis // Rev Esp Enferm Dig. 1993, Nov; 84 (5): 301–309. -
Blaheta R. A., Scholz M., Hailer N. P. et al. Adhesion and
penetration properties of human lymphocytes acting on allogeneic vascular
endothelial cells // Immunology. 1994: 81: 538–545. -
Мешкова Р. Я. Руководство по иммунопрофилактике для врачей.
Учебное пособие. Смоленск: ГМА, 1998. 133 с. ISBN 5–87349–042–2. -
Gorina R., Lyck R., Vestweber D., Engelhardt B. β2
integrin-mediated crawling on endothelial ICAM-1 and ICAM-2 is a prerequisite
for transcellular neutrophil diapedesis across the inflamed blood-brain
barrier // J Immunol. 2014 Jan 1; 192 (1): 324–37. doi:
10.4049/jimmunol.1300858. -
Wang D., Zeng Q., Song R. et al. Ligation of ICAM-1 on human
aortic valve interstitial cells induces the osteogenic response: A critical
role of the Notch1-NF-κB pathway in BMP-2 expression // Biochim Biophys Acta.
2014, Nov; 1843 (11): 2744–2753. doi: 10.1016/j.bbamcr.2014.07.017. -
Dustin M. L., Rothlein R., Bhan A. K. et al. Induction by IL 1
and interferon-gamma: tissue distribution, biochemistry, and function of a
natural adherence molecule (ICAM-1) // J Immunol. 1986, Jul 1; 137 (1):
245–254. -
Goh Q., Dearth C. L., Corbett J. T. et al. Intercellular adhesion
molecule-1 expression by skeletal muscle cells augments myogenesis // Exp Cell
Res. 2014, Sep 30. pii: S0014–4827 (14)00437–6. doi:
10.1016/j.yexcr.2014.09.032. -
Yang M., Fu Z., Zhang Q. et al. Association between the
Polymorphisms in Intercellular Adhesion Molecule-1 and the Risk of Coronary
Atherosclerosis: A Case-Controlled Study // PLoS One. 2014, Oct 13; 9 (10):
e109658. doi: 10.1371/journal.pone.0109658. -
Puthothu B., Krueger M., Bernhardt M., Heinzmann A. ICAM1
amino-acid variant K469 E is associated with paediatric bronchial asthma and
elevated sICAM1 levels // Genes Immun. 2006, Jun; 7 (4): 322–326. -
Li Y. F., Lin C. C., Tai C. K. Interaction of intercellular
adhesion molecule 1 (ICAM1) polymorphisms and environmental tobacco smoke on
childhood asthma // Int J Environ Res Public Health. 2014, Jun; 11 (6):
6504–6516. -
Zou J., Guan J. L. Intercellular adhesion molecule-1
polymorphisms in patients with Behçet disease: a meta-analysis // Mod
Rheumatol. 2014, May; 24 (3): 481–486. doi: 10.3109/14397595.2014.887988. -
Yilmaz U., Zeybek U., Kahraman O. T. et al. Investigation of
ICAM-1 and β3 integrin gene variations in patients with brain tumors // Asian
Pac J Cancer Prev. 2013; 14 (10): 5929–5934. -
Dunstan S. J., Rockett K. A., Quyen N. T. et al. Variation in
human genes encoding adhesion and proinflammatory molecules are associated
with severe malaria in the Vietnamese // Genes Immun. 2012, Sep; 13 (6):
503–508. doi: 10.1038/gene.2012.25. -
Alkhateeb A., Karasneh J., Abbadi H. et al. Association of cell
adhesion molecule gene polymorphisms with recurrent aphthous stomatitis // J
Oral Pathol Med. 2013 Nov; 42 (10): 741–746. doi: 10.1111/jop.12100. -
Zhang X. Q., Hong X. J., Bai X. J. Susceptibility to active
decompensated cirrhosis is associated with polymorphisms of intercellular
adhesion molecule-1 (ICAM-1) in chronic HBV carriers // Viral Hepat. 2008, Mar;
15 (3): 173–178. doi: 10.1111/j.1365–2893.2007.00931.x. -
Warakomska I., Wiczkowski A., Kepa L. et al. Serum intercellular
adhesion molecule ICAM-1 concentration in interferon alpha treated patients
with chronic viral C hepatitis // Wiad Lek. 2004; 57 (11–12): 641–646. -
Fukuda Y., Nakano I., Katano Y. et al. Serum levels of soluble
intercellular adhesion molecule-1 and soluble vascular cell adhesion
molecule-1 in asymptomatic carriers of hepatitis C virus // J Int Med Res.
1998, Dec; 26 (6): 313–318. -
Rizk N. M., Derbala M. F. Genetic polymorphisms of ICAM 1 and
IL28 as predictors of liver fibrosis severity and viral clearance in hepatitis
C genotype 4 // Clin Res Hepatol Gastroenterol. 2013, Jun; 37 (3): 262–268.
doi: 10.1016/j.clinre.2012.09.012.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru