Введение
В 2020 г. здравоохранение столкнулось с проблемой новой коронавирусной инфекции COVID-19, вызванной коронавирусом SARS-COV-2. У пациентов с COVID-19 были обнаружены и другие сопутствующие респираторные инфекции [1, 2]. Согласно данным Управления Роспотребнадзора по г. Москве («Динамика инфекционной и паразитарной заболеваемости населения Москвы за январь — июнь 2020 года», документ № 02–03/01–00369–02 от 08.07.2020) наблюдается рост заболеваемости вирусными пневмониями в 1400 раз: в 2020 г. зарегистрировано 91 455 случаев, тогда как за такой же период в 2019 г. — лишь 65 случаев. Одновременно за этот же период увеличилось количество микоплазменных пневмоний (951 случай в 2020 г. против 210 случаев в 2019 г.) и хламидийных пневмоний (294 случая в 2020 г. против 48 случаев в 2019 г.).
В период подъема заболеваемости гриппом и новой коронавирусной инфекцией COVID-19 остро встал вопрос о выборе антибактериальных препаратов. Одной из рассматриваемых групп антибиотиков стали макролиды.
Содержание статьи
- 1 Характеристика антибиотиков группы макролидов
- 2 Кларитромицин: фармакология, клиническая эффективность и безопасность
- 3 Применение кларитромицина при заболеваниях, обусловленных хламидиями и микоплазмами
- 4 Кларитромицин и азитромицин: в чем отличия?
- 5 Проблема резистентности M. pneumoniae к макролидам
- 6 Безопасность применения кларитромицина
- 7 Заключение
Характеристика антибиотиков группы макролидов
Важная веха в изучении макролидов начиная с 1980-х гг. была связана с диагностикой внутриклеточных возбудителей и активным выбором антибиотиков этой группы как основных препаратов в борьбе с внутриклеточными инфекциями. Высокую чувствительность к макролидам проявляют стрептококки, пневмококки, стафилококки, гонококки, хламидии, микоплазмы, легионеллы. Умеренной активностью обладают макролиды в отношении Helicobacter pylori, боррелий, некоторых видов микобактерий, токсоплазм, анаэробов, Haemophilus influenzae. Устойчивы к макролидам метициллин-резистентные штаммы стафилококков, Enterococcus faecium, грамотрицательные микроорганизмы семейства Enterobacteriaceae, Pseudomonas aeruginosa, Acinetobacter, Mycobacteria tuberculosis. Активность макролидов связана с наличием макроциклического лактонного кольца, к которому присоединены один или несколько дезоксисахаров, обычно кладиноза и дезозамин. Химическая классификация предполагает разделение макролидов на 3 группы в зависимости от числа атомов углерода в лактонном кольце — 14-, 15- и 16-членные, причем 15-членные правильнее называть азалидами, так как в кольцо азитромицина включен атом азота (рис. 1).
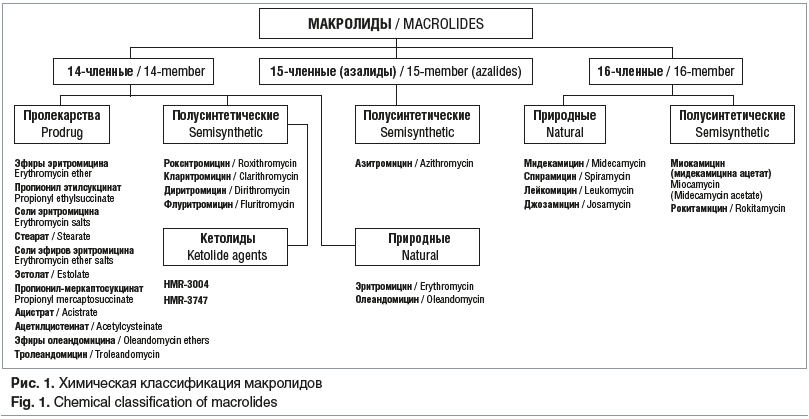
Макролиды обладают хорошей антимикробной активностью и способностью проникать в ткани, что обусловливает особенности их назначения. Макролиды обладают бактериостатическим действием. Однако в высоких концентрациях, превышающих минимальную подавляющую концентрацию (МПК) в 2–4 раза, макролиды могут оказывать бактерицидное действие, особенно в стадии роста микроорганизма. В случае сочетанных вирусных и бактериальных инфекций на практике макролиды комбинируют с противовирусными препаратами и другими антибиотиками. При некоторых хронических заболеваниях, обусловленных синегнойными возбудителями, добавление макролида одновременно с антипсевдомонадными антибиотиками может быть более эффективным, чем использование одного антибиотика [3].
Механизм действия макролидов состоит в связывании 50S-субъединицей рибосом бактериальной клетки, в результате чего нарушаются процессы транслокации/транспептидации, преждевременно отщепляется растущая тРНК-полипептидная цепочка, и таким образом прекращается сборка белковой молекулы [4].
Помимо типичного антибактериального эффекта макролиды обладают противовоспалительным и иммуномодулирующим действием.
Противовоспалительные и иммуномодулирующие свойства макролидов
В 2012 г. J.-Y. Min et al. провели поиск публикаций в базе данных PubMed, используя комбинации ключевых слов, включающие «макролиды» и «инфекция дыхательных путей» [5]. Авторы установили, что, по данным доклинических исследований in vitro и in vivo и клинических исследований, макролиды могут быть эффективны при различных респираторных вирусных инфекциях, в т. ч. обусловленных респираторно-синтициальным вирусом (РСВ), риновирусом, аденовирусом, метапневмовирусом, вирусами гриппа и парагриппа. Макролиды подавляют пролонгированную воспалительную реакцию, уменьшают секрецию слизи в дыхательных путях, ингибируют бактериальную адгезию и формирование биопленок [6–8]. Вирусы являются мощными индукторами цитокинов и хемокинов, таких как фактор некроза опухолей-α (tumor necrosis factor α, TNF-α), интерфероны (interferon, IFN) IFN-α, IFN-β, IFN-γ, интерлейкины (interleukin, IL) IL-6, IL-1, IL-8, макрофагальный воспалительный белок-1, монокин, индуцируемый IFN-γ, интерферон-γ-индуцируемый белок-10, моноцитарный хемоаттрактантный белок-1, хемокин, экспрессируемый и секретируемый T-клетками при их активации [5, 9–11].
Известно, что тяжесть течения вирусных инфекций связана с интенсивностью высвобождения провоспалительных цитокинов и развитием клинических синдромов, в т. ч. фатальных, таких как острый респираторный дистресс-синдром, сопровождающийся кровоизлияниями в альвеолярную ткань, реактивным гемофагоцитозом и отеком легких. Макролиды, ослабляя избыточную продукцию цитокинов, изменяют весь каскад воспалительной реакции. Кроме того, они могут влиять на активность фагоцитов, изменяя их функцию (хемотаксис, фагоцитоз), уничтожая бактерии и вирусы. Ранее сообщалось, что макролиды, в частности кларитромицин, могут вмешиваться в цикл репликации вируса гриппа, ингибируя его размножение путем внутриклеточного протеолиза гемагглютинина [12, 13].
На сегодняшний день кларитромицин и азитромицин — два антибиотика, которые были предложены не только в России, но и в разных странах мира для лечения пневмонии, обусловленной SARS-CoV-2. В России во время эпидемии COVID-19 на основании результатов лечения больных было опубликовано семь версий «Временных методических рекомендаций: Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» у взрослых и две версии у детей, вторая: «Методические рекомендации: Особенности клинических проявлений и лечения заболевания, вызванного новой коронавирусной инфекцией (COVID-19) у детей. Версия 2 от 03.07.2020». Согласно данным рекомендациям наряду с обследованием ребенка на SARS-CoV и MERS-CoV следует исключить ряд вирусных инфекций, таких как грипп, парагрипп, аденовирусная инфекция, РСВ-инфекция, риновирусная инфекция, метапневмовирусная инфекция, а также вызванные Mycoplasma pneumoniae и Chlamydia pneumoniae и другими бактериальными агентами, которые могут вызывать пневмонии [14]. В частности, относительно детей в методических рекомендациях сказано, что «для решения вопроса о необходимости назначения противомикробных средств следует ориентироваться на динамику клинических симптомов в сочетании с маркерами воспаления, отдавая предпочтение (там, где это возможно) пероральным формам препаратов. Пероральные формы амоксициллина (в т. ч. защищенного) являются препаратами выбора при типичных (пневмококковых) пневмониях, а макролиды — при атипичных (микоплазменных)» [14]. В последней, 7-й версии рекомендаций для взрослых речь идет о комбинированном назначении антибиотиков: «Пациентам в тяжелом состоянии (в ОРИТ) рекомендована комбинированная терапия: защищенные аминопенициллины, цефалоспорины III поколения (ЦС III) в комбинации с азитромицином или кларитромицином в/в» [15].
Кларитромицин: фармакология, клиническая эффективность и безопасность
Кларитромицин представляет собой метилированное основание эритромицина. Благодаря своей химической структуре кларитромицин — наиболее устойчивый к гидролизу в кислой среде макролид. Особенности химической структуры кларитромицина позволяют снизить осложнения со стороны желудочно-кишечного тракта [16]. Кларитромицин и его основной метаболит 14-гидроксикларитромицин быстро проникают в ткани и жидкости организма, при этом их концентрация в тканях обычно в несколько раз выше, чем в сыворотке крови. Кларитромицин метаболизируется в системе цитохрома P450 3A (CYP3A) [17].
Кларитромицин проявляет высокую активность в отношении широкого ряда аэробных и анаэробных, грамположительных и грамотрицательных микроорганизмов. МПК кларитромицина для большинства возбудителей меньше, чем МПК эритромицина.
Как in vitro, так и в клинической практике доказана активность кларитромицина в отношении большинства штаммов следующих микроорганизмов: Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes, H. influenzae, H. parainfluenzae, Moraxella catarrhalis, Legionella pneumophila, M. pneumoniae, C. pneumoniae, микобактерии avium-комплекса. Кларитромицин in vitro проявляет активность в отношении большинства штаммов следующих микроорганизмов: Streptococcus agalactiae, Streptococcus spp. группы C, F и G, Streptococcus viridans, Listeria monocytogenes, Bordetella pertussis, Pasteurella multocida, Neisseria gonorrhoeae, Clostridium perfringens, Peptococcus niger, Propionibacterium acnes, Bacteroides melaninogenicus, Borrelia burgdorferi, Treponema pallidum, Mycobacterium leprae, M. kansasii, M. chelonae, M. fortuitum, Campylobacter jejuni. В то же время Enterobacteriaceae, Рseudomonas spp. и другие не ферментирующие лактозу грамотрицательные микроорганизмы невосприимчивы к действию кларитромицина [18]. Противовоспалительное действие кларитромицина при вентилятор-ассоциированной пневмонии изучалось на мышах. Известно, что искусственная вентиляция легких (ИВЛ) с использованием повышенного давления связана с повреждением легких. Однако у мышей, получавших кларитромицин, после проведения ИВЛ развилось только незначительное повреждение легких, тогда как у мышей, получавших левофлоксацин, зарегистрировали более выраженные структурные изменения [19].
Показаниями к применению кларитромицина являются инфекционно-воспалительные заболевания, вызванные чувствительными к препарату микроорганизмами: инфек-
ции верхних и нижних дыхательных путей и ЛОР-органов, инфекции кожи и мягких тканей. Кларитромицин рекомендован в качестве препарата первого выбора при лечении острого отита, синусита, бронхита, внебольничной пневмонии, поскольку хорошо проникает в очаг воспаления [20]. Особо следует подчеркнуть способность кларитромицина разрушать микробные биопленки, которые наряду с тканями хозяина способны колонизировать различные медицинские устройства небиологической природы, например, катетеры, протезы, кохлеарные имплантаты [21].
Применение кларитромицина при заболеваниях, обусловленных хламидиями и микоплазмами
Хламидии имеют уникальный, отличный от остальных бактерий цикл развития. Эти облигатные внутриклеточные паразиты существуют за счет энергии клеток хозяина. По современным представлениям хламидии имеют сходный химический состав, общий родоспецифический антиген. Хламидии имеют две формы существования: внеклеточную — элементарные тельца (ЭТ), морфологически зрелые клетки размером 0,2–0,6 мкм, и внутриклеточную — ретикулярные тельца (РТ). Существование хламидий в двух формах объясняет развитие как острых форм инфекции, так и протекающих латентно. Попадая в организм хозяина, ЭТ начинают размножаться, появляются множественные РТ. После проникновения ЭТ в клетку и выхода из нее клетка разрушается, и в таком случае развивается местная воспалительная реакция. Хламидии могут покидать клетку и без повреждения клеточной стенки — путем экзоцитоза, при этом возможно бессимптомное течение инфекции. Полный цикл развития хламидий занимает 48–72 ч.
Микоплазмы — факультативные мембранные паразиты, чрезвычайно требовательные к условиям культивирования. Они обладают разнообразными факторами патогенности. Наиболее изучена M. pneumoniae, обладающая токсическим действием [22].
Хламидиоз — системное инфекционное заболевание, проявляющееся морфологическими, клиническими и функциональными нарушениями со стороны дыхательной системы и других органов-мишеней, сопровождающееся развитием специфической иммунной реакции. Хламидийная инфекция может протекать в двух формах: респираторной и внелегочной (лимфадениты, артриты, миокардиты и т. д.).
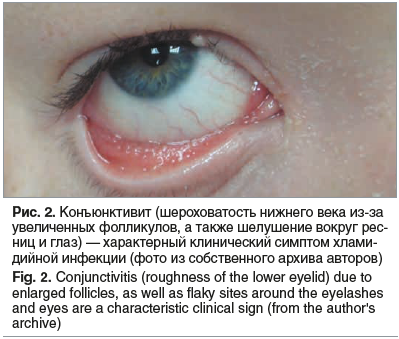
Нами накоплен 30-летний опыт лечения детей с различными формами хламидийной и микоплазменной инфекций. Одним из характерных симптомов при хламидийной инфекции является конъюнктивит (рис. 2).
Еще одним характерным симптомом внутриклеточных инфекций является лимфаденопатия (рис. 3).
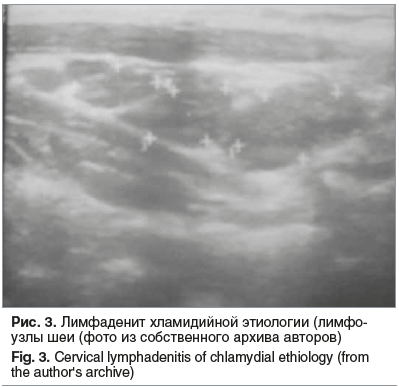
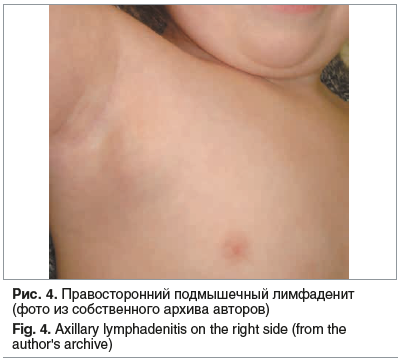
При ультразвуковом обследовании у детей наиболее часто проявляет себя шейная группа лимфоузлов. Увеличение лимфоузлов подмышечной группы может быть как односторонним, так и двусторонним (рис. 4).
Наиболее часто хламидийная и микоплазменная инфекции поражают различные участки респираторного тракта и проявляются в виде назофарингита, ларингита, обструктивного ларинготрахеита (синдром крупа), бронхита (с обструкцией и без обструкции), трахеита, пневмонии, бронхиальной астмы (БА) (рис. 5) [22, 23].
![Рис. 5. Распределение пациентов с хламидийной (n=249) и микоплазменной (n=129) инфекцией по клиническим формам заболевания [23] Fig. 5. Distribution of children with chlamydial (n=249) and mycoplasma (n=129) infections by clinical forms of the disease [23 Рис. 5. Распределение пациентов с хламидийной (n=249) и микоплазменной (n=129) инфекцией по клиническим формам заболевания [23] Fig. 5. Distribution of children with chlamydial (n=249) and mycoplasma (n=129) infections by clinical forms of the disease [23](https://medblog.su/wp-content/uploads/2020/12/1609060835_777_aktualnye-voprosy-lecheniya-vnutrikletochnyh-infektsij-u-detej-savenkova-m-s-savenkov-m-p.png)
Для микоплазменной инфекции более характерны пневмония (61,3%) и бронхит (32,6%), тогда как хламидийная инфекция протекает в различных формах: от крупа (обструктивного ларингита, 15,4%) до пневмонии (31,7%).
Нередко вызванные внутриклеточными возбудителями заболевания протекают в смешанной форме (например, пневмония и артрит одновременно). Кроме того, возможно развитие микст-инфекций, вызванных хламидиями или микоплазмами и другими возбудителями, например герпесвирусами. На рисунке 6 представлены результаты комплексного серологического обследования пациентов с микоплазменной пневмонией, у которых наиболее часто встречались инфекции, вызванные сочетанием микоплазм с хламидиями и микоплазм с вирусом простого герпеса 1-го и 2-го типа.
![Рис. 6. Результаты серологического обследования детей с микоплазменной пневмонией (n=82) [22] Fig. 6. Serological tests results of children with mycoplasma pneumonia (n=82) [22] Рис. 6. Результаты серологического обследования детей с микоплазменной пневмонией (n=82) [22] Fig. 6. Serological tests results of children with mycoplasma pneumonia (n=82) [22]](https://medblog.su/wp-content/uploads/2020/12/1609060835_249_aktualnye-voprosy-lecheniya-vnutrikletochnyh-infektsij-u-detej-savenkova-m-s-savenkov-m-p.png)
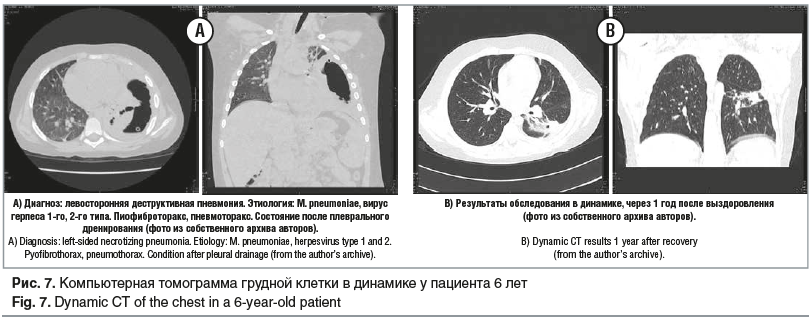
Нами был описан клинический случай тяжелой левосторонней деструктивной пневмонии у мальчика 6 лет. В течение 5 дней ребенок получал лечение амбулаторно, однако состояние ухудшалось, сохранялась лихорадка. Пациент был госпитализирован, на 8-й день от начала заболевания была выполнена плевральная пункция, проведена торакоскопия в 5-м межреберье. В плевральной полости был выявлен выраженный воспалительный процесс с наложением фибрина. На основании результатов комплексного лабораторно-инструментального обследования был поставлен диагноз: «Левосторонняя деструктивная пневмония. Этиология: M. pneumoniae, вирус герпеса 1-го, 2-го типа. Пиофиброторакс, пневмоторакс» (рис. 7). Было выполнено дренирование левой плевральной полости, назначен ацикловир внутривенно и кларитромицин (длительность терапии составила 14 дней). На фоне проводимой терапии пациент выздоровел [24, 25].
Алгоритм диагностики пневмоний и схема лечения внебольничной пневмонии представлены в работе А.Б. Малахова и соавт. (2019) (рис. 8) [26].
![Рис. 8. Алгоритм диагностики внебольничной пневмонии средней степени тяжести у детей [26] Fig. 8. Algorithm for the diagnosis of community-acquired pneumonia of moderate severity in children [26] Рис. 8. Алгоритм диагностики внебольничной пневмонии средней степени тяжести у детей [26] Fig. 8. Algorithm for the diagnosis of community-acquired pneumonia of moderate severity in children [26]](https://medblog.su/wp-content/uploads/2020/12/1609060835_818_aktualnye-voprosy-lecheniya-vnutrikletochnyh-infektsij-u-detej-savenkova-m-s-savenkov-m-p.png)
В случае внутриклеточных инфекций, а также пневмоний обязательно назначение макролидов (азитромицина, джозамицина, кларитромицина, мидекамицина). Однако во временных методических рекомендациях (в период эпидемии), о которых речь шла выше, упоминаются лишь два макролида — азитромицин и кларитромицин.
Известно, что в разных странах эпидемии микоплазменной инфекции происходят с периодичностью 1 раз в 5–8 лет. В период эпидемического подъема микоплазменной инфекции в Москве в 2012–2013 гг. нами было проведено исследование, в рамках которого выполнено 3553 анализа на микоплазмоз у детей, при этом зарегистрировано 177 (20%) позитивных результатов. В данном исследовании мы сравнили эффективность двух схем лечения микоплазменной пневмонии: 1-я схема включала стартовое назначение ЦС III, а затем после получения анализа на микоплазму — макролида (кларитромицина или азитромицина). При 2-й схеме с момента поступления больного назначалась комбинация ЦС III с макролидом одновременно. Результаты лечения оценивались по продолжительности и выраженности клинических симптомов и рентгенологическим данным и были лучше при 2-й схеме лечения [25].
Изучение влияния кларитромицина на выработку цитокинов у детей с острой обструкцией дыхательных путей было проведено в двойном слепом рандомизированном плацебо-контролируемом исследовании в ходе лечения инфекций, вызванных M. pneumoniae и C. pneumoniae. Кларитромицин снижал концентрацию TNF-α, IL-1, IL-10 в слизистой оболочке дыхательных путей [27].
Особую группу составляют часто болеющие дети (ЧБД), в которую входят и дети с аллергической предрасположенностью. Лечение ЧБД связано с трудностями, в частности, представляет трудность выбор антибиотика. В нашем исследовании участвовали 143 ребенка в возрасте от 1 до 17 лет и члены их семей. Результаты у детей из основной группы (ЧБД, n=120) сравнивали с результатами у эпизодически болеющих детей (ЭБД) из контрольной группы (n=23). Обследование детей проводилось с целью выявления аллергопатологии, а также выделения возбудителей из группы вирусов герпеса и внутриклеточных патогенов. В группе ЧБД и их семьях были выявлены повышенная сенсибилизация и инфицирование внутриклеточными возбудителями и вирусами герпеса (табл. 1) [28].
![Таблица 1. Сравнительный анализ инфицирования вирусами герпеса и внутриклеточными возбудителями детей и их родителей [28] Table 1. Comparative analysis of infection with herpes viruses and intracellular bacterial pathogens in children and their parents [2 Таблица 1. Сравнительный анализ инфицирования вирусами герпеса и внутриклеточными возбудителями детей и их родителей [28] Table 1. Comparative analysis of infection with herpes viruses and intracellular bacterial pathogens in children and their parents [2](https://medblog.su/wp-content/uploads/2020/12/1609060835_935_aktualnye-voprosy-lecheniya-vnutrikletochnyh-infektsij-u-detej-savenkova-m-s-savenkov-m-p.png)
Результаты исследования свидетельствуют о внутрисемейной циркуляции выявленных возбудителей, поэтому для ее прекращения целесообразно лечить не только детей, но и их родителей.
Довольно долго спорным был вопрос о значении внутриклеточных инфекций при БА и хронической обструктивной болезни легких (ХОБЛ). В результате изучения этого вопроса на протяжении более чем 10 лет доказано, что хламидии и микоплазмы не только являются триггерами, но без своевременного лечения могут сформировать хроническое заболевание. Кларитромицин и азитромицин при этих инфекциях наиболее приемлемы у пациентов с бронхиальной астмой и хронической обструктивной болезнью легких [29]. Лечение кларитромицином в дозе 10–15/кг в сутки, разделенной на 2 приема, в течение 4–21 сут у младенцев с заболеваниями нижних дыхательных путей, обусловленными C. pneumoniae, привело к улучшению клинических, рентгенологических и лабораторных показателей [30]. M. pneumoniae может быть этиологическим фактором поражения не только дыхательной системы, но и других органов и систем, приводя к развитию менингоэнцефалитов [31], гемолитико-геморрагического синдрома [32], эндокардита [33], которые также являются показаниями к назначению макролидов.
Н.О. Кувардина и соавт. (2019) изучали поражения кожи и слизистых оболочек при микоплазмозе, нередко сочетающиеся с поражением других органов и систем, которые патогенетически являются результатом иммуновоспалительных реакций, развивающихся в сосудистом русле. Эти кожные симптомы или синдромы чаще представлены картиной необычных высыпаний и поражений слизистых, подобных таковым при ветряной оспе и псориазе. При сочетании микоплазмоза с инфекциями, вызванными вирусом простого герпеса, цитомегаловирусом, вирусом Эпштейна — Барр, врачу приходится проводить дифференциальный диагноз с синдромом Фукса, токсикодермией и др. В группе детей с сочетанной микоплазменной и герпесвирусной инфекциями антитела к антигенам гладкой мускулатуры в титре от 1:80 до 1:160 (при норме 1:40) обнаруживались у всех
18 детей, антитела к антигенам эндотелия сосудов в титре от 1:80 до 1:320 (при норме 1:40) регистрировались у 16 из 18 детей [34].
Кларитромицин выпускается в различных лекарственных формах: в таблетках, покрытых пленочной оболочкой, таблетках с пролонгированным высвобождением, покрытых пленочной оболочкой (Клацид® СР) [35], гранулах для приготовления суспензии для приема внутрь [36].
Кларитромицин и азитромицин: в чем отличия?
R.J. Davidson et al. (2019) на основании сравнения данных об антибактериальной активности in vitro и фармакодинамических/фармакокинетических параметров кларитромицина и азитромицина пришли к выводу о том, что при использовании азитромицина создается больше предпосылок для развития устойчивости микроорганизмов вследствие более длительного периода полувыведения и меньшей антибактериальной активности данного антибиотика. В отношении оценки свойств данных антибиотиков in vivo было показано, что кларитромицин обладает наибольшей активностью в отношении чувствительного
S. pneumoniae. Значения МПК кларитромицина и азитромицина для 90% штаммов составили 0,06 мкг/мл. Азитромицин, кларитромицин и эритромицин имели очень высокую активность в отношении M. pneumoniae, C. pneumoniae,
L. pneumophila [37].
Проблема резистентности M. pneumoniae к макролидам
M. pneumoniae не имеют клеточной стенки и, следовательно, устойчивы к β-лактамам и всем антимикробным препаратам, воздействующим на клеточную стенку.
M. pneumoniae изначально чувствительны к макролидам, которые являются препаратами первой линии для подавления данного инфекционного агента.
До 2000 г. инфекции, вызванные M. pneumoniae, хорошо излечивались с помощью макролидов, но начиная с этого времени уровень резистентности к макролидам, особенно в Азии (в частности, в Японии, Китае и Южной Корее), увеличился до 90–100% [38]. Однако нередко приходится сталкиваться и с ошибочными рассуждениями относительно резистентности к макролидам, когда данные показатели экстраполируются на другие страны, в т. ч. на Россию. В Европе и США уровень устойчивости M. pneumoniae к макролидам умеренный: во Франции — 8,3% (2011), Германии — 1,2% (2003–2008), Италии — 26% (2010), Швейцарии — 2% (2011–2013), Израиле — 30% (2010), Австралии — 3,3% (2008–2012), Англии — 0–9,3% (2010–2015), США — 3,5–13,2% (2006–2014) [38]. Антибиотики с потенциальной активностью против M. pneumoniae включают макролиды, линкозамиды, комбинацию стрептограмина и кетолиды (устойчивость к макролидам, линкозамидам и стрептограмину В, MLSB-устойчивость), а также тетрациклины и фторхинолоны. Эти антибиотики способны накапливаться в клетках и таким образом воздействовать на микоплазмы. Однако доксициклин и хинолоны во многих странах мира не разрешены к применению у детей младше 8 лет [38]. Макролиды остаются препаратами выбора для лечения детей даже в случае выявленной резистентности. Причем в одной и той же стране, как показали исследования, проведенные в Японии, имеются региональные различия по резистентности M. pneumoniae (от 0% до 100%) [39].
Антибиотикорезистентность M. pneumoniae связана с приобретенными мутациями в результате генетической трансформации 23S pРНК и рибосомных белков L4 и L22 [40, 41]. Сравнение результатов секвенирования с тестом на чувствительность к противомикробным препаратам подтвердило, что мутации A2058G и A2059G привели к высокому уровню устойчивости M. pneumoniae к 14- и 15-членным макролидам [42, 43], в то время как на 16-членные макролиды влияние оказала замена на A2059G. В различных регионах России под руководством Р.С. Козлова (НИИ антимикробной химиотерапии
Смоленской государственной медицинской академии) проводились многоцентровые проспективные микробиологические исследования «ПеГАС» по изучению резистентности к различным группам антимикробных препаратов. Устойчивость к 14-, 15- и 16-членным макролидам в течение указанного периода была относительно стабильной и составляла не более 8,2, 8,2 и 6,3% соответственно [44, 45].
Безопасность применения кларитромицина
Наиболее распространенными побочными реакциями у взрослых и детей при лечении кларитромицином являются боль в животе, диарея, тошнота, рвота и искажение вкуса. Эти побочные реакции обычно незначительно выражены. Макролиды обладают низкой токсичностью, поэтому предпочтительны для применения у детей раннего возраста. Кларитромицин противопоказан при гиперчувствительности к макролидам или вспомогательным веществам, при удлинении интервала QT в анамнезе, желудочковой аритмии, гипокалиемии (существует риск увеличения интервала QT), тяжелой печеночной недостаточности. Назначение макролидов может приводить к развитию желудочковой тахикардии типа «пируэт», которая связана со способностью макролидов влиять на калиевые каналы [46, 47]. К факторам риска кардиотоксических эффектов относятся прежде всего пожилой возраст, высокие дозы, сопутствующие сердечно-сосудистые заболевания, а также прием препаратов, при совместном использовании которых с макролидами можно ожидать увеличения интервала QT [48]. Одним из таких препаратов, как было выявлено во время эпидемии новой коронавирусной инфекции COVID-19, является противомалярийный препарат гидроксихлорохин. В конце мая 2020 г. появилась работа, основанная на данных анализа мультинационального регистра, в который были включены 96 032 пациента с лабораторно подтвержденной инфекцией и с тяжелым течением COVID-19. По результатам этого исследования установлено, что применение гидроксихлорохина ассоциировано с повышением риска внутригоспитальной смертности. Также была выявлена ассоциация применения гидроксихлорохина, в т. ч. в комбинации с макролидом (азитромицином), с развитием желудочковых аритмий во время госпитализации. Основываясь на полученных данных, 26 мая 2020 г. ВОЗ приняла решение приостановить клинические испытания гидроксихлорохина в рамках программы Solidarity для дополнительной оценки его безопасности [15].
Заключение
Таким образом, макролиды на сегодняшний день сохраняют свою актуальность и активность. В настоящем обзоре представлены данные литературы и результаты собственных исследований, касающиеся представителей макролидов — препаратов линейки Клацид® — при лечении различных форм внутриклеточных хламидийной и микоплазменной инфекций. Препараты Клацид® — это оригинальные препараты кларитромицина со стабильным содержанием действующего вещества и стабильными показателями растворимости [48]. Грамотное назначение кларитромицина как при моноинфекции, так и при смешанных, обусловленных другими бактериальными, герпесвирусными агентами, а также при острых респираторных заболеваниях поможет сохранить данный антибиотик для дальнейшей эффективной клинической практики. При лечении внутриклеточных инфекций следует учитывать фактор внутрисемейного инфицирования, при котором требуется лечение всей семьи.
Благодарность
Авторы и редакция благодарят компанию «Эбботт» за предоставление полных текстов иностранных статей, требовавшихся для подготовки данной публикации.
Acknowledgement
The authors and Editorial Board are grateful to «Abbott» for providing full-text foreign articles required to write.
Сведения об авторах:
Савенкова Марина Сергеевна — д.м.н., профессор кафедры клинической функциональной диагностики факультета дополнительного профессионального образования, ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, Россия, 117997, г. Москва, ул. Островитянова, д. 1; главный внештатный инфекционист ТИНАО, ГБУЗ «Морозовская ДГКБ ДЗМ», Россия, 119049, г. Москва, пер. 4-й Добрынинский, д. 1/9, ORCID iD 0000-0002-1648-8683.
Савенков Михаил Петрович — д.м.н., профессор, заведующий кафедрой клинической функциональной диагностики факультета дополнительного профессионального образования, ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, Россия, 117997, г. Москва, ул. Островитянова, д. 1, ORCID iD 0000-0002-0000-0000.
Контактная информация: Савенкова Марина Сергеевна, e-mail: pr-rnimu@yandex.ru. Конфликт интересов отсутствует. Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах. Статья поступила 14.08.2020, поступила после рецензирования 04.09.2020, принята в печать 17.09.2020 .
About the authors:
Marina S. Savenkova — Dr. of Sci. (Med.), Professor of the Department of Clinical Functional Diagnostics, Faculty of Additional Professional Education, Pirogov Russian National Research Medical University, 1, Ostrovityanova str., Moscow, 117997, Russian Federation, Chief External Infectious Disease Specialist at TINAO, Morozov Children’s City Clinical Hospital, 1/9, Dobryninskii 4th lane, Moscow, 119049, Russian Federation; ORCID iD 0000-0002-1648-8683.
Mikhail P. Savenkov — Dr. of Sci. (Med.), Professor, Head of the Department of Clinical Functional Diagnostics, Faculty of Additional Professional Education, Pirogov Russian National Research Medical University, 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-0000-0000.
Contact information: Marina S. Savenkova, e-mail: pr-rnimu@yandex.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 14.08.2020, revised 04.09.2020, accepted 17.09.2020 .
.
Информация с rmj.ru






