Введение
Эндокринная офтальмопатия (ЭОП) представляет собой органоспецифическое аутоиммунное заболевание, характеризующееся увеличением объема ретробульбарной клетчатки, воспалительными изменениями, отеком и последующим фиброзом глазодвигательных мышц [1]. Наиболее часто ЭОП ассоциирована с болезнью Грейвса, реже наблюдается при аутоиммунном тиреоидите [2].
В основе патогенеза клинических проявлений ЭОП лежит выработка антител к рецепторам тиреотропного гормона (ТТГ), экспрессируемым на тиреоцитах и орбитальных фибробластах, а также повышенная секреция цитокинов Т-лимфоцитами [1, 3]. Аутоантитела, связываясь с рецепторами фибробластов, инициируют каскад патологических реакций, приводящих к пролиферации клеток соединительной ткани, их дифференцировке в адипоциты и повышенному синтезу гиалуроновой кислоты. Параллельно цитокины, выступая в роли провоспалительных медиаторов, потенцируют воспалительный ответ, что обусловливает развитие отека орбитальных тканей с последующим фиброзированием [4].
Клиническая картина ЭОП демонстрирует стадийность развития. На начальном этапе преобладают симптомы в виде слезотечения, светобоязни, ощущения инородного тела, отечности век и конъюнктивы. При прогрессировании заболевания формируются экзофтальм и функциональные нарушения: диплопия, ограничение подвижности глазных яблок, ретракция век [1, 3, 5]. К угрожающим зрению осложнениям относятся компрессионно-ишемическая оптическая нейропатия и/или кератопатия с риском изъязвления роговицы [1].
Миастения гравис представляет собой хроническое аутоиммунное заболевание нервно-мышечного соединения, ключевым проявлением которого служит патологическая утомляемость и слабость поперечно-полосатой мускулатуры [6]. В основе патогенеза лежит выработка аутоантител к ключевым белкам постсинаптической мембраны: ацетилхолиновым рецепторам, мышечно-специфической киназе, липопротеин-связанному рецепторному белку 4 [7]. Это приводит к деградации и уплощению постсинаптической мембраны, следствием чего является нарушение нервно-мышечной передачи [8].
Патогенез миастении определяет ее ключевое клиническое проявление — флуктуирующую слабость скелетной мускулатуры [6]. При поражении глазодвигательных мышц развиваются патогномоничные симптомы: асимметричный птоз, усиливающийся при нагрузке и характеризующийся феноменом попеременности; диплопия с ограничением подвижности глазных яблок вследствие диссинхронизации работы экстраокулярных мышц; неполное смыкание век, обусловленное слабостью круговой мышцы глаза [9, 10].
Несмотря на различные патогенетические механизмы, сосуществование ЭОП и миастении гравис у одного пациента создает значительные диагностические трудности ввиду перекрывания ключевых симптомов — диплопии и ограничения подвижности глазных яблок [11]. Сочетание этих заболеваний встречается редко, что обусловливает недостаточную настороженность врачей и риск ошибочной интерпретации клинической картины. В данной статье мы представляем собственное клиническое наблюдение сочетанной патологии, где первоначальный диагноз ЭОП потребовал расширения и пересмотра в связи с устойчивостью к стандартной терапии. Получено информированное добровольное согласие пациентки на публикацию клинического наблюдения.
Содержание статьи
Клиническое наблюдение
Пациентка Л., 45 лет. В марте 2022 г. впервые обратилась к эндокринологу с симптомами тиреотоксикоза: сердцебиением, снижением массы тела на 9 кг, тремором рук и лабильностью настроения. Лабораторно подтвержден тиреотоксикоз: ТТГ <0,05 мМЕ/л, свободный Т4 — 36 пмоль/л, антитела к рецептору ТТГ — 14 МЕ/л. По данным ультразвукового исследования щитовидной железы (ЩЖ) зафиксировано увеличение ее объема до 26 мл с диффузной неоднородностью структуры. Установлен диагноз: диффузный токсический зоб, тиреотоксикоз. Назначена терапия тиамазолом 20 мг/сут.
В течение 2022–2023 гг. на фоне терапии достигнута стабильная эутиреоидная компенсация с последующим снижением дозы тиамазола до 5 мг/сут. В декабре 2023 г. на фоне стресса зарегистрирован рецидив тиреотоксикоза (ТТГ <0,05 мМЕ/л, свободный Т4 — 30 пмоль/л) с повышением уровня антитела к рецептору ТТГ >30 МЕ/л. В связи с нестабильным течением заболевания и неэффективностью консервативного лечения принято решение о выполнении тотальной тиреоидэктомии. В послеоперационном периоде назначена заместительная терапия левотироксином в дозе 75 мкг/сут с поддержанием целевых значений ТТГ в диапазоне 0,4–4,0 мЕд/л.
В марте 2024 г. пациентка обратилась к офтальмологу с жалобами на диплопию, сухость глаз, отечность век и расширение глазной щели. Указанная симптоматика отмечалась с января 2024 г. На момент осмотра пациентка применяла глазные капли, содержащие натрия гиалуронат и декспантенол, по 2 капли 4 р/сут и по потребности. Офтальмологический анамнез не отягощен.
При объективном обследовании выявлены выраженный экзофтальм и расходящееся косоглазие при взгляде прямо. Отмечалось ограничение подвижности глазных яблок рестриктивного характера: при взгляде вправо отсутствовала аддукция левого глаза, при взгляде влево — аддукция правого глаза. Наблюдался отек век и конъюнктивы. Острота зрения составляла 1,0 на оба глаза, внутриглазное давление: OD — 19 мм рт. ст., OS — 17 мм рт. ст.
По данным компьютерной томографии (КТ) орбит подтвержден выраженный экзофтальм: OD — 26,6 мм, OS — 25,8 мм. Визуализируется значительное утолщение медиальных прямых мышц и избыточное разрастание ретробульбарной жировой клетчатки (рис. 1).
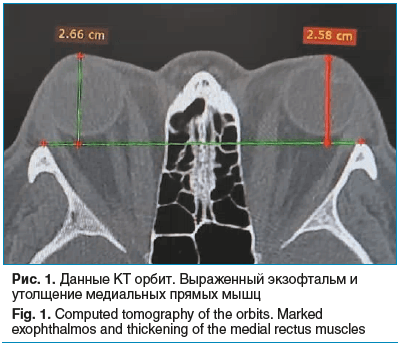
При этом выявлено клинико-рентгенологическое несоответствие: несмотря на преимущественное поражение медиальных прямых мышц по данным КТ, офтальмологическое обследование выявило отсутствие конвергенции с развитием рестриктивного косоглазия, что является характерным признаком ЭОП (рис. 2, 3).
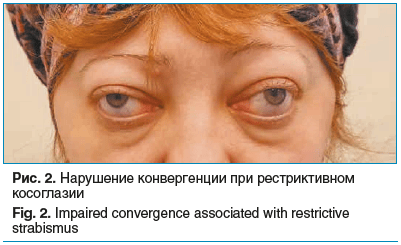
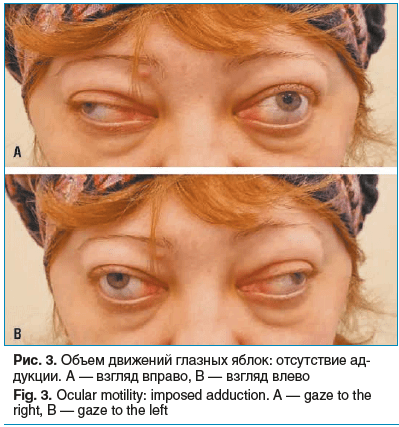
На основании анализа жалоб, данных анамнеза, объективного офтальмологического осмотра и результатов КТ-исследования установлен диагноз: эндокринная офтальмопатия, активная фаза, средней степени тяжести.
В соответствии с клиническими рекомендациями была проведена пульс-терапия метилпреднизолоном по схеме: внутривенная инфузия 500 мг препарата (в 250 мл 0,9% раствора натрия хлорида) № 6 с последующим переходом на 250 мг (в 250 мл 0,9% раствора натрия хлорида) № 6 1 р/нед. Суммарная доза составила 4500 мг. Однако проведенная терапия не имела значимого клинического эффекта.
В связи с неэффективностью консервативного лечения выполнена костно-жировая декомпрессия орбит, в ходе которой полностью или частично резецированы три костные стенки орбиты и удалено приблизительно 5 мл ретробульбарной клетчатки с каждой стороны с одновременной коррекцией нижних грыж век (рис. 4).

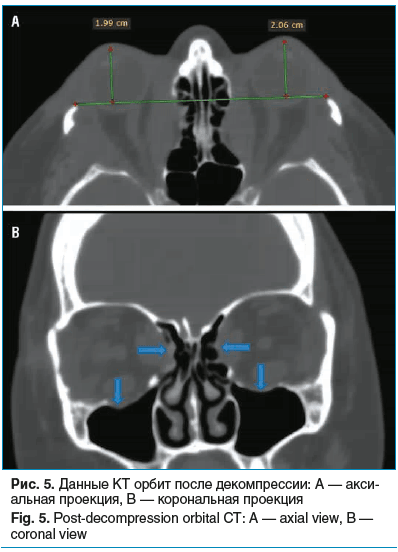
Контрольная КТ орбит подтвердила уменьшение экзофтальма до значений OD — 19,9 мм, OS — 20,6 мм, что составило регрессию на 6–7 мм. На томограммах визуализируются костные дефекты наружных и частично внутренних стенок орбит (рис. 5).
В марте 2025 г., с учетом отсутствия восстановления глазодвигательной функции (сохраняющееся отсутствие конвергенции) в послеоперационном периоде проведено дополнительное обследование пациентки. Персистирующие нарушения моторики позволили предположить глазную форму миастении гравис. При сборе семейного анамнеза установлено, что мать пациентки страдает генерализованной формой миастении. Проведенный декремент-тест выявил электронейромиографические признаки нарушения нервно-мышечной передачи по миастеническому типу. Серологически обнаружены антитела к ацетилхолиновым рецепторам, что подтвердило диагноз миастении.
Назначена терапия: длительный пероральный прием преднизолона в стартовой дозе 1 мг/кг/сут с последующим снижением на 5 мг каждые 2 нед. до минимально эффективной поддерживающей дозы, и пиридостигмина бромид 60 мг 3 р/сут.
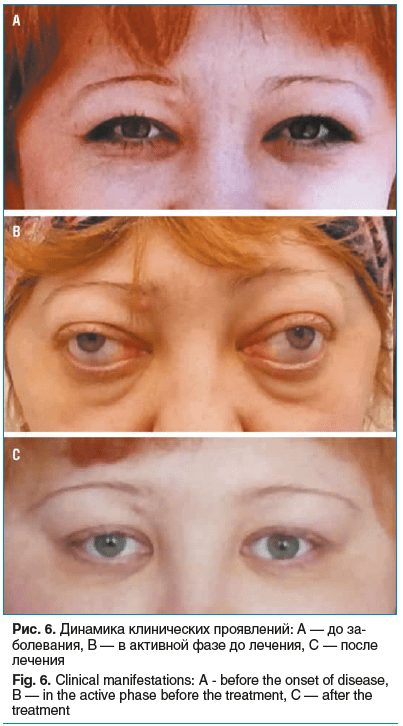
На текущий момент продолжается постепенное снижение дозы преднизолона. Заместительная терапия L-тироксином после тиреоидэктомии адекватно подобрана. Признаки активности ЭОП отсутствуют. Хирургическая декомпрессия орбит обеспечила регресс экзофтальма на 6–7 мм с каждой стороны и улучшение объема движений глаз. Подбор и титрация доз глюкокортикоидов и антихолинэстеразных препаратов позволили достичь полного восстановления конвергенции и нормальной моторики глазодвигательных мышц (рис. 6).
Обсуждение
Дифференциальная диагностика сочетанной аутоиммунной патологии представляет значительные сложности в связи с перекрыванием клинических симптомов. Первоначально офтальмологическая симптоматика была интерпретирована как проявление ЭОП на фоне дисфункции ЩЖ [1, 5]. Однако отсутствие положительного клинического ответа на стандартную терапию глюкокортикоидами в дозах, эффективных при ЭОП, а также сохранение нарушений конвергенции после хирургической декомпрессии орбит позволили предположить наличие сопутствующего заболевания [7]. Диагностический поиск был завершен проведением декремент-теста и лабораторного исследования на наличие специфических аутоантител, что подтвердило диагноз миастении гравис [6, 9].
Эффективность преднизолона при миастении гравис подтверждена рядом исследований. В рандомизированном плацебо-контролируемом исследовании EPITOME показана высокая эффективность преднизолона в лечении глазной формы миастении — достижение стабильной минимальной манифестации заболевания за 14 нед. терапии [12]. Проспективное исследование T.A. Europa et al. [13] продемонстрировало полное восстановление глазодвигательных функций у 59% пациентов с миастенией в течение 12 мес. иммуносупрессивной терапии.
В представленном клиническом наблюдении успешный терапевтический результат был достигнут благодаря назначению комбинированной схемы лечения, включающей пиридостигмина бромид и преднизолон. Данная терапевтическая стратегия соответствует международным рекомендациям по ведению миастении гравис [6]. Пиридостигмина бромид, являясь ингибитором ацетилхолинэстеразы, обеспечивает симптоматическое улучшение нервно-мышечной передачи, тогда как преднизолон оказывает патогенетическое иммуносупрессивное действие, направленное на подавление аутоиммунного процесса. Сочетанное применение этих препаратов позволило не только купировать симптомы миастении, но и добиться полного восстановления глазодвигательных функций, что подтверждает эффективность выбранной тактики лечения.
Важным аспектом лечения явилось выполнение тиреоидэктомии в связи с рецидивирующим тиреотоксикозом, резистентным к консервативному лечению, поскольку, согласно современным данным, хирургическое лечение заболеваний ЩЖ может рассматриваться как метод выбора при нестабильном течении аутоиммунной патологии [1, 3]. Достижение стабильного эутиреоидного статуса после тиреоидэктомии создало благоприятные условия для эффективности последующей иммуносупрессивной терапии, что согласуется с данными литературы о взаимном влиянии аутоиммунных процессов ЩЖ и нарушений нервно-мышечной передачи [8, 11]. Учитывая, что дисфункция ЩЖ может выступать провоцирующим фактором развития миастении в 3–5% случаев [11], а развитие ЭОП на фоне гипертиреоза встречается значительно чаще — в 25–50% наблюдений [2], сочетанное применение тиреоидэктомии и иммуносупрессивной терапии в представленном наблюдении позволило не только купировать симптомы ЭОП, но и добиться полного восстановления неврологических функций, что подчеркивает важность достижения контроля над эндокринным заболеванием как основы успешной терапии неврологических проявлений.
Заключение
Данное клиническое наблюдение представляет интерес для эндокринологов, офтальмологов и неврологов. Знание особенностей течения ЭОП и миастении гравис, характерных изменений в орбите при данных заболеваниях, позволит специалистам своевременно провести дифференциальную диагностику и определиться с лечением. Поэтапный подход к лечению ЭОП лекарственными и хирургическими методами обеспечит отличные функциональные и эстетические результаты при устранении экзофтальма.
Сведения об авторах:
Атарщиков Дмитрий Сергеевич — к.м.н., врач-офтальмолог, офтальмохирург, орбитальный хирург, окулопластический хирург АО «Группа компаний «Медси»; 123056, Россия, г. Москва, Грузинский пер., д. 3а; ORCID iD 0000-0003-4401-9099
Таскина Елизавета Сергеевна — к.м.н., доцент кафедры офтальмологии ФГБОУ ВО ЧГМА Минздрава России; 672000, Россия, г. Чита, ул. Горького, д. 39а; ORCID iD 0000-0002-6223-8888
Подкопаева Дарья Павловна — клинический ординатор кафедры офтальмологии; ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119048, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0009-0007-0984-5113
Кибалина Наталья Игоревна — врач — пластический хирург АО «Группа компаний «Медси»; 123056, Россия, г. Москва, Грузинский пер., д. 3а; ORCID iD 0000-0002-8930-6588
Контактная информация: Таскина Елизавета Сергеевна, e-mail: taskins@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 09.06.2025.
Поступила после рецензирования 04.07.2025.
Принята в печать 29.07.2025.
About the authors:
Dmitryi S. Atarshchikov — C. Sc. (Med.), Ophthalmologist, Ophthalmic Surgeon, Orbital Surgeon, Oculoplastic Surgeon, AO GK Medsi; 3a, Gruzinskiy lane, Moscow, 123056, Russian Federation; ORCID iD 0000-0003-4401-9099
Elizaveta S. Taskina — C. Sc. (Med.), Assistant Professor of the Department of Ophthalmology, Chita State Medical Academy; 39a, Gorkyi str., Chita, 672000, Russian Federation; ORCID iD 0000-0002-6223-8888
Daria P. Podkopaeva — Clinical Resident of the Department of Ophthalmology; I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119048, Russian Federation; ORCID iD 0009-0007-0984-5113
Natalia I. Kibalina — Plastic Surgeon, AO GK Medsi; 3a, Gruzinskiy lane, Moscow, 123056, Russian Federation; ORCID iD 0000-0002-8930-6588
Contact information: Elizaveta S. Taskina, e-mail: taskins@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 09.06.2025.
Revised 04.07.2025.
Информация с rmj.ru






