Хронический гастрит и
функциональная диспепсия. Единство и борьба двух
противоположностей
Н.В. Бакулина
С.В. Тихонов
Н.Б. Лищук
Северо-Западный государственный медицинский
университет имени И.И. Мечникова; 191015, Россия,
Санкт-Петербург, ул. Кирочная, д. 41.
Резюме
В обзорной статье описывается эпидемиология,
клиническая картина, патогенез, подходы к
диагностике и терапии хронического гастрита и
функциональной диспепсии. Хронический гастрит –
необоснованно распространенный диагноз в
отечественной клинической практике,
устанавливающийся у большинства пациентов с
беспокоящими диспепсическими жалобами.
В соответствии с международными согласительными
документами, хронический гастрит прежде всего
морфологическое понятие. Хронический гастрит не
имеет патогномоничных клинических признаков и
должен диагностироваться в процессе
гистологического исследования слизистой желудка.
Функциональная диспепсия – диагноз, отражающий
наличие у больного определенного симптомокомплекса
(боли или жжение в эпигастрии, чувство
переполнения или раннего насыщения) при отсутствии
органических заболеваний, которые могли бы
объяснить данную симптоматику. Вторичная диспепсия
диагностируется у пациентов с органическими
заболеваниями верхних отделов желудочно-кишечного
тракта, метаболическими или системными
заболеваниями, являющимися причиной
диспепсического синдрома. В процессе обследования
пациента с беспокоящими диспепсическими жалобами
врачу целесообразно использовать диагноз
«диспепсия неуточненная» — предварительный диагноз
до проведения лабораторного и инструментального
обследования, направленного на выявление причины
диспепсического синдрома. Диспепсия,
ассоциированная с Н. pylori,
диагностируется у пациентов с хеликобактерной
инфекцией. Диагноз пересматривается в динамике и
является правомочным в случае купирования жалоб в
течение 6 мес. после эффективной эрадикации H.
pylori.
Основными препаратами для лечения пациентов с
жалобами диспепсического характера являются
ингибиторы протонной помпы и прокинетики.
Фиксированная комбинация омепразола и домперидона
с замедленным высвобождением активного вещества
характеризуется оптимальной эффективностью и
хорошим профилем безопасности у пациентов как с
функциональной, так и с вторичной диспепсией и
обеспечивает высокую приверженность к проводимому
лечению.
Ключевые слова: хронический гастрит, Н.
pylori, функциональная диспепсия, синдром
эпигастральной боли, постпрандиальный
дистресс-синдром, ингибиторы протонной помпы,
омепразол, прокинетики, домперидон
Для цитирования: Бакулина Н.В., Тихонов
С.В., Лищук Н.Б. Хронический гастрит и
функциональная диспепсия. Единство и борьба двух
противоположностей. Медицинский совет.
2021;(15):164–174. ht tps://doi.org/10.21518/2079-701X-2021-15-164-174.
Конфликт интересов: статья написана при
поддержке фармакологической компании Dr. Reddy’s
Laboratories Ltd. Это никак не повлияло на мнение
авторов.
ВВЕДЕНИЕ
По утверждению Л. Кэролла: «Необходимо бежать со
всех ног, чтобы только оставаться на месте, а
чтобы куда-то попасть, надо бежать как минимум
вдвое быстрее». Так, несмотря на проведения
большого количества клинических исследований,
доступность современных отечественных и зарубежных
рекомендаций, посвященных хроническому гастриту и
функциональной диспепсии, первичная заболеваемость
населения Российской Федерации болезнями органов
пищеварения за последние 20 лет существенно не
изменилась: в 2000 г. – 32,3 человека, в 2019 г. –
33 человека на 1000 жителей [1]. На протяжении 20
лет в структуре заболеваний органов пищеварения во
всех возрастных группах преобладают хронические
гастриты и практически отсутствует диагноз
«функциональная диспепсия» [1–3].
Функциональная диспепсия до сих пор является
непривычным диагнозом, в особенности для
терапевтов и врачей общей практики, к которым, как
правило, обращаются пациенты с беспокоящими
диспепсическими жалобами, что обуславливает
отсутствие объективных статистических данных по
данному заболеванию в нашей стране.
Гипердиагностика хронического гастрита отмечается
не только в отечественной медицине. Обзорную
статью от 2020 г., посвященную проблеме
хронического гастрита, ведущие мировые эксперты в
области гастроэнтерологии P. Malfertheiner и M.
Rugge начинают следующими словами: «Гастрит широко
и необоснованно диагностируется у пациентов с
жалобами со стороны верхних отделов
желудочно-кишечного тракта (ЖКТ)» [4].
В обзорной статье обсуждаются дефиниции и
патофизиология хронического гастрита и
функциональной диспепсии, подходы к диагностике и
лечению. Правильное понимание практикующими
врачами взаимоотношения между хроническим
гастритом и функциональной диспепсией,
принципиального отличия патогенеза данных
страданий, является крайне важным для выработки
эффективной тактики обследования и лечения.
ОПРЕДЕЛЕНИЕ, ЭПИДЕМИОЛОГИЯ, ПАТОФИЗИОЛОГИЯ
ХРОНИЧЕСКОГО ГАСТРИТА
Хронические гастриты – группа заболеваний,
развивающихся вследствие различных причин и
морфологически характеризующихся воспалением и
дистрофическими процессами в слизистой оболочке
желудка [5, 6]. Исходя из приведенного
определения, диагноз «хронический гастрит»
является прежде всего морфологическим и
устанавливается на основании гистологического
исследования биоптатов слизистой оболочки желудка.
Этиология хронического гастрита определяет выбор
эффективного лечения. Этиологическая классификация
гастритов, предложенная экспертами при создании
Киотского консенсуса от 2015 г., приводится в
табл. 1 [7].
Таблица 1. Этиологическая
классификация гастритов [7]
| Типы гастрита | Подтипы гастрита |
|---|---|
| Аутоиммунный гастрит | — |
| Инфекционный гастрит | Вызванный H.pylori; вызванный другими бактериями (Helicobacter hellmani, Enterococcus, Micobacteria и т.д.); вызванный вирусами (энтеровирусный, цитомегаловирусный и др.); вызванный грибами; вызванный паразитами; флегмона желудка |
| Гастрит, вызванный внешними причинами | Лекарственный; алкогольный; радиационный; химический; на фоне дуоденогастральных рефлюксов |
| Гастрит, имеющий специфические причины | Лимфобластный; гигантский гипертрофический (болезнь Менетрие); аллергический; эозинофильный |
| Вторичный гастрит | При саркоидозе, при васкулитах, при болезни Крона |
Хронический гастрит в подавляющем большинстве
случаев не визуализируется при проведении
стандартного эндоскопического исследования, при
этом, согласно 5-му положению Киотского
консенсуса, эрозии желудка должны выноситься в
диагноз отдельно от хеликобактерного гастрита,
учитывая их более частое возникновение вследствие
лекарственного воздействия, в частности на фоне
терапии нестероидными противовоспалительными
препаратами [7].
Хроническое воспаление в слизистой желудка, как
правило, не беспокоит пациента. Проведенные
исследования продемонстрировали, что выраженность
воспалительных и дистрофических изменений
слизистой не коррелирует с наличием и
выраженностью клинической симптоматики. При этом у
пациентов без воспалительных изменений слизистой
могут присутствовать выраженные клиническими
жалобами, оказывающие значимое влияние на качество
жизни [8, 9]. Согласно положению 7 Киотского
консенсуса, H. pylori-ассоциированный
гастрит является причиной жалоб диспепсического
характера лишь у части пациентов [7].
Распространенность хронического гастрита в
популяции является крайне высокой (50–80% среди
взрослого населения) и коррелирует с
инфицированностью H. pylori [3, 10]. С
возрастом частота заболевания увеличивается – до
50 лет ту или иную форму гастрита имеют 60%, в
возрасте старше 50 лет – 95% населения [11].
Наиболее распространенной формой является
хеликобактерный гастрит – около 90% случаев,
аутоиммунный гастрит составляет 5%, другие формы
гастритов встречаются значительно реже [3, 6].
Нередким вариантом хронического гастрита, которому
не уделяется должного внимания в клинической
практике и в согласительных документах, является
хронический билиарный рефлюкс-гастрит или
химический гастрит типа С. Данная форма входила в
рубрику гастрита с неустановленной этиологией по
МКБ-10, в МКБ-11 гастрит на фоне
дуоденогастрального рефлюкса (ДГР) будет иметь
отдельный шифр DA42.51. Хронический билиарный
рефлюкс-гастрит развивается в результате заброса
дуоденального содержимого, включающего желчные
кислоты, панкреатические ферменты, лизолецитин и
другие агрессивные субстанции. Причинами ДГР может
быть нарушение моторики 12-перстной кишки,
некоординированная работа антродуоденального
перехода, повышение давления в желудке или ДПК,
моторно-эвакуаторные нарушения в антродуоденальной
зоне, нарушение моторики желчного пузыря или его
отсутствие [12–14]. Желчные кислоты за счет их
способности разрыхлять и разрушать фосфолипидный
слой мембран способствуют диффузии ионов водорода
в межклеточные пространства, вызывая их
ацидификацию и ишемию слизистой оболочки желудка
[14–16]. На фоне длительных патологических
дуоденогастральных рефлюксов в слизистой оболочке
антрального отдела нередко формируются участки
кишечной метаплазии [14–19].
Исходом длительно протекающего хронического
гастрита являются атрофические, метапластические,
диспластические изменения слизистой оболочки, в
ряде случаев аденокарцинома. Последовательность
данных событий описана P. Correa еще до открытия
хеликобактерной инфекции и получила название
«каскад Correa» [20, 21]. Атрофия слизистой
характеризуется нарастающим необратимым
уменьшением количества желудочных желез, а
метаплазия – замещением желудочного эпителия
эпителиальными клетками других локализаций, как
правило кишечными. Кишечная метаплазия может быть
полной – замещение тонкокишечными клетками и
неполной – замещение толстокишечными клетками
[20–24]. Пациенты с выраженными атрофическими и
метапластическими изменениями в слизистой желудка
нуждаются в динамическом наблюдении и лечении
[19-22]. Учитывая необратимость кишечной
метаплазии, риски развития аденокарциномы
сохраняются у пациентов даже после успешной
эрадикации H. pylori [25].
Хронический гастрит – морфологический диагноз,
устанавливающийся на основании эндоскопического
исследования, позволяющего оценить локализацию и
протяженность воспалительного и/или атрофического
процесса и получить биоптаты слизистой для
морфологического подтверждения заболевания
(выраженность воспаления, наличие атрофии,
метаплазии, дисплазии). Эндоскопическое
исследование на аппаратуре экспертного класса с
функцией высокого разрешения, в режиме NBI (Narrow
Band Imaging – узкоспектральная эндоскопия), с
проведением хромоскопии характеризуется наибольшей
специфичностью и чувствительностью [26].
Классификация Kimura – Takemoto используется для
описания протяженности атрофических изменений в
желудке. Для постановки диагноза хронического
гастрита, а также с целью стратификации риска рака
желудка и определения дальнейшей тактики пациентам
необходимо выполнить мультифокальную биопсию по
системе OLGA (Operative Link for Gastritis
Assessment) [26–31]. Согласно данному подходу два
биоптата забираются из антрального отдела, два —
из тела и один — из угла желудка. Дополнительная
биопсия выполняется из антрального отдела желудка
для проведения быстрого уреазного теста с целью
выявления H. pylori. Эндоскопическая
классификация Kimura — Takemoto и методология
забора биоптатов по системе OLGA представлены на
рисунке [26].
Рисунок. Эндоскопическая классификация
атрофического гастрита Kimura – Takemoto и
методология забора биоптатов для гистологического
исследования по системе OLGA
Figure. Kimura-Takemoto endoscopic
classification of atrophic gastritis and
methodology of biopsy sampling for histological
examination according to the OLGA system
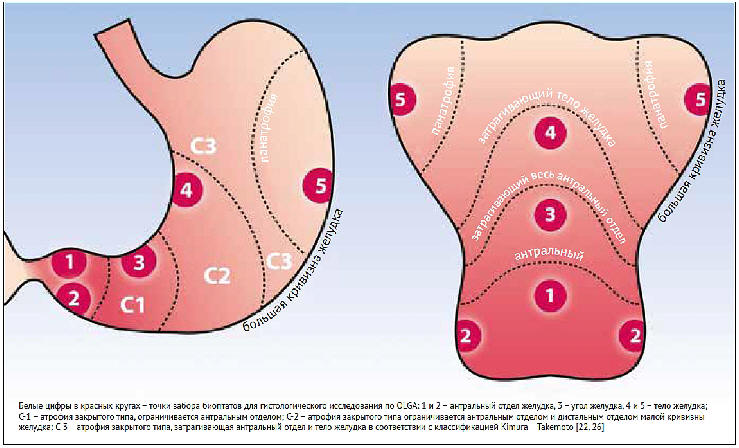
У пациентов с хроническим гастритом в
клинической практике могут проводиться следующие
лабораторно-инструментальные исследования:
клинический анализ крови, биохимический анализ
крови, определение железа сыворотки, ферритина,
витамина В12, фолиевой кислоты,
диагностика H. pylori (неинвазивная: 13С-уреазный
дыхательный тест, определение антигена H. pylori в
кале, определение антител к H. pylori в крови;
инвазивная: уреазный тест с биоптатом);
ультразвуковое исследование брюшной полости;
анализ кала на скрытую кровь; определение уровня
пепсиногена I, пепсиногена II, гастрина-17,
антител к париетальным клеткам и внутреннему
фактору Касла; суточная рН-импедансометрия верхних
отделов ЖКТ, рентген желудка с барием [5, 6].
ОПРЕДЕЛЕНИЕ, ЭПИДЕМИОЛОГИЯ, ПАТОФИЗИОЛОГИЯ
ФУНКЦИОНАЛЬНОЙ ДИСПЕПСИИ
В отличие от хронического гастрита функциональная
диспепсия является клиническим диагнозом, который
отражает наличие у больного определенного
симптомокомплекса [32, 33]. Ключевой
согласительный документ по диагностике и терапии
данного заболевания – Римские критерии IV от 2016
г. [32]. Расширение представления о возможных
клинических сочетаниях принято в ходе
согласительного совещания Европейского общества
нейрогастроэнтерологии и моторики по
функциональной диспепсии 2020 г. Диспепсические
симптомы часто сочетаются с симптомами вздутия в
верхней части живота, тошнотой и отрыжкой (уровень
согласия: 98%, А). При этом вздутие или заметное
растяжение верхней части живота являются
проявлениями симптомов диспепсии (уровень
согласия: 61%, В). Типичные рефлюксные симптомы
(изжога и регургитация) часто сочетаются с
диспепсией [34].
Согласно Римским критериям IV, функциональная
диспепсия диагностируется при наличии одного или
более симптомов – боли или жжение в эпигастрии,
чувство переполнения или раннего насыщения при
отсутствии органических заболеваний, которые могли
бы объяснить данную симптоматику. Симптомы должны
присутствовать в течение последних 3 мес. при
общей продолжительности существования по крайней
мере 6 мес. Частота симптомов должна быть три раза
в неделю и более для чувства переполнения и
раннего насыщения и один раз в неделю и более для
боли и эпигастрального жжения [32–34].
Выделяют два типа функциональной диспепсии в
зависимости от имеющихся клинических жалоб –
синдром эпигастральной боли и постпрандиальный
дистресс-синдром [32–37]. Классификация
функциональной диспепсии представлена в табл. 2.
Таблица 2. Классификация
функциональной диспепсии
| Тип функциональной диспепсии |
Характерные жалобы | Частота жалоб, необходимая для постановки диагноза |
|---|---|---|
| Синдром эпигастральной боли | Боль в подложечной области до или после еды. Жжение в подложечной области до или после еды |
≥1 раза в неделю |
| Постпрандиальный дистресс-синдром |
Чувство переполнения в животе после еды. Чувство раннего насыщения, нежелания больше есть, возникающее во время еды |
≥1 раза в неделю |
| Симптомы присутствуют в течение последних 3 мес. при общей продолжительности существования не менее 6 мес. У пациента отсутствуют органические заболевания, которые могут обуславливать присутствие диспепсического синдрома |
||
В основе патогенеза функциональной диспепсии лежат
процессы, не ассоциированные с воспалением на
уровне слизистой желудка: нарушение моторики
верхних отделов ЖКТ (замедление или ускорение
эвакуаторной функции, нарушение адаптивной
релаксации дна желудка), субклиническое воспаление
в слизистой желудка, эозинофилия, нарушение
выработки пептидных гормонов, висцеральная
гиперчувствительность, хронический стресс и
психологические особенности личности,
патологическое функционирование центральной и
периферической нервной системы, генетические
факторы [35–40].
Согласно Римским критериям IV, симптоматика
функциональных заболеваний ЖКТ может быть легкой,
умеренной или тяжелой. Большинство пациентов с
функциональными заболеваниями, в т. ч.
функциональной диспепсией, имеют легкую и
умеренную симптоматику, которая незначительно
влияет на их социальную активность, однако у
20–25% пациентов имеются выраженные симптомы,
значительно ухудшающие качество жизни.
Функциональная диспепсия у таких пациентов, как
правило, рефрактерна к стандартной соматотропной
терапии, что требует проведения
психофармакотерапии, психотерапевтической или
психиатрической поддержки, но не влияет на
продолжительность жизни [36–39].
Функциональная диспепсия — наиболее
распространенная нозология среди функциональных
расстройств. Согласно данным популяционных
исследований, от 10 до 30% населения имеют жалобы
диспепсического характера, при этом за помощью к
врачу обращается лишь четверть пациентов [34–37].
Для практикующего врача важно, что функциональная
диспепсия – это диагноз исключения. При
консультации пациента, предъявляющего жалобы
диспепсического характера, необходимо
конкретизировать жалобы, собрать подробный
анамнез, провести физикальное и лабораторное
обследования с целью выявления симптомов тревоги:
лихорадки, немотивированного похудания, дисфагии,
рвоты с кровью или черного стула (мелена),
появления алой крови в кале, анемии, лейкоцитоза,
увеличения скорости оседания эритроцитов,
появления симптомов диспепсии у пациентов старше
45 лет, онкологических заболеваний у кровных
родственников [33, 36]. Обнаружение любого из этих
симптомов или наследственная отягощенность делает
диагноз функционального расстройства менее
вероятным и требует тщательного диагностического
поиска с целью исключения серьезного органического
заболевания, в частности злокачественного
новообразования.
В США и странах Западной Европы используется два
подхода к обследованию пациентов с диспепсической
симптоматикой: подход “test and treat”
(лабораторно-инструментальное обследование
больного → диагноз → лечение) и подход “treat and
test” (эмпирической терапии без предварительного
обследования → дообследование при неэффективности
терапии) [41–43].
В соответствии с рекомендациями Российской
гастроэнтерологической ассоциации от 2016 г.
пациентам с впервые возникшими симптомами
диспепсии необходимо обязательное
лабораторно-инструментальное обследование. К
основным методам диагностики относят клинический и
биохимический анализы крови, анализ кала на
скрытую кровь, ЭГДС, ультразвуковое исследование
органов брюшной полости, диагностика
хеликобактерной инфекции [37].
К дополнительным методам диагностики у пациентов с
жалобами диспепсического характера относятся:
рентгенологическое исследование желудка и
12-перстной кишки с барием, суточная
рН-импедансометрия, методы исследования
двигательной функции желудка (сцинтиграфия,
электрогастрография, манометрия желудка),
компьютерная томография [36, 37].
ВЗАИМООТНОШЕНИЕ ДИАГНОЗОВ «ХРОНИЧЕСКИЙ ГАСТРИТ»
И «ФУНКЦИОНАЛЬНАЯ ДИСПЕПСИЯ» В КЛИНИЧЕСКОЙ
ПРАКТИКЕ
Постановка диагноза «хронический гастрит» и/или
«функциональная диспепсия» требует от
практикующего врача достаточного опыта и
клинического мышления. В клинической практике при
обследовании и лечении пациентов с жалобами
диспепсического характера целесообразно
использовать следующую терминологию: диспепсия
неуточненная (на этапе обследования); вторичная
диспепсия (при выявлении органической причины
жалоб); диспепсия, ассоциированная с Н. pylori
(при исчезновении диспепсии после эрадикации
хеликобактера в течение 6 мес.); функциональная
диспепсия (при исключении других причин);
хронический гастрит (при морфологической
верификации диагноза) [4, 36, 37]. Определения и
их клиническая значимость представлены в табл. 3.
Таблица 3. Термины,
используемые в клинической практике и обозначающие
различные варианты диспепсии
| Термин | Определение и клиническая значимость |
|---|---|
| Диспепсия неуточненная | Предварительный диагноз до проведения лабораторного и инструментального обследования, направленного на выявления причины диспепсического синдрома |
| Вторичная диспепсия | Диагностируется у пациентов с органическими заболеваниями верхних отделов ЖКТ, метаболическими или системными заболеваниями, являющимися причиной диспепсического синдрома |
| Диспепсия, ассоциированная с Н. pylori |
Диагностируется у пациента с выявленной хеликобактерной инфекцией. Диагноз пересматривается в динамике и является правомочным в случае купирования диспепсического синдрома в течение 6 мес. после эффективной эрадикации H. pylori |
| Функциональная диспепсия | Диагноз устанавливается при исключении у пациента органических заболеваний верхних отделов ЖКТ, метаболических или системных заболеваний, объясняющих имеющиеся жалобы. Диагноз устанавливается при отрицательном результате обследования на H. pylori. Диагноз устанавливается при сохранении жалоб диспепсического характера через 6 и более месяцев после эффективной эрадикационной терапии |
| Хронический гастрит | Диагноз, устанавливающийся по результатам патоморфологического исследования слизистой оболочки желудка |
В Римских критериях IV пересмотра инфекция
Helicobacter pylori рассматривается в качестве
одной из возможных причин возникновения диспепсии
[29]. Доказательством роли инфекции Н. pylori в
генезе диспепсического синдрома у ряда пациентов
является небольшой, но статистически значимый
положительный эффект от эрадикационной терапии —
купирование симптоматики диспепсии с показателем
number needed to treat (NNT) = 8–14 [44, 45].
Учитывая результаты клинических исследований,
эксперты, принимавшие участие в создании Римских
критериев IV, считают целесообразным проведения
эрадикационной терапии у инфицированных Н.
pylori пациентов с диспепсией, особенно в
случае присутствия синдрома эпигастральной боли
[2, 3, 36, 45-49].
ЛЕЧЕНИЕ ХРОНИЧЕСКОГО ГАСТРИТА И ФУНКЦИОНАЛЬНОЙ
ДИСПЕПСИИ
Лечение пациентов с хроническим гастритом
определяется этиологией, стадией болезни,
особенностями патогенеза и наличием осложнений.
Главная цель лечения — остановка или замедление
прогрессирования атрофических изменений слизистой
оболочки и уменьшение риска развития рака желудка,
что в некоторых случаях достигается за счет
воздействия на этиологические факторы хронического
гастрита [4-6, 10, 11].
Основным эффективным вариантом лечения
хеликобактерного гастрита (90% случаев
хронического гастрита) является 14-дневная
эрадикационная терапия [45].
Этиотропная и патогенетическая терапия
аутоиммунного гастрита (3–5% случаев хронического
гастрита) окончательно не разработана. В случае
присутствия хеликобактерной инфекции пациентам
показана эрадикационная терапия. В ряде работ
исследовалась эффективность и безопасность
ребамипида, малых доз ацетилсалициловой кислоты,
витаминов, обладающих антиоксидантной активностью.
У пациентов с аутоиммунным гастритом может
использоваться симптоматическая терапия (прокинетики,
альгинаты, адсорбенты, УДХК и т. п.); в случае
развития недостаточности витаминов и
микроэлементов назначается витамин D, магний,
кальций, цианокобаламин, препараты железа в
энтеральных и парентеральных формах [10, 48].
При хроническом рефлюкс-ассоциированном гастрите
используются прокинетики, антациды, препараты
урсодезоксихолевой кислоты (УДХК), ингибиторы
протонной помпы (ИПП), сорбенты и гастропротекторы
[12, 49-51].
Лечение пациентов с функциональной диспепсией
включает общие мероприятия по нормализации образа
жизни и питания, применение лекарственных
препаратов, а в ряде случаев и
психотерапевтических методов. В современных
российских и европейских рекомендациях по лечению
функциональной диспепсии, основанных на принципах
доказательной медицины, представлены четыре
фармакотерапевтических подхода [32–37]:
- эрадикация H. pylori;
- антисекреторная терапия;
- прокинетическая терапия;
- психофармакотерапия (антидепрессанты,
анксиолитики).
Выбор варианта лечения определяется типом
функциональной диспепсии. При наличии синдрома
эпигастральной боли препаратами стартового выбора
являются ИПП, в случае постпрандиального
дистресс-синдрома – прокинетики. При двух типах
функциональной диспепсии, а также синдроме
перекреста востребована и комбинированная
кислотосупрессивная и прокинетическая терапия. По
данным S. Chen et al., при функциональной
диспепсии частота ответа на терапию прокинетиками
– 61%, на эрадикационную терапию H. pylori
– 38%, на терапию ИПП – 34% [52]. По данным других
исследователей, показатель NNT для прокинетиков
составляет 4, для антисекреторной терапии – 7, для
эрадикационной терапии – 12 [53–56]. Психотропные
препараты при функциональной диспепсии
рассматриваются в качестве второй линии лечения.
На отечественном рынке используются следующие
препараты, обладающие прокинетическим действием:
метоклопрамид, домперидон, итоприда гидрохлорид и
тримебутина малеат. Фармакологические эффекты
метоклопрамида, итоприда гидрохлорида и
домперидона связаны с блокадой D2-дофаминовых
рецепторов. Антагонисты дофаминовых рецепторов
повышают тонус нижнего пищеводного сфинктера,
усиливают сократительную активность и препятствуют
релаксации желудка, улучшают антродуоденальную
координацию и ускоряют эвакуацию пищи из желудка
[38, 57–59]. Из D2-дофаминоблокаторов в
гастроэнтерологической практике преимущественно
применяется домперидон и итоприда гидрохлорид,
поскольку метоклопрамид проникает через
гематоэнцефалический барьер и вызывает большое
количество побочных эффектов: экстрапирамидные
расстройства, сонливость, беспокойство, депрессию,
эндокринные нарушения – гиперпролактинемию и
галакторею2.
Учитывая результаты проведенных исследований,
пациентам с функциональной диспепсией, как
правило, требуется комбинированная терапия ИПП и
прокинетиками [37, 60]. Использование
фиксированных комбинаций позволяет добиться
предсказуемой клинической эффективности и
безопасности, сделать терапию более рентабельной,
а также повысить комплаентность.
Препарат Омез® ДСР является фиксированной
комбинацией омепразола 20 мг и домперидона 30 мг с
замедленным высвобождением активного вещества3.
Патогенетически использование Омеза ДСР может быть
оправдано у пациентов с различными вариантами
диспепсии, как функционального, так и вторичного
генеза; у пациентов с ГЭРБ, при хроническом
рефлюкс-ассоциированном гастрите. Инновационная
комбинированная лекарственная форма с замедленным
высвобождением обеспечивает оптимальную
эффективность, хороший профиль безопасности,
экономичность и комплаентность к терапии.
Оптимальная эффективность и комплаентность
достигается однократным приемом препарата в
течение суток. Благоприятный уровень безопасности
определяется отсутствием пиковых концентраций
домперидона в плазме крови, возникающих при
использовании классических форм доставки.
Концентрация домперидона в плазме крови на фоне
применения фиксированной комбинации Омез®
ДСР стабильно находится в терапевтическом
коридоре, что минимизирует риски неблагоприятных
сердечно-сосудистых событий4 [61].
КЛИНИЧЕСКИЙ ПРИМЕР
Пациентка 46 лет обратилась на прием с жалобами на
боль, тяжесть и распирание в эпигастрии после еды,
возникающие ежедневно, и тошноту в утренние часы.
Жалобы появились и нарастали в течение последнего
года после перенесенной острой кишечной инфекции,
а также на фоне психоэмоционального напряжения на
работе и нерегулярного режима питания. Пациентка
ранее к врачам не обращалась хронические
заболевания отрицает, не курит, алкогольные
напитки не употребляет. Наследственность не
отягощена. При физикальном обследовании отмечается
необильный беловатый налет на языке.
Пациентке был поставлен предварительный диагноз
«Диспепсия неуточненная». Проведено комплексное
обследование с целью исключения органической
патологии: ЭГДС с биопсией по OLGA, определение
антигенов Н. pylori в стуле, клинический анализ
крови, биохимическое исследование крови (АЛТ, АСТ,
ГГТП, общий билирубин, амилаза, липаза, глюкоза),
ультразвуковое исследование органов брюшной
полости. Клинический и биохимический анализ крови,
УЗИ органов брюшной полости без патологических
отклонений. По данным ЭГДС макроскопические
изменения слизистой не определялись, по
результатам патоморфологического исследования по
системе OLGA выявлялось минимальное воспаление
слизистой 1-й степени и 1-й стадии, локализованное
преимущественно в антральном отделе желудка. В
стуле присутствовал антиген H. pylori.
На основании клинической картины, данных
физикального и лабораторно-инструментального
обследования пациентке был установлен диагноз
«Диспепсия, ассоциированная с инфекцией H.
pylori». Пациентке была проведена 14-дневная
эрадикационная терапия: омепразол 40 мг 2 р/сут,
висмут трикалия дицитрат 240 мг 2 р/сут,
кларитромицин 500 мг 2 р/сут, амоксициллин 1 г 2 р/сут.
Эффективность эрадикационной терапии подтверждена
через 1 мес. после ее завершений –
иммуноферментный анализ кала на антигены H.
pylori отрицательный.
После проведенной эффективной эрадикационной
терапии интенсивность жалоб у пациентки
значительно снизилась, однако через 5,5 мес. на
фоне эмоционального стресса жалобы существенно
усилились – жжение и чувство переполнения в
эпигастрии после еды беспокоят больную ежедневно.
При исследовании стула антигены H. pylori
не определяются. Пациентке установлен диагноз
«Функциональная диспепсия по типу синдрома
эпигастральной боли и постпрандиального
дистресс-синдрома» и назначена терапия препаратом
Омез® ДСР 1 капсула 1 р/сут на
протяжении 4 нед. На 5-й день приема жалобы у
пациентки значительно уменьшились, на 3-й нед.
приема полностью купировались. Побочные эффекты в
процессе терапии не возникали. На фоне
нормализации психологического климата на работе и
в семье жалобы диспепсического характера не
беспокоят в течение 3 мес.
ЗАКЛЮЧЕНИЕ
Распространенность хронического гастрита в
популяции является крайне высокой и коррелирует с
инфицированностью H. pylori; жалобы
диспепсического характера выявляются у 10–30%
населения.
Хронический гастрит, как правило, не имеет
симптоматики и должен диагностироваться при
проведении патоморфологического исследования
слизистой оболочки желудка по системе OLGA.
Следствием длительно протекающего хронического
гастрита являются атрофические, метапластические,
диспластические изменения и опухоли слизистой.
Этиотропная терапия при хроническом гастрите, в
частности эрадикация H. pylori, до развития
атрофии и метаплазии минимизирует риски развития
рака желудка.
Врачам первичного звена, гастроэнтерологам,
эндоскопистам важно диагностировать хронический
гастрит, обращая внимание на проведение не только
эндоскопической, но и мультифокальной биопсии,
выявлять этиологические факторы и воздействовать
на них; осуществлять динамическое наблюдение,
интенсивность которого зависит от исходного
состояния слизистой (атрофия, метаплазия,
дисплазия).
Функциональная диспепсия диагностируется при
исключении у пациента органических заболеваний
верхних отделов ЖКТ, метаболических или системных
заболеваний, объясняющих имеющийся синдром
эпигастральной боли и/или постпрандиальный
дистресс-синдром.
Основной целью терапии функциональной диспепсии
является купирование симптоматики и улучшение
качества жизни пациентов.
Фиксированные комбинации лекарственных препаратов
повышают приверженность лечению, позволяют
оказывать влияние на различные звенья патогенеза
заболевания. Примером рационального сочетания
действующих веществ является Омез® ДСР,
который содержит фиксированную комбинацию
омепразола 20 мг и домперидона 30 мг с замедленным
высвобождением. Омез® ДСР доказал свою
оптимальную эффективность и хороший профиль
безопасности у пациентов с различными вариантами
диспепсического синдрома, включая функциональную и
вторичную по отношению к хроническому гастриту
диспепсию.
Список литературы
- Агеева Л.И., Александрова Г.А., Зайченко
Н.М., Кириллова Г.Н., Леонов С.А., Огрызко Е.В.
и др. Здравоохранение в России. 2019. М.; 2019.
170 с. - Ивашкин В.Т., Маев И.В., Лапина Т.Л.,
Шептулин А.А., Трухманов А.С., Абдулхаков Р.А. и
др. Лечение инфекции Helicobacter pylori:
мейнстрим и инновации (обзор литературы и
резолюция экспертного совета российской
гастроэнтерологической ассоциации 19 мая 2017
г.). Российский журнал гастроэнтерологии,
гепатологии, колопроктологии. 2017;27(4):4—21.
Режим доступа: ht tps://w ww.gastro-j.ru/jour/article/view/164. - Бордин Д.С., Эмбутниекс Ю.В., Вологжанина
Л.Г., Ильчишина Т.А., Войнован И.Н., Сарсенбаева
А.С. и др. Европейский регистр Helicobacter
pylori (Hp-EuReg): как изменилась клиническая
практика в России с 2013 по 2018 г.
Терапевтический архив. 2019;91(2):16–24. ht tps://doi.org/10.26442/00403660.2019.02.000156. - Rugge M., Sugano K., Sacchi D., Sbaraglia
M., Malfertheiner P. Gastritis: An Update in
2020. Curr Treatment Options Gastroenterol.
2020;18(3):488–503. ht tps://doi.org/10.1007/s11938-020-00298-8. - Бордин Д.С., Бакулин И.Г., Березина О.И.,
Быкова С.В., Винницкая Е.В., Гуляев П.В. и др.
Система поддержки принятия врачебных решений.
Гастроэнтерология: клинические протоколы
лечения. М.: НИИОЗММ ДЗМ; 2021. 136 с. Режим
доступа:
https://gastroscan.ru/literature/pdf/klin-prot-moscow-2021.pdf. - Минушкин О.Н. Хронический гастрит:
представления, диагностика, лечебные подходы.
Медицинский совет. 2007;(3):71-76. Режим
доступа: ht tps://cyberleninka.ru/article/n/hronicheskiy-gastrit-predstavleniya-diagnostika-lechebnye-podhody/viewer. - Sugano K., Tack J., Kuipers E.J., Graham
D.Y., El-Omar E.M., Miura S. et al. Kyoto global
consensus report on Helicobacter pylori
gastritis. Gut. 2015;64(9):1353–1367. ht tps://doi.org/10.1136/gutjnl-2015-309252. - Talley N.J. Editorial: moving away from
focussing on gastric pathophysiology in
functional dyspepsia: new insights and
therapeutic implications. Am J Gastroenterol.
2017;112(1):141–144. ht tps://doi.org/10.1038/ajg.2016.519. - Tack J., Talley N.J., Camilleri M., Holtmann
G., Hu P., Malagelada J.-R., Stanghellini V.
Functional gastroduodenal disorders.
Gastroenterology. 2006;130(5):1466–1479. ht tps://doi.org/10.1053/j.gastro.2005.11.059. - Минушкин О.Н., Зверков И.В., Львова Н.В.,
Скибина Ю.С., Иневатова В.С. Хронический
гастрит: современное состояние проблемы.
Терапевтический архив. 2020;92(8):18–23. ht tps://doi.org/10.26442/0040.3660.2020.08.000693. - Ивашкин В.Т., Лапина Т.Л. (ред.).
Гастроэнтерология. М.: ГЭОТАР-Медиа; 2008. 704 c.
Режим доступа: ht tps://bookree.org/reader?file=1348790&pg=0. - Минушкин О.Н., Зверков И.В., Скибина Ю.С.
Некоторые подходы к лечению больных хроническим
(билиарным) рефлюкс-гастритом. Медицинский
алфавит. 2017;19(2):28–31. Режим доступа: ht tps://w
ww.med-alphabet.com/jour/article/view/226/0. - Симаненков В.И., Тихонов С.В., Лищук Н.Б.
Гетерогенность ГЭРБ. Миф или реальность. РМЖ.
2016;(17):1119–1124. Режим доступа: ht tps://w
ww.rmj.ru/articles/gastroenterologiya/Geterogennosty_GERB_Mif_ili_realynosty. - Губергриц Н.Б., Лукашевич Г.М., Фоменко
П.Г., Беляева Н.В. Желчный рефлюкс: современные
теория и практика. М.: Форте принт; 2014. 36 с.
Режим доступа:
https://gastroscan.ru/literature/authors/7640. - Лапина Т.Л., Картавенко И.М., Ивашкин В.Т.
Патогенетическое и терапевтическое значение
желчных кислот при рефлюкс-гастрите. Российский
журнал гастроэнтерологии, гепатологии,
колопроктологии. 2015;(1):86–93. Режим доступа:
https://gastroscan.ru/literature/authors/8840. - Sobola G.M., O’Connor H.J., Dewar E.P., King
R.F., Axon A.T., Dixon M.F. Bile reflux and
intestinal metaplasia in gastric mucosa. J CIin
Pathol. 1993;46(3):235–240. ht tps://doi.org/10.1136/jcp.46.3.235.
- Elhak N.G., Mostafa M., Salah T., Haleem M.
Duodenogastroesophageal reflux: results of
medical treatment and anti-reflux surgery.
Hepatogastroenterology. 2008;55(81):120–126.
Available at: ht tps://pubmed.ncbi.nlm.nih.gov/18507090. - Tack J. Review article: the role of bile and
pepsin in the pathophysiology and treatment of
gastro-oesophageal reflux disease. Aliment
Pharmacol Ther. 2006;24(2):10–16. ht tps://doi.org/10.1111/j.1365-2036.2006.03040.x. - Salomoni M., Zuccato E., Granelli P.,
Montorsi W., Doldi S.B., Germiniani R., Mussini
E. Effect of bile salts on carbonic anhydrase
from rat and human gastric mucosa. Scand J
Gastroenterol. 1989;24(l):28–32. ht tps://doi.org/10.3109/00365528909092235. - Correa P. Human gastric carcinogenesis: a
multistep and multifactorial process — First
American Cancer Society Award Lecture on Cancer
Epidemiology and Prevention. Cancer Res.
1992;52:6735–6740. Available at: ht tps://cancerres.aacrjournals.org/content/52/24/6735.full-text.pdf. - Kapadia C.R. Gastric atrophy, metaplasia and
dysplasia: a clinical perspective. J Clin
Gastroenterol. 2003;36(5):29–36. ht tps://doi.org/10.1097/00004836-2003-05001-00006. - Yue H., Shan L., Bin L. The significance of
OLGA and OLGIM staging systems in the risk
assessment of gastric cancer: a systematic
review and meta-analysis. Gastric Cancer.
2018;21:579–587. ht tps://doi.org/10.1007/s10120-018-0812-3. - Matsuhisa T., Arakawa T., Watanabe T.,
Tokutomi T, Sakurai K., Okamura S. Relation
between bile acid reflux into the stomach and
the risk of atrophic gastritis and intestinal
metaplasia: a multicenter study of 2283 cases.
Dig Endosc. 2013;25(5):519–525. ht tps://doi.org/10.1111/den.12030. - Goo J.J., Choi C.W., Kang D.H., Kim H.-W.,
Park S.B., Cho M. et al. Risk factors associated
with diagnostic discrepancy of gastric
indefinite neoplasia: Who need en bloc resection?
Surg Endosc. 2015;29:3761–3767. ht tps://doi.org/10.1007/s00464-015-4151-8. - Take S., Mizuno M., Ishiki K., Kusumoto C.,
Imada T., Hamada F. et al. Risk of gastric
cancer in the second decade of follow-up after
Helicobacter pylori eradication. J Gastroenterol.
2020;55(3):281–288. ht tps://doi.org/10.1007/s00535-019-01639-w. - Pimentel-Nunes P., Libanio D., Marcos-Pinto
R., Areia M., Leja M., Esposito G. et al.
Management of epithelial precancerous conditions
and lesions in the stomach (MAPS II): European
Society of Gastrointestinal Endoscopy (ESGE),
European Helicobacter and Microbiota Study Group
(EHMSG), European Society of Pathology (ESP),
and Sociedade Portuguesa de Endoscopia Digestiva
(SPED) guideline update 2019. Endoscopy.
2019;51(4):365–388. ht tps://doi.org/10.1055/a-0859-1883. - Kimura K., Takemoto T. An endoscopic
recognition of the atrophic border and its
significance in chronic gastritis. Endoscopy.
1969;1(3):87–97. ht tps://doi.org/10.1055/s-0028-1098086. - Rugge M., Correa P., Di Mario F., El-Omar
E., Fiocca R., Geboes K. et al. OLGA staging for
gastritis: a tutorial. Dig Liver Dis.
2008;40(8):650–658. ht tps://doi.org/10.1016/j.dld.2008.02.030. - Rugge M., Correa P., Dixon M.F., Fiocca R.,
Hattori T., Lechagoet J. et al. Gastric mucosal
atrophy: interobserver consistency using new
criteria for classification and grading. Aliment
Pharmacol Ther. 2002;16(7):1249–1259. ht tps://doi.org/10.1046/j.1365-2036.2002.01301.x. - Rugge M., Sugano K., Scarpignato C., Sacchi
D., Oblitas W.J., Naccarato A.G. Gastric cancer
prevention targeted on risk assessment:
gastritis OLGA staging. Helicobacter.
2019;24(2):e12571. ht tps://doi.org/10.1111/hel.12571. - Rugge M., Genta R.M., Fassan M., Valentini
E., Coati I., Guzzinati S. et al. OLGA gastritis
staging for the prediction of gastric cancer
risk: a longterm follow-up study of 7436
patients. Am J Gastroenterol.
2018;113(11):1621-1628. ht tps://doi.org/10.1038/s41395-018-0353-8. - Drossman D.A., Hasler W.L. Rome
IV-Functional GI Disorders: Disorders of
Gut-Brain Interaction. Gastroenterology.
2016;150(6):1257–1261. ht tps://doi.org/10.1053/j.gastro.2016.03.035. - Маев И.В., Дичева Д.Т, Щегланова М.П.,
Андреев Д.Н., Заборовский А.В. Функциональная
диспепсия в свете Римских критериев IV
пересмотра (2016 г.). Consilium Medicum.
Гастроэнтерология. 2016;(2):5–10. Режим доступа:
https://gastroscan.ru/literature/authors/10147. -
Wauters L., Dickman R., Drug V., Mulak A., Serra
J., Enck P., Tack J. and the ESNM FD consensus
group. United European Gastroenterology (UEG)
and European Society for Neurogastroenterology
and Motility (ESNM) consensus on functional
dyspepsia. United European Gastroenterol J.
2021;9(3):307–331. ht tps://doi.org/10.1002/ueg2.12061. - Stanghellini V., Chan F.K., Hasler W.L.,
Malagelada J.R., Suzuki H., Tack J., Talley N.J.
Gastroduodenal Disorders. Gastroenterology.
2016;150(6): 1380–1392. ht tps://doi.org/10.1053/j.gastro.2016.02.011. - Drossman D.A. Functional Gastrointestinal
Disorders: History, Pathophysiplogy, Clinical
Features, and Rome IV. Gastroenterology.
2016;150(6):1262–1279. ht tps://doi.org/10.1053/j.gastro.2016.02.032. -
Ивашкин В.Т., Маев И.В., Шептулин А.А., Лапина
Т.Л., Трухманов А.С., Картавенко И.М. и др.
Клинические рекомендации Российской
гастроэнтерологической ассоциации по диагностике
и лечению функциональной диспепсии. Российский
журнал гастроэнтерологии, гепатологии,
колопроктологии. 2017;27(1):50–61. Режим
доступа: ht tps://w ww.gastro-j.ru/jour/article/view/123/98. - El-Serag H.B., Talley N.J. Health-related
quality of life in functional dyspepsia. Aliment
Pharmacol Ther. 2003;18(4):387–393. ht tps://doi.org/10.1046/j.1365-2036.2003.01706.x. - Talley N.J. Editorial: moving away from
focussing on gastric pathophysiology in
functional dyspepsia: new insights and
therapeutic implications. Am J Gastroenterol.
2017;112(1):141–144. ht tps://doi.org/10.1038/ajg.2016.519. - Miwa H., Oshima T., Tomita T., Fukui H.,
Kondo T., Yamasaki T., Watari J. Recent
understanding of the pathophysiology of
functional dyspepsia: role of the duodenum as
the pathogenic center. J Gastroenterol.
2019;54(4):305–311. ht tps://doi.org/10.1007/s00535-019-01550-4 - Janssen M., Laheij R.J.F., De Boer W.,
Jansen, J. Test first or treat first? A
randomized comparison of treatment strategies
for dyspepsia. European Journal of
Gastroenterology & Hepatology.
2007;19(10):A55–A56. Available at: ht tps://w
ww.researchgate.net/publication/296112584_Test_first_or_treat_first_A_randomized_comparison_of_treatment_strategies_for_dyspepsia. - Delaney B.C. Dyspepsia management in the
millennium: to test and treat or not? Gut.
2003;52(1):10–11. ht tps://doi.org/10.1136/gut.52.1.10. - Talley N.J., Ford A.C. Functional Dyspepsia.
N Engl J Med. 2015;373(19):1853–1863. ht tps://doi.org/10.1056/NEJMra1501505. - Маев И.В., Самсонов А.А., Андреев Д.Н.
Инфекция Helicobacter pylori. M.: ГЭОТАР-Медиа;
2016. 256 с. Режим доступа: ht tp://i.uran.ru/webcab/system/
files/bookspdf/infekciya-helicobacter-pylori/infekciya.pdf. -
Malfertheiner P., Megraud F., O’Morain C.A.,
Gisbert J.P., Kuipers E.J., Axon A.T. et al.
Management of Helicobacter pylori infection –
the Maastricht V/Florence consensus report. Gut.
2017;66(1):6–30. ht tps://doi.org/10.1136/gutjnl-2016-312288. - Zhao B., Zhao J., Cheng W.F., Shi W.J., Liu
W., Pan X.-L., Zhang G.-X. Efficacy of
Helicobacter pylori eradication therapy on
functional dyspepsia: a meta-analysis of
randomized controlled studies with 12-month
followup. J Clin Gastroenterol.
2014;48(3):241–247. ht tps://doi.org/10.1097/
MCG.0b013e31829f2e25. -
Malfertheiner P., Megraud F., O’Morain C.A.,
Atherton J., Axon A.T., Bazzoli F. et al.
Management of Helicobacter pylori infection –
the Maastricht IV/ Florence Consensus Report.
Gut. 2012;61(5):646–664. ht tps://doi.org/10.1136/gutjnl-2012-302084. - Lahner E., Zagari R.M., Zullo A., Sabatino
A.D., Meggio A., Cesaro P. Chronic atrophic
gastritis: Natural history, diagnosis and
therapeutic management. A position paper by the
Italian Society of Hospital Gastroenterologists
and Digestive Endoscopists [AIGO], the Italian
Society of Digestive Endoscopy [SIED], the
Italian Society of Gastroenterology [SIGE], and
the Italian Society of Internal Medicine [SIMI].
Dig Liver Dis. 2019;51(12):1621–1632. ht tps://doi.org/10.1016/j.dld.2019.09.016. - Chen H., Li X., Ge Z., Gao Y., Chen X., Cui
Y. Rabeprazole combined with hydrotalcite is
effective for patients with bile reflux
gastritis after cholecystectomy. Can J
Gastroenterol. 2010;24(3):197–201. ht tps://doi.org/10.1155/2010/846353. - Thao T.D., Ryu H.C., Yoo S.H., Rhee D.K.
Antibacterial and anti-atrophic effects of a
highly soluble, acid stable UDCA formula in
Helicobacter pylori-induced gastritis. Biochem
Pharmacol. 2008;75(11):2135–2146. ht tps://doi.org/10.1016/j.bcp.2008.03.008. -
Лищук Н.Б., Симаненков В.И., Тихонов С.В.
Дифференцированная терапия «некислых» форм
гастроэзофагеальной рефлюксной болезни.
Терапевтический архив. 2017;89(4):57–63. ht tps://doi.org/10.17116/terarkh201789457-
63. - Chen S.L. A review of drug therapy for
functional dyspepsia. J Dig Dis.
2013;14(12):623–625. ht tps://doi.org/10.17116/terarkh201789457-63.10.1111/1751-2980.12094. - Moayyedi P., Soo S., Deeks J., Forman D.,
Harris A., Innes M., Delaney B. Systemic review:
Antacids, H2-receptor antagonists, prokinetiks,
bismuth and sucralfate therapy for non-ulcer
dyspepsia. Aliment Pharmacol Ther.
2003;17(10):1215—1227. ht tps://doi.org/10.17116/terarkh201789457-63.10.1046/j.1365-2036.2003.01575.x. - Moayyedi P., Deeks J., Talley N.J., Delaney
B., Forman D. An update of the Cochrane
systematic review of Helicobacter pylori
eradication therapy in nonulcer dyspepsia:
resolving the discrepance between systematic
reviews. Am J Gastroenterol.
2003;98(12):2621–2626. ht tps://doi.org/10.1111/j.1572-0241.2003.08724.x. - Moayyedi P., Delaney B.C., Vakil N., Forman
D., Talley N. The efficacy of proton pump
inhibitors in non-ulcer dyspepsia: a systematic
review and economic analysis. Gastroenterology.
2004;127(5):1329–1337. ht tps://doi.org/10.1053/j.gastro.2004.08.026. - Veldhuyzen van Zanten S. J., Jones M. J.,
Verlinden M., Talley N. J. Efficacy of cisapride
and domperidone in functional dyspepsia: a
meta-analysis. Am J Gastoenterol.
2001;96(3):689–696. Available at: ht tps://pubmed.ncbi.nlm.nih.gov/11280535. - Лазебник Л.Б., Алексеенко С.А., Лялюкова
Е.А., Самсонов А.А., Бордин Д.С. и др.
Рекомендации по ведению первичных пациентов с
симптомами диспепсии. Терапия. 2019;(3):12–18.
ht tps://doi.org/10.18565/therapy.2019.3.12-18. - Карева Е.Н., Сереброва С.Ю. Медикаментозное
лечение нарушений моторики желудка. Проблемы,
пути решения, достижения (обзор литературы).
Экспериментальная и клиническая
гастроэнтерология. 2017;(7):167–183. Режим
доступа: ht tps://w ww.nogr.org/jour/article/view/469. - Huang X., Lv B., Zhang S., Fan Y.-H., Meng
L.-N. Itopride therapy for functional dyspepsia:
a meta-analysis. World J Gastroenterol.
2012;18(48):7371–7377. ht tps://doi.org/10.3748/wjg.v18.i48.7371. - Маев И.В., Андреев Д.Н., Дичева Д.Т.
Кислотозависимые заболевания. М.: Ремедиум;
2020. 88 с. Режим доступа: ht tps://remedium.ru/doctor/gastroenterology/kislotozavisimye-zabolevaniya/?view_result=Y.
- Arana A., Johannes C.B., McQuay L.J.,
Varas-Lorenzo C., Fife D., Rothman K.J. Risk of
Out-of-Hospital Sudden Cardiac Death in Users of
Domperidone, Proton Pump Inhibitors, or
Metoclopramide: A Population-Based Nested
Case-Control Study. Drug Saf.
2015;38(12):1187–1199. ht tps://doi.org/10.1007/s40264-015-0338-0.
Статья опубликована на сайте
http://www.gastroscan.ru
материал MedLinks.ru







