Введение
Везикоамниальное шунтирование является наиболее часто используемым методом внутриутробной коррекции обструкции мочевыводящих путей у плода. Данное оперативное вмешательство заключается в установке стента с фиксаторами под контролем ультразвукового исследования (УЗИ) и местной анестезией. Дистальный конец стента должен находиться в амниотической полости, а проксимальный конец — в лоханке почки, чтобы обеспечить адекватный дренаж мочи плода [1].
Обструкция нижних мочевыводящих путей (НМВП) включает гетерогенную группу заболеваний, которые проявляются сходными пренатальными ультразвуковыми данными: расширением задней части уретры, мегацистисом, гидронефрозом, маловодием [2]. Обструкция НМВП может сформироваться из-за врожденного клапана задней уретры (63%), атрезии уретры (17%) и других причин. Этим патологиям чаще подвержены плоды мужского пола, тогда как у плодов женского пола при УЗ-диагностике чаще обнаруживаются более комплексные патологии (персистирующая клоака или микроколон-мегацистис-гипоперистальтический синдром) [3, 4].
Клапан задней уретры — наиболее распространенная причина инфравезикальной обструкции. Это врожденные аномальные складки слизистой оболочки в виде мембран, которые образуются в простатическом отделе мочеиспускательного канала и способствуют нарушению оттока мочи из мочевого пузыря. Данная аномалия встречается преимущественно у мальчиков, однако описаны единичные случаи у девочек. Клапан задней уретры при УЗ-скрининге плодов выявляется с частотой 1:1250. До 46% плодов с клапаном задней уретры погибают до рождения [5]. Более тяжелые формы выявляются на ранних сроках беременности, в то время как легкие формы обычно обнаруживаются позже, в детском возрасте, чаще всего при появлении симптомов обструкции НМВП. Дисфункция мочевого пузыря сопровождает данное заболевание в 55% случаев и ассоциируется с недержанием мочи [6].
Лечение клапана задней уретры не ограничивается только устранением обструкции, а включает в себя также профилактику и лечение дисфункции мочевого пузыря. Со временем уродинамические паттерны могут меняться от детрузорной гиперактивности к снижению функции, уменьшению емкости мочевого пузыря, миогенной недостаточности. Раньше у пациентов с клапаном задней уретры применялся агрессивный хирургический подход, и резекция клапана считалась экстренной процедурой. С развитием хирургии плода стала возможным внутри-утробная коррекция данной патологии, с применением фетальной цистоскопии и пузырно-амниотического шунтирования [6].
Обструкция НМВП может быть обнаружена уже в конце I и начале II триместра беременности во время проведения УЗИ [2]. Критериями для установления данного диагноза являются: растянутый мочевой пузырь с утолщенными стенками, двусторонний гидронефроз и мегауретер, выраженное маловодие. При наличии заднего уретрального клапана в области шейки мочевого пузыря и проксимальной части мочеиспускательного канала будет определяться расширение — симптом «замочной скважины» [7]. Чувствительность пренатального УЗИ для диагностики обструкции НМВП составляет 57–66% [8]. Также для диагностики данной патологии может быть использована магнитно-резонансная томография (МРТ) [2]. Пренатальная МРТ у плодов женского пола может помочь в выявлении микроколона, расширенного пищевода или признаков микроколон-мегацистис-гипоперистальтического синдрома [9].
Прогноз при врожденной обструкции НМВП зависит от основной патологии, тяжести обструкции, хромосомных и других сопутствующих структурных аномалий [10]. Для генетической оценки необходимо проведение инвазивного пренатального диагностического обследования.
Наибольшую пользу внутриутробная коррекция дает плодам с изолированной пренатально подтвержденной обструкцией НМВП, с маловодием на ранних сроках беременности, но с обратимой функцией почек [2]. Учитывая тяжесть порока, в отсутствие своевременного лечения обструкции НМВП у плода перинатальная смертность, по некоторым данным, может достигать 46% [11]. Оперативное вмешательство может помочь в коррекции обструкции, но для этого требуется тщательный отбор пациентов. УЗ-признаки (уменьшение объема амниотической жидкости, состояние паренхимы почек плода), а также биохимические показатели мочи плода, такие как натрий, хлор и β2-микроглобулин, могут быть использованы для прогнозирования исходов [12].
Методы фетальной коррекции обструкции НМВП у плода
Проведенный анализ литературы показал, что для внутриутробной хирургической коррекции обструкции НМВП у плода могут проводиться везикоамниальное шунтирование и цистоскопия. Везикоамниальное шунтирование является более признанным основным методом лечения.
Установка везикоамниального шунта была впервые описана в 1980-х годах Чарльзом Родеком как процедура, которая позволяет свободно выводить мочу плода из мочевого пузыря (с обструкцией шейки), чтобы снизить давление в мочевой системе и защитить почки от повреждения [2]. Описанные в литературе исследования показывают, что данное оперативное вмешательство увеличивает перинатальную выживаемость у плодов с обструкцией НМВП по сравнению с консервативным лечением [13]. В метаанализе, проведенном в 2020 г., выживаемость была выше в группе с проведенным везикоамниальным шунтированием (57,1%) по сравнению с группой без оперативного вмешательства (38,8%) [14]. Доказано, что раннее шунтирование (до 16 нед. беременности) улучшает долгосрочную функцию почек у плодов с инфравезикальной обструкцией [15].
Фетальная цистоскопия позволяет поставить точный диагноз и выполнить операцию за один сеанс без необходимости амниоинфузии. В ретроспективном анализе R. Ruano et al. [16] наблюдалось 111 мальчиков с предполагаемой пренатальной обструкцией НМВП. В 34 случаях пренатально была проведена фетальная цистоскопия, в 16 — установлен везикоамниальный шунт, в 61 случае (контрольная группа) пренатальная коррекция порока не проводилась. В результате было выявлено, что оба вмешательства улучшили выживаемость по сравнению с контрольной группой. Цистоскопия показала тенденцию к улучшению долгосрочной функции почек, чего не наблюдалось в группе шунтирования. Миграция шунта произошла у 31,3%, формирование уретроректального свища — у 8,8% после цистоскопии.
Везикоамниальное шунтирование и фетальная цистоскопия имеют свои преимущества и недостатки в лечении обструкции НМВП у плода (табл. 1) [17].
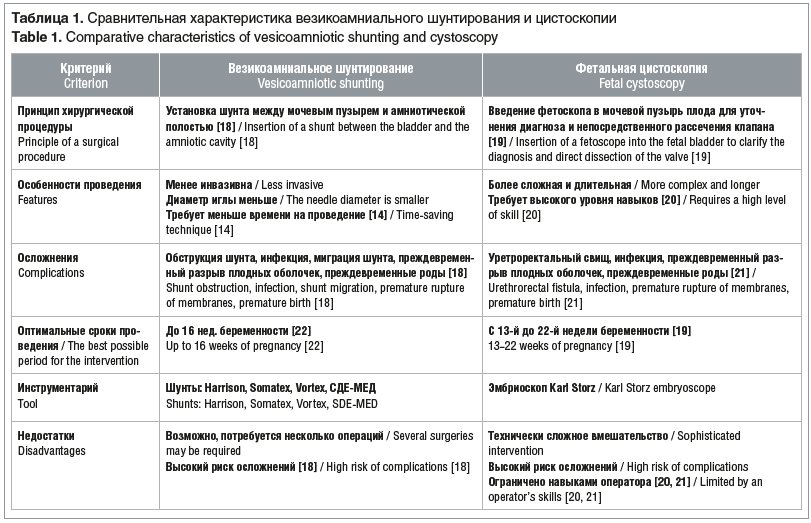
Для проведения везикоамниального шунтирования возможно использование различных типов шунтов.
Варианты шунтов
Шунт Somatex (Германия) имеет длину 22 мм и диаметр 1,2 мм (рис. 1). Состоит из нитиноловой проволочной сетки и внутреннего непроницаемого силиконового покрытия. Шунт имеет самораскрывающиеся зонтики на обоих концах и может быть введен через внутривенный катетер с инъекционным портом G18 (внешний диаметр 1,27 мм) без необходимости анестезии. Так как стент предварительно установлен в канюлю, во время процедуры невозможно получить образцы мочи плода [18].

В исследовании, проведенном B. Strizek et al. [23], 10 пациенткам до 14 нед. беременности было проведено везикоамниальное шунтирование с использованием данного шунта. Медиана гестационного возраста на момент постановки диагноза составила 12,9 нед. Шунтирование проводилось при медиане гестационного возраста 13,3 (12,6–13,9) нед. Размещение шунта было технически успешным во всех 10 случаях. В 1 случае исход беременности остался неизвестен. В 2 случаях произошло прерывание беременности. Семь (70%) плодов родились живыми, при среднем сроке беременности 35,1 (31–39) нед. Неонатальная выживаемость среди живорожденных детей составила 85,7% (1 из 7 новорожденных умер от гипоплазии легких в первый день жизни). Среди 6 выживших детей только у 1 недоношенного новорожденного были признаки незначительной гипоплазии легких. Функция почек оказалась сохранной в неонатальном периоде у всех выживших новорожденных. У новорожденного, умершего от гипоплазии легких, на основании сонографических данных об ангидрамнионе и кистозной дисплазии почек выставлен диагноз внутри-утробной почечной недостаточности. Из 10 установленных шунтов в 4 (40%) случаях произошла их миграция, во всех случаях стент был установлен повторно.
В исследовании I. Gottschalk et al. [24] был проведен ретроспективный анализ 46 случаев везикоамниального шунтирования у плодов с мегацистисом. Авторы выделяли раннюю группу (гестационный возраст до 14+0 нед.), промежуточную группу (гестационный возраст между 14+1 и 17+0 нед.) и позднюю группу (гестационный возраст после 17+0 нед.). Технически успешная первая процедура была проведена в 43 (93,5%) случаях. Такие осложнения шунтирования, как самопроизвольная миграция и экспульсия шунта в брюшную полость плода, возникли в 10 (21,7%) случаях при среднем сроке беременности 28 (17–31) нед. Если миграция произошла в брюшную полость, то в брюшную стенку плода устанавливали дополнительный шунт для дренирования мочевого асцита. Травмы плода из-за самого шунта произошли еще в 2 (4,3%) случаях и включали перфорацию кишечника смещенным шунтом и небольшой дефект брюшной стенки с выпадением сальника в месте установки шунта. Таким образом, вероятность неудачной первой процедуры шунтирования в когорте составила 6,5%, а необходимость 2-го и 3-го вмешательства из-за спонтанной миграции шунта составила 19,5 и 2,2% соответственно. Спонтанной внутриутробной гибели плода выявлено не было. Семь (15,2%) беременностей были прерваны. Четверо (8,7%) живорожденных умерли в неонатальном периоде: 2 из них родились на 23-й и 29-й неделях гестации и умерли после паллиативной помощи в течение первых 10 ч жизни, 1 умер от гипоплазии легких на 8-й день жизни, еще 1 — на 9-й день от уремического перикардита. Еще 1 ребенок мужского пола умер от последствий гипоплазии легких в возрасте 2,5 мес. У него был изолированный мегацистис, и ему было проведено раннее шунтирование. Выжили 32 младенца. Среди 39 живорожденных детей 32 (82%) имели достаточную функцию почек без необходимости немедленного диализа после рождения. Двое (5,1%) детей родились с бессимптомной легкой хронической почечной недостаточностью без необходимости проведения диализа при последнем наблюдении в среднем возрасте 3,6 года, а 4 (10,3%) ребенка родились с почечной недостаточностью. Среди них одному ребенку потребовалась трансплантация почки после первого года жизни с хорошо функционирующим трансплантатом при последнем наблюдении через 2 года, а остальные трое находились на хроническом диализе в среднем возрасте 1,5 года жизни. Функция почек была лучше после раннего шунтирования, поскольку у всех детей с нарушением функции почек было либо промежуточное, либо позднее оперативное вмешательство. Значительный гидронефроз или мегауретеры диагностированы в 14 случаях, кистозно-диспластические почки — в 7, уринома — в 5, значительная гипоплазия почки — в 4 и односторонняя агенезия почки — в 3 случаях. Размер и функция легких при рождении были адекватными у 37 (94,9%) из 39 живорожденных, без необходимости механической респираторной поддержки. У 2 (5,1%) детей наблюдались гипоплазия легких и фатальная дыхательная недостаточность. Размер и функция легких не различались между подгруппами с ранним, промежуточным и поздним везикоамниальным шунтированием [24].
В исследовании B. Strizek et al. [25] был проведен ретроспективный анализ 33 случаев шунтирования мочевого пузыря при среднем сроке беременности 15+1 (от 12+4 до 16+6) нед. У 25 плодов имелся симптом «замочной скважины». До оперативной коррекции порока в 18 (54,5%) случаях определялся нормальный объем околоплодных вод. Проведено 4 (12,2%) прерывания беременности, 1 (3,3%) внутриутробная гибель плода на сроке 17+4 нед. Прерывание беременности выполнялось по поводу сопутствующих пороков развития, выявленных на более поздних сроках беременности, осложнений шунтирования (амниоинфузия при преждевременном отхождении околоплодных вод), наличия признаков тяжелой дисплазии почек во время беременности. Маловодие после 27 нед. зарегистрировано у 11 (39,3%) пациентов. Миграция шунта произошла у 12 (36,4%) из 33 пациентов при среднем сроке беременности 25+6 (15+2–37+4) нед. Двадцать восемь (84,8%) новорожденных родились живыми при среднем сроке беременности 36+0 (31+0–41+0) нед. Преждевременных родов до 37+0 нед. было 15 (53,6%). В 1 (3,6%) случае зафиксирована неонатальная смерть вследствие гипоплазии легких. Неблагоприятный исход (прерывание беременности, внутриутробная смерть, неонатальная смерть) зафиксирован в 6 (18,2%) беременностях. После исключения прерывания беременностей перинатальная выживаемость составила 93,1% (27/29). На момент последнего контрольного обследования 68% (17/25) пациентов (средний возраст 2,9 (1,4–4,7) года имели нормальную функцию почек. У 2 детей наблюдалась легкая, а у 6 — тяжелая почечная недостаточность или терминальная стадия почечной недостаточности [25].
Шунт Harrison (США) представляет собой стент с двойным пигтейлом (double pigtail), внешним диаметром 1,67 мм, внутренним диаметром 0,97 мм (рис. 2). Длина между пигтейлами 15–35 мм. Его вводят через внутривенную канюлю 13G.

В работе [25] представлен ретроспективный анализ 24 случаев проведения везикоамниального шунтирования, с применением данного стента, при среднем сроке беременности 14+4 (13+1–16+6) нед. У 13 плодов присутствовал симптом «замочной скважины». Количество околоплодных вод до внутриутробной коррекции было нормальным в 10 (41%) случаях. Зарегистрировано 4 (16,7%) выкидыша и внутриутробной гибели плода и 8 (33,3%) прерываний беременности. Причины прерывания беременности были связанны с шунтированием у 7 из 8 пациенток. У одной пациентки прерывание беременности проведено из-за сопутствующих пороков развития, обнаруженных на более поздних сроках беременности. Миграция шунта произошла у 21 (87,5%) пациентки со средним интервалом 20,6 (1–111) дня. Повторное вмешательство выполнено у 8 (33,3%) из 24 пациенток. Среднее количество шунтов на 1 плод составило 1,6, при этом у 1 пациента было максимум 4 шунта. 12 (50%) детей родились живыми. Было зарегистрировано 3 случая неонатальной смерти из-за легочной гипоплазии: 1 случай у ребенка, родившегося недоношенным на сроке 27 нед. Неблагоприятный исход (прерывание беременности, выкидыш, внутриутробная гибель, неонатальная смерть) имел место у 12 (50%) пациенток. Общая перинатальная выживаемость составила 37,5% (9/24) и 75% (9/12) после исключения прерываний беременности [25].
Шунт Vortex разработан врачами детской больницы Люсиль Паккард при Стэнфордском университете (рис. 3).

Он включает несколько инновационных особенностей, предназначенных для повышения эффективности и улучшения исходов лечения. Внутренний виток из нитинола обеспечивает динамическую регулировку и сопротивление перегибу, что особенно важно по мере роста и изменения положения плода. Плетеные элементы фиксации гарантируют надежное прикрепление к мочевому пузырю плода, значительно снижая риск смещения шунта. Клапан «утиный клюв» с обратным оттоком позволяет периодически опорожнять мочевой пузырь, что помогает сохранить его функцию, предотвращая постоянное дренирование и возможное чрезмерное опорожнение. Система установки шунта позволяет при необходимости изменить его положение и извлечь, что минимизирует необходимость во множественных внутриутробных процедурах и, таким образом, снижает риск преждевременных родов. В настоящее время проведены исследования на животных (овцах), которые показали жизнеспособность и эффективность шунта Vortex [26]. В этих исследованиях шунт успешно устанавливался и оставался на месте без смещений и перегибов в течение как минимум 24 ч после установки (4/4, 100%). Эти результаты наблюдались наряду с уменьшением маловодия и мочевого асцита [26]. Исследований у людей не проводилось.
Шунт Rocket представляет собой стент длиной 2 мм с двойным хвостиком (twin pigtail) с внешним диаметром 1,65 мм, внутренним диаметром 1,2 мм (рис. 4).

В литературе имеются исследования R. Ruano et al. [16, 17], в которых описываются осложнения и выживаемость при установке двух шунтов в совокупности — Harrison и Rocket. При этом разделение исследуемых на группы по виду установленного шунта не проводилось. Данный шунт не использовался в течение последних двух лет из-за тяжелых осложнений, связанных с его установкой, таких как перфорация передней брюшной стенки и гастрошизис.
Почечный стент «СДЕ-МЕД» изготовлен из силиконовой ренттено-контрастной резины, с диаметром 3,0 Fr (рис. 5). Длина рабочей части стента 49 мм, диаметр рабочей части 15G. С 2015 г. включен в клиническую практику ФГБУ «НИИ ОММ» Минздрава России [27–29]. Стент имеет оригинальную форму пигтейлов, что позволяет автоматически включиться механизмам фиксации при установке в рабочую зону и, следовательно, уменьшить частоту экспульсии стента.
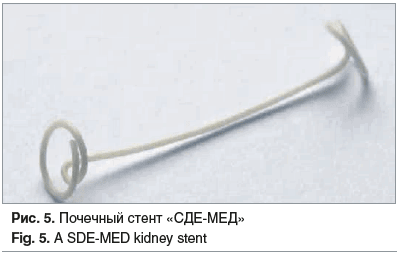
Данный стент применяется в основном для проведения нефроамниального шунтирования (проведено 156 процедур) по методике, разработанной в ФГБУ «НИИ ОММ» Минздрава России. В период с 2010 по 2024 г. проведено 10 внутриутробных везикоамниальных шунтирований беременным с диагностированной обструкцией НМВП у плода (рис. 6). У всех беременных с данной патологией у плода был проведен пренатальный консилиум. Учитывая тяжесть порока, предлагалось прерывание беременности по медицинским показаниям. Во всех случаях семья приняла решение о пролонгировании беременности.
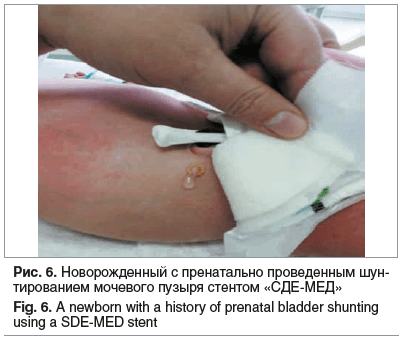
Срок беременности при поступлении в стационар с данной патологией составил 25±1,6 нед. Ни в одном случае пациенты не были направлены в 13–14 нед. гестации в стационар 3-го уровня для дообследованная и решения вопроса о применении методов фетальной хирургии. Во всех 10 случаях при поступлении в стационар по данным УЗИ наблюдалось умеренное или абсолютное маловодие, почки имели повышенную эхогенность, в 8 случаях имелись признаки кистозной дисплазии почек. В 9 из 10 случаев у пациенток не было расширения чашечно-лоханочной системы, что определило невозможность установки нефроамниального шунта. Миграция везикоамниального стента произошла у 6 (60%) пациенток со средним интервалом 9 (1–35) дней после первоначального шунтирования и медианным сроком беременности 23,5 (17–26) нед. Во всех случаях было проведено повторное везикоамниальное шунтирование. В 1 случае проведено комбинированное оперативное внутриутробное лечение: везикоамниальное в сроке 18 нед. беременности, с последующим нефроамниальным шунтированием в сроке 25–26 нед. В 1 (10%) случае произошло прерывание беременности с преждевременным излитием околоплодных вод в сроке 22–23 нед. Пренатально у плода выявлены множественные пороки развития: перфорация мочевого пузыря, кистозная дисплазия почек, двусторонний мегауретер, амелия. В 100% дети родились живыми. Средний срок родоразрешения составил 35±6 нед. гестации. В одном случае на 3-и сутки после родоразрешения в сроке 35–36 нед. гестации зарегистрирована нео-натальная смерть. У плода/новорожденного выявлены неиммунная водянка, почечная недостаточность. В данном случае везикоамниальное шунтирование было проведено в сроке 28–29 нед. Общая перинатальная выживаемость составила 90% (8/9). В постнатальном периоде в 2 случаях функция почек осталось сохранной (1 случай с комбинированным шунтированием мочевыделительной системы), 4 детям проведена пересадка почек, а двое детей наблюдаются с хронической почечной недостаточностью, не требующей трансплантации почек (табл. 2).
Заключение
Разнообразные типы шунтов имеют свои особенности, преимущества и риски, которые необходимо учитывать при выборе подходящего метода лечения. Например, шунт Somatex имеет облегченную конструкцию и минимальный диаметр, улучшенный фиксирующий механизм — самораскрывающиеся зонтики на обоих концах и может быть введен через внутривенный катетер с инъекционным портом G18. Шунт Vortex включает несколько инновационных особенностей, предназначенных для повышения эффективности и улучшения исходов лечения, что обеспечивает динамическую регулировку и сопротивление перегибу, плетеные элементы фиксации гарантируют надежную фиксацию в мочевом пузыре. Шунт «СДЕ-МЕД» также имеет оригинальные пигтейлы для надежности установки стента. Применение вышеуказанных вариантов шунтов для коррекции обструкции НМВП у плода дает различный клинический исход у данных пациентов. Наши исследования показывают, что при проведении ранней коррекции данного порока, до 18 нед. беременности, значительно снижается смертность плодов и новорожденных, а также постнатальная заболеваемость. Однако опубликованы лишь отдельные серии наблюдений. Отсутствуют рандомизированные многоцентровые исследования, и, в связи с высокой частотой осложнений, предлагаются новые модификации шунтов. Необходимы дальнейшие исследования в этой когорте пациентов.
Сведения об авторах:
Косовцова Наталья Владимировна — д.м.н., руководитель отдела биофизических методов исследования ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0000-0002-4670-798Х
Федорова Наталья Анатольевна — врач акушер-гинеколог, аспирант ФГБУ «НИИ ОММ» Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 1; ORCID iD 0000-0003-1474-4978
Мамаев Алексей Олегович — студент по специальности «Медицинская биофизика» ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина»; 620062, Россия, г. Екатеринбург, ул. Мира, д. 19.
Контактная информация: Федорова Наталья Анатольевна, e-mail: fedotova.natasha95@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 12.03.2025.
Поступила после рецензирования 04.04.2025.
Принята в печать 29.04.2025.
About the authors:
Nataliya V. Kosovtsova — Dr. Sc. (Med.), Head of the Department of Biophysical Research Methods, Ural Research Institute for Maternal and Infant Health; 1, Repin str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0002-4670-798X
Nataliya A. Fyodorova — Obstetrician&Gynecologist, Postgraduate Student of the Ural Research Institute for Maternal and Infant Health; 1, Repin str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0003-1474-4978
Alexey O. Mamaev — Student specializing in Medical Biophysics, Ural Federal University named after the First President of Russia B.N. Yeltsin; 19, Mira str., Yekaterinburg, 620062, Russian Federation.
Contact information: Nataliya A. Fyodorova, e-mail: fedotova.natasha95@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 12.03.2025.
Revised 04.04.2025.
Accepted 29.04.2025.
Информация с rmj.ru






