Введение
С каждым годом в мире увеличивается число людей с психическими и неврологическими расстройствами. По данным ВОЗ, за 2019 г. выявлено почти 1 млрд случаев психического расстройства у людей, из которых 14% приходилось на подростков1. Среди всех случаев смерти в мире более 1% составляет смертность в результате суицида на фоне психических расстройств.
Психические расстройства являются актуальной проблемой в мире, так как ведут к росту безработицы, инвалидности и преждевременной смертности. Срок жизни у людей с тяжелыми психическими заболеваниями меньше в среднем на 10–20 лет1.
Те или иные психические нарушения, чаще расстройства настроения, поведенческие синдромы и соматоформ-ные расстройства, как правило, сопровождают такие неврологические заболевания, как паркинсонизм и болезнь Альцгеймера. В случаях аутизма нарушения поведения и мышления формируются с раннего детства [1, 2].
В ходе исследований было выявлено, что психические расстройства относятся к многофакторным заболеваниям, их развитие связано не только с генетическими факторами, но и с действием социальной среды [1–4]. Но эти теории не всегда могут объяснить особенности течения заболевания у пациентов. Дальнейшие исследования показали влияние питания на клиническую картину [4]. Вслед за этим были обнаружены взаимосвязи симптоматики психических расстройств и состава микробиоты, включающей условно-патогенные и патогенные бактерии, различные вирусы и грибы, обусловливающие различные инфекционные процессы. На сегодняшний день известно, что нарушения микробиома кишечника (и, возможно, других локализаций) могут оказывать негативное воздействие на центральную нервную систему (ЦНС) и периферическую нервную систему, в том числе при развитии различных инфекционных процессов [4].
Бактерии, составляющие микробиоту кишечника, способны вырабатывать ряд нейромедиаторов, таких как ацетилхолин, катехоламины, γ-аминомасляная кислота (GABA), гистамин, мелатонин и серотонин, которые необходимы для регуляции перистальтики и чувствительности в кишечнике, могут напрямую действовать на блуждающий нерв, который передает информацию о состоянии кишечника в мозг [5]. Исследования показывают, что нарушения соотношений этих веществ могут вызывать тревожность, депрессию и когнитивные нарушения. В исследовании M. Lyte et al. [6] показано, что при острой инфекции, вызванной Campylobacter jejuni, у мышей развивается тревожность уже через несколько часов после введения возбудителя в желудок, еще до формирования клинических симптомов и иммунного ответа, предположительно за счет выброса цитокинов. В дальнейшем было доказано, что введение C. jejuni вызывает активацию вагус-ассоциированного восходящего пути, которая сопровождается активацией многих участков мозга, отвечающих за тревож-ное поведение. Предполагается, что в этом случае можно думать об механизме, созданном в ходе эволюции, цель которого заключается в обнаружении острых изменений в кишечнике нервной системой для быстрого выявления патогена [7, 8].
Другие исследования показывают, что аномальное пищевое поведение сопровождается снижением уровня регуляторного пептида пропиомеланокортина в дуговидном ядре и повышением уровня провоспалительного цитокина фактора некроза опухоли α (TNF-α) в срединном выпячивании гипоталамуса, где гематоэнцефалический барьер более проницаем, чем в других его областях. Нарушенный гематоэнцефалический барьер позволяет метаболитам и малым молекулам из системного кровотока попадать в ЦНС. В экспериментальном моделировании хеликобактерной инфекции были отмечены тревожность и биохимические нарушения у животных, которые сохранялись в течение 2 мес. после элиминации патогена [9, 10]. Биохимические исследования показали, что у зараженных животных отмечаются высокие показатели нейтрофильных факторов роста нервов (NGF) и нейтрофильного фактора мозга (BDNF) с дифференцированной экспрессией множества генов, участвующих во вторичных путях передачи информации, синоптическом долгосрочном усилении в гиппокампе, лобных долях коры и стриатуме [11].
В работах N. Sudo [12] было показано влияние комменсальных бактерий на ЦНС. В эксперименте у гнотобионтных мышей стала проявляться аномальная активность оси гипоталамус — гипофиз — надпочечники (ГГН) с повышенными уровнями адренокортикотропного гормона и кортикостерона в ответ на стресс. Нормализация активности оси ГГН наблюдалась после колонизации животных комменсальными бактериями. При этом у гнотобионтных мышей наблюдались более низкие уровни BDNF в коре и гиппокампе [12].
Эксперименты L.V. Hooper et al. [13] показали взаимо-связь колонизации единственной комменсальной бактерией Bacteroides thetaiotaomicron и изменения экспрессии широкого спектра генов, отвечающих за обмен веществ, проницаемость кишечника и ангиогенез, а также за усвоение глутамата, продукцию GABA и выделение нейротрансмиттеров.
По данным разных источников, практически 100% пациентов с психическими нарушениями имеют разнообразные жалобы на работу желудочно-кишечного тракта (ЖКТ), а при лабораторных исследованиях у них находят проявления дисбиоза [1, 14]. В исследованиях не раз предпринимались попытки выявить специфические для той или иной психоневрологической патологии изменения. Однако результаты были противоречивы. В настоящее время можно однозначно говорить о том, что при психоневрологической патологии в большинстве случаев состав микробиома кишечника отличается от показателей здорового человека. В свою очередь изменения микробиоценоза сопровождаются повышенной продукцией токсинов, которые оказывают негативное воздействие на иммунную систему и мозг, а также провоцируют иммунный ответ и усиливают воспалительный процесс [1, 4, 14].
В настоящее время еще плохо изучена взаимо-связь между представителями микробиома ЖКТ и реакциями ЦНС, однако в ходе клинических исследований было выявлено улучшение психического состояния у пациентов после применении пробиотиков на основе лакто- и бифидобактерий [15–17]. Также было показано, что использование препаратов на основе штаммов Bifidobacterium spp. снижает тревожность и улучшает настроение у пациентов с психиатрической патологией [18]. В то же время штаммы лакто- и бифидобактерий могут существенно отличаться по своим свойствам. В настоящее время наиболее изучены и достоверно безопасны для применения лактобактерии LGG и бифидобактерии BB-12, которые входят в состав биологически активной добавки (БАД) Адиарин® Пробио. LGG и BB-12 являются естественными для организма человека, выделены из фекалий здоровых людей, что объясняет практически полное отсутствие нежелательных действий при их применении.
Для оценки эффективности и безопасности применения LGG проведено более 300 клинический исследований, в том числе 12 — российских. По их результатам и доклинической оценке имеется более 1100 научных публикаций, большинство из которых представлено зарубежными исследователями. Этот штамм устойчив к действию соляной кислоты желудка и желчных кислот, остается жизнеспособным при прохождении через ЖКТ, обладает высокой способностью адгезии к эпителию слизистой оболочки кишечника [19]. В свою очередь ВВ-12 является самым изученным штаммом среди бифидобактерий. Его эффективности и безопасности при применении как у детей, так и у взрослых было посвящено более 130 клинических исследований, из которых 12 проведено в России. Имеется более 300 научных публикаций, в том числе 52 — российских, посвященных особенностям, эффективности и безопасности ВВ-12 [20]. Штамм продуцирует ряд молекул: молочную (лактат) и уксусную (ацетат) кислоты, которые обеспечивают бактерицидные свойства среды. Среди важных отличий отмечается доказанный иммуномодулирующий эффект, который проявляется, в первую очередь, снижением риска пищевой аллергии [20]. При пероральном приеме, так же как и LGG, ВВ-12 не разрушается и сохраняет свои свойства при воздействии соляной кислоты и желчных кислот в ЖКТ.
В исследованиях было доказано, что именно комбинация LGG и BB-12 является рациональной, так как данные штаммы не конкурируют друг с другом, а наоборот, являются синергичными. При сочетании этих штаммов адгезия к клеткам эпителия кишечника нарастает до 39–44% [21, 22]. Как показали исследования, эти микроорганизмы помогают справляться с запорами [23] и сокращают количество случаев диареи, вызванных патогенными организмами [24]. Также сообщалось, что LGG и BB-12 уменьшают воспаление в кишечнике [24]. У пожилых людей, находящихся в специализированных учреждениях, на воспалительные реакции, измеряемые по уровню TNF-α, влияют бифидобактерии в течение 6 мес. потребления [24]. Известно, что комбинация этих бактерий антагонистически действует против большого ряда условно-патогенных и патогенных микроорганизмов, в том числе влияющих на состояние ЦНС.
Одна доза (6 капель) Адиарин® Пробио содержит пробиотические штаммы LGG® и BB-12® в количестве не менее 109 КОЕ бактерий, что достаточно для достижения нужного клинического эффекта без побочных действий при применении 1–2 доз в сутки. Вспомогательными веществами являются масло подсолнечника и α-токоферол, способствующие хорошей переносимости.
Вместе с этим при дисбиотических нарушениях, сопровождающихся диареей и/или рвотой, очевидна необходимость применения регидратационных растворов и цитомукопротекторов для купирования симптоматики.
Исследований по влиянию комбинации лактобактерий LGG и бифидобактерий BB-12 на симптоматику психоневрологической патологии у взрослых пациентов с признаками дисбиоза до настоящего момента не проводили.
Цель исследования: оценить продолжительность и динамику психоневрологических и желудочно-кишечных нарушений у пациентов на фоне добавления к комплексной терапии пробиотического средства, содержащего лактобактерии LGG® и бифидобактерии BB-12®.
Содержание статьи
Материал и методы
В ретроспективное исследование, проведенное в 2024 г. на базе ФБУН МНИИЭМ им. Г.Н. Габричевского Роспотребнадзора, включили 100 пациентов (из них 59 женщин) в возрасте старше 18 лет (от 18 до 95 лет, средний возраст 49±8,6 года) с психоневрологической симптоматикой: с соматоформным расстройством — 37, биполярным расстройством — 9, шизофренией или шизоаффективным расстройством — 12, паркинсонизмом — 35 (в том числе с болезнью Паркинсона — 19), болезнью Альцгеймера — 1, деменцией неуточненной — 2, аутизмом — 4. Пациенты наблюдались амбулаторно, были направлены на консультацию к врачам-терапевтам психиатрами (47) и неврологами (53) для уточнения причин жалоб, характерных для патологии ЖКТ. У 84 пациентов отмечали жалобы на работу ЖКТ: наиболее часто — дискомфорт с периодами болей в животе (78), сопровождающийся запорами (47), диареей (18) или чередованием диареи и запора (9). Реже отмечали плохой аппетит (48), отвращение к рекомендованной пище (21), тошноту (18) с эпизодами рвоты (8), по поводу чего пациенты обращались к гастроэнтерологам, по данным гастроскопии и ультразвукового исследования органов брюшной полости и почек органическая патология, которая могла бы объяснять указанные жалобы, была исключена. Лабораторное подтверждение дисбиотических изменений кишечника микробиологическим методом получено у 100% пациентов, дисбиоз ротоглотки выявлен у 65% пациентов перед началом терапии.
Критерии исключения: онкологические, острые инфекционные и аутоиммунные заболевания, ВИЧ-инфекция, туберкулез; острые и хронические в стадии обострения гастрит, дуоденит, язвенная болезнь желудка и двенадцатиперстной кишки, панкреатит, холецистит; отсутствие подтверждений дисбиотических изменений ротоглотки и/или кишечника по результатам лабораторных исследований; беременность.
После уточнения клинической симптоматики пациенты были разделены методом «случай — контроль» на 2 группы по 50 человек: в основной группе больные получали в течение 21 дня терапию БАД Адиарин® Пробио по 6 капель 2 р/сут или по 12 капель 1 р/сут во время еды. Средство имеет встроенный во флакон дозатор капель, что удобно пациентам с точки зрения ежедневного использования и гигиенично. Кроме того, при рвоте и/или диарее пациентам основной группы рекомендовали принимать цитомукопротектор Адиарин® (желатина таннат) и состав для пероральной регидратации Адиарин®Регидрокомплекс® в соответствии с инструкцией до момента купирования этих симптомов. В группе сравнения пациенты не получали средств линейки Адиарин®.
Пациенты в обеих группах получали лечение в соответствии с Клиническими рекомендациями по основному (психиатрическое или неврологическое заболевание) и сопутствующим заболеваниям. По возрасту, гендерному составу, основному диагнозу и выраженности дисбиотических нарушений группы были сопоставимы.
В период терапии и после него у каждого пациента оценивали динамику психоневрологических симптомов (тревожности и нарушений сна по шкале Гамильтона, продуктивной симптоматики — бреда и галлюцинаций (при наличии) по шкалам SAPS или Янга, способности к самообслуживанию по шкале Бартела, способности к обучению по Монреальской шкале), а также желудочно-кишечных нарушений (болей в животе, вздутия, тошноты, диареи, запоров, плохого аппетита). Для оценки по данным историй болезни были выбраны сроки: 5±1, 10±1, 20±2, 30±3, 60±3, 90±3, 180±10 дней от начала терапии. В большинстве случаев на этих сроках связь с пациентами осуществлялась с помощью телефонного звонка или по видеосвязи, реже были очный амбулаторный прием, консультация на дому или оценка состояния по данным выписки из истории болезни в стационаре. Дополнительно на 180±10 дней оценивали число ОРВИ за истекшие 6 мес. Продолжительность сохранения проявлений дисбиоза (по бактериологическому исследованию кала и мазка из зева с дополнительным применением хромато-масс-спектрометрии для идентификации микроорганизмов) оценивали по результатам повторных обследований с основной точкой на 30±3 дня.
Все участники исследования или их законные представители подписали информированное согласие об использовании обезличенных данных медицинской документации в научных целях, а также в публикациях и докладах по полученным результатам.
Статистическую обработку полученных результатов проводили с помощью компьютерной программы Statistica, версия 12. Рассчитывали средние значения (M), стандартное отклонение (SD). Статистическую значимость различий средних значений оценивали с помощью критерия Манна — Уитни, а частоты встречаемости признака — с помощью критерия χ2. Статистически значимыми считали значения р<0,05.
Результаты и обсуждение
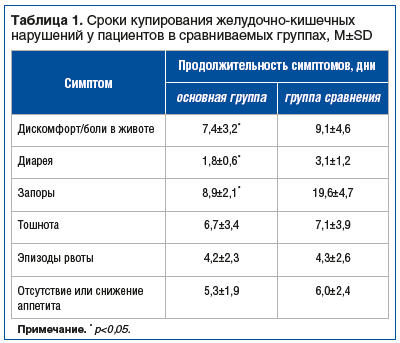
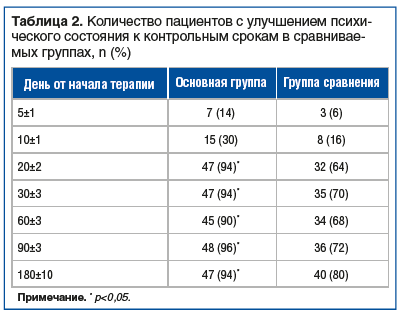
На фоне терапии БАД Адиарин® Пробио было отмечено более быстрое купирование дискомфорта и эпизодов болей в животе, а также нарушений стула (табл. 1). Примечательно, что у пациентов отмечалась нормализация частоты и характера стула как при диарее, так и при запорах. К моменту завершения приема препарата, а также в последующие контрольные сроки наблюдения отмечали улучшение психоневрологического состояния при снижении количества баллов не менее чем на 2 по шкалам Гамильтона, SAPS или Янга, Бартела, Монреальской шкале в соответствии с клиническими проявлениями, а также с основным диагнозом (табл. 2). Было обращено внимание на незначительную динамику этих проявлений в первые 2 нед. лечения.
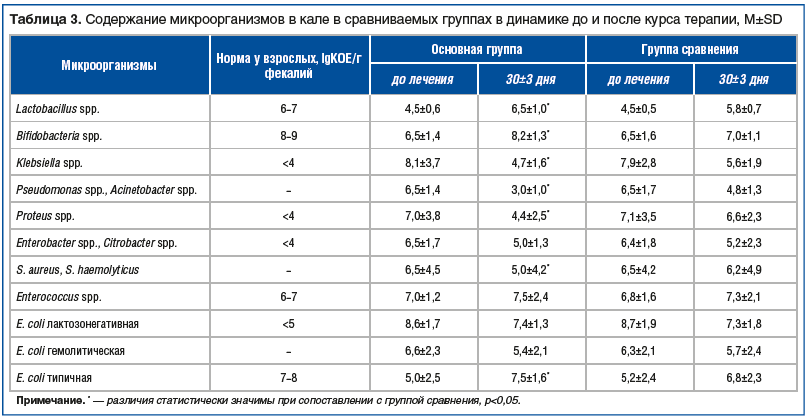
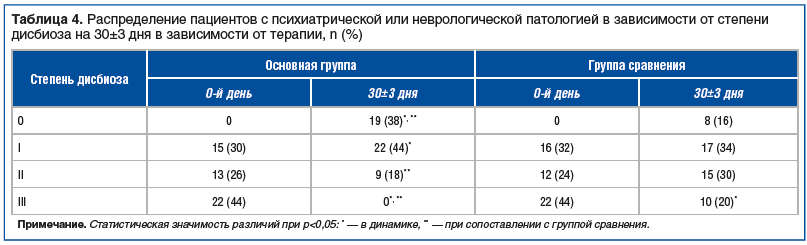
На сроке 30±3 дня в основной группе отмечено существенное улучшение показателей состава микробиоты со статистически значимым относительно группы сравнения повышением количества Lactobacillus spp., Bifidobacteria spp., непатогенных Escherichia coli и снижением числа условно-патогенных бактерий Klebsiella spp., Pseudomonas spp., Acinetobacter spp., Proteus spp. Staphylococcus aureus и Staphylococcus haemolyticus (табл. 3). Сокращение числа условно-патогенных микроорганизмов закономерно сопровождается уменьшением риска осложнений ОРВИ, в первую очередь пневмоний, и других заболеваний, возникающих за счет активности собственной условно-патогенной флоры ротоглотки или транслокации ее из кишечника. У всех пациентов было отмечено улучшение состава микробиоты кишечника, а купирование дисбиотических изменений с отсутствием условно-патогенной флоры при нормальном количестве лакто- и бифидобактерий зарегистрировано у 19 (38%) пациентов, тогда как в группе сравнения положительную динамику отметили только у 23 (46%) больных (p<0,05), а нормализацию состава микробиоты — у 8 (16%) (p<0,05, табл. 4).
У 27 пациентов в период со 2-го по 6-й месяц отметили необходимость повторного курса БАД Адиарин® Пробио в связи с возобновлением ранее отмеченных жалоб. Повторные курсы были одобрены лечащими врачами, после них также отмечалось улучшение самочувствия пациентов с купированием желудочно-кишечных нарушений и положительной динамикой психического состояния.
Частота ОРВИ в основной группе за 6 мес. была 1,3±0,74, что статистически значимо меньше, чем в группе сравнения (1,9±1,17, р<0,05). Это подтвердило результаты ранее проведенных исследований среди пациентов без учета психоневрологического статуса [25]. По-видимому, такой результат связан с повышением количества бифидо- и лактобактерий на слизистых оболочках ротоглотки и кишечника, участвующих в формировании резистентности организма к возбудителям, а также со снижением числа представителей условно-патогенных микроорганизмов.
На необходимость сохранения нормального состава микробиома кишечника и ротоглотки с помощью адекватной биоценоз-сберегающей терапии и своевременной коррекции нарушений было обращено внимание достаточно давно [4, 26, 27], влияние различных микроорганизмов на поведенческие реакции изучено в ходе экспериментальных работ на животных [15–17], оценено в исследованиях с участием пациентов, имеющих различные психопатологические состояния и соматическую патологию [17, 18, 28]. В настоящее время известна иммуномодулирующая роль сообщества микроорганизмов здорового человека, обеспечивающая сопротивляемость возбудителям инфекционных заболеваний. Много внимания в последние годы уделяется роли оси «кишечник — мозг». В экспериментальных и клинических исследованиях было показано, что психическое состояние и поведение зависят от состава микробиоты кишечника и могут корректироваться с помощью применения пробиотических препаратов [4, 15–18]. Однако исследований, посвященных дисбиотическим нарушениям у психоневрологических пациентов, по-прежнему немного, данные их противоречивы, не все работы однозначно подтверждают результативность проводимой пробиотической терапии [4, 29, 30]. Безусловно, неудачи при терапии таких пациентов возможны, особенно в случаях отсутствия лабораторной оценки наличия и выраженности дисбиотических изменений, недоучета клинических и лабораторных изменений в динамике. В отличие от предыдущих работ, в ретроспективное исследование мы включали только тех пациентов, у которых были клинические симптомы дисбиоза ЖКТ, подтвержденные лабораторными методами. Проведенное нами исследование впервые показало эффективность применения комбинации ранее хорошо изученных пробиотических штаммов лактобактерий LGG® и бифидобактерий BB-12®, входящих в состав БАД Адиарин® Пробио, не только в отношении желудочно-кишечных симптомов, но и в отношении психоневрологических проявлений у пациентов, что может быть взято на вооружение на практике.
Заключение
Дополнение терапии взрослых пациентов с психоневрологической патологией и дисбиозом ЖКТ, сопровождающимся дискомфортом или болями в животе, нарушениями стула и аппетита, пробиотическим средством, содержащим лактобактерии LGG® и бифидобактерии BB-12®, приводит к более быстрому купированию или снижению выраженности жалоб, улучшению психического состояния, снижению частоты ОРВИ и улучшению лабораторных показателей состава микробиома, чем при применении стандартной комплексной терапии.
Информация с rmj.ru






