Введение
Проблема избыточной массы тела и ожирения приобретает все большую актуальность в связи с их высокой распространенностью, в том числе в детском и подростковом возрасте. По данным Всемирной организации здравоохранения (ВОЗ), к 2018 г. около 38 млн детей в возрасте до 5 лет имели избыточную массу тела и ожирение [1], а при сохраняющихся темпах роста общее число таких детей может достигнуть 70 млн к 2025 г. [2]. Распространенность избыточной массы тела и конституционально-экзогенного ожирения в Российской Федерации соответствует общемировым тенденциям. Избыточная масса тела и ожирение встречаются в среднем у 25,3% детей и подростков в РФ, однако показатели значительно различаются в зависимости от региона (избыток массы тела от 2,1 до 28,8%, ожирение от 1,2 до 25,3%) [3].
На сегодняшний день общепринят термин «метаболический синдром» (МС), который объединяет кластер метаболических расстройств, ассоциированных с повышенным риском развития сердечно-сосудистых заболеваний и сахарного диабета. Единогласно основными компонентами МС у взрослых и подростков старше 16 лет признаны ожирение, резистентность к инсулину, дислипидемия (повышенное содержание триглицеридов (ТГ) >1,7 ммоль/л) и артериальная гипертензия (АГ). В настоящее время действуют унифицированные критерии диагностики МС у взрослых и подростков старше 16 лет, которые используются во всем мире [4]. Для установления достоверного диагноза необходимо сочетание не менее трех указанных критериев (табл. 1).

В начале 1980-х годов на основании результатов ранее проведенных эпидемиологических исследований [5], продемонстрировавших, что избыточная масса тела и ожирение не всегда ассоциированы с повышением риска сердечно-сосудистых заболеваний и смерти, была впервые сформулирована концепция метаболически здорового ожирения (МЗО) [6]. К группе МЗО, как правило, относят пациентов, имеющих, помимо ожирения, не более одного дополнительного критерия МС [7]. Необходимо подчеркнуть, что термин «метаболически здоровое ожирение» используется лишь в отношении факторов кардиометаболического риска.
Известно, что ожирение ассоциировано с развитием низкоуровневого воспаления жировой ткани. Развивающиеся на фоне гипертрофии подкожно-жировой клетчатки, гипертрофии и гиперплазии висцеральной жировой ткани гипоксия и оксидативный стресс провоцируют ускоренный апоптоз адипоцитов и выработку провоспалительных цитокинов (интерлейкин (ИЛ) 1, ИЛ-6, фактор некроза опухоли α и др.) [8].
В наших предыдущих работах уже была затронута тема гормональных, сосудистых и метаболических последствий ожирения у подростков [9, 10]. В ряде научных исследований была продемонстрирована значимость определения ИЛ-6 в качестве одного из маркеров эндотелиальной дисфункции у пациентов групп повышенного риска развития атеросклероза [11, 12]. Однако роль ИЛ-6 во взаимосвязи с развитием клинико-биохимических проявлений МС среди подростков с ожирением ранее не была изучена.
Цель исследования: изучение активности провоспалительного цитокина ИЛ-6 и определение его значимости как маркера формирующихся кардиометаболических рисков у мальчиков-подростков с ожирением с учетом клинико-биохимических проявлений МС.
Содержание статьи
Материал и методы
Для достижения поставленной цели обследованы 96 подростков мужского пола 16–18 лет с конституционально-экзогенным ожирением 1–3-й степени (SDS индекса массы тела (ИМТ) 2,0–3,9). Все пациенты европеоидной расы, постоянно проживают в Ростовской области РФ. В исследование не включали пациентов с сопутствующими тяжелыми органическими, неврологическими, психическими или соматическими заболеваниями, сахарным диабетом или другой значимой эндокринной патологией.
У всех пациентов собирали анамнез и проводили физикальное обследование. Антропометрические измерения проводили с использованием программы ANTHROPlus в соответствии со стандартизированным протоколом, разработанным ВОЗ [13]. Рассчитывали отношение массы тела к возрасту (Weight-for-Age Z-score, WAZ) и отношение ИМТ к возрасту (BMI-for-Age Z-score, BAZ). Интерпретировали полученные значения по следующим критериям: избыточная масса тела — SDS ИМТ +1–+2; ожирение — SDS ИМТ >+2,0, где ожирению 1-й степени соответствовал SDS ИМТ +2,0–+2,5, 2-й степени — SDS ИМТ +2,6–+3,0, 3-й степени — SDS ИМТ +3,1–+3,9 [14]. Для интерпретации исследуемых показателей была привлечена группа контроля из 20 здоровых подростков мужского пола с нормальной массой тела.
Биохимические исследования включали определение содержания глюкозы в крови и показателей липидограммы с помощью методов иммуноферментного анализа на анализаторе AliseiQ.S. (Radim, Италия). Для оценки инсулинорезистентности (ИР) применяли индекс НОМА-IR, (Homeostasis Model Assessment of Insulin Resistance), который рассчитывали по формуле: уровень глюкозы (ммоль/л) × уровень инсулина (мкМЕ/мл) / 22,5. Для выявления нарушений углеводного обмена использовали пероральный тест толерантности к глюкозе (ПТТГ) с определением уровня глюкозы и инсулина в крови натощак (глюк-1, инс-1 соответственно) и через 2 ч после приема внутрь 75 г глюкозы (глюк-2, инс-2).
Для оценки атерогенного потенциала определяли следующие показатели в анализе крови: содержание общего холестерина, ТГ, холестерина липопротеинов высокой плотности (ЛПВП) и низкой плотности (ЛПНП). Исследования проводили энзиматическим методом на автоматическом анализаторе с использованием стандартных реактивов. Коэффициент атерогенности (в норме 2–3) определяли по формуле Friedewald.
У всех пациентов методом иммуноферментного анализа определяли уровень ИЛ-6 в сыворотке крови с помощью тест-системы Cloud-Clone Corp. (США) на фотометре SUNRISETECAN (Австрия).
Пациенты и их родители были информированы о методах исследования и дали письменное информированное согласие на участие в нем. Текст информированного согласия соответствует биоэтическим принципам, предъявляемым Хельсинкской декларацией Всемирной медицинской ассоциации. Исследование было одобрено локальным этическим комитетом НИИ акушерства и педиатрии ФГБОУ ВО РостГМУ Минздрава России.
Статистический анализ данных осуществляли в программе Statistica 10.0 (StatSoft Inc., США). Нормальность распределения количественных признаков оценивали с помощью критерия Шапиро — Уилка. При описании переменных указывали среднее и стандартное отклонение (M±σ) или 95% доверительный интервал. Проверку гипотез о равенстве двух средних для параметрических данных проводили с помощью t-критерия Стьюдента. Для выявления межгрупповых различий более чем в трех группах использовали однофакторный дисперсионный анализ (модуль ANOVA пакета Statistica 10.0). Статистически значимыми считали различия при р<0,05. По коэффициенту Спирмена оценивали силу связи между переменными (r).
Результаты и обсуждение
Анализ данных о содержании ИЛ-6 в крови показал, что у пациентов с ожирением этот показатель был выше, чем у здоровых подростков (4,46±0,71 пг/мл и 2,5±0,3 пг/мл соответственно, р=0,03). При этом статистически значимых различий в концентрации ИЛ-6 в зависимости от показателей ИМТ выявлено не было (табл. 2). В то же время отмечено достоверное повышение этого показателя у пациентов с 3-й степенью ожирения по сравнению с подростками с ожирением 1-й и 2-й степени (р=0,042). Подобные результаты были получены и в некоторых других исследованиях [15].
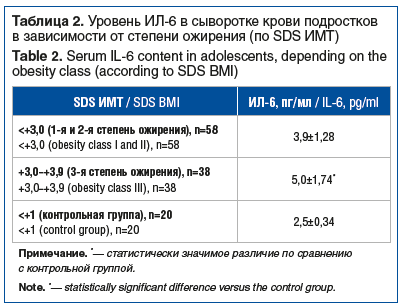
В результате анализа изменений содержания ИЛ-6 в крови в зависимости от степени выраженности ИР, продемонстрировано, что при высоких значениях показателя ИР (HOMA-IR>5,0) концентрация ИЛ-6 у подростков с ожирением была существенно выше по сравнению с пациентами, у которых показатели ИР были нормальными (HOMA-IR<2,5) или умеренно повышенными (HOMA-IR 2,5–5,0): 6,5±2,1 пг/мл против 2,9±1,1 пг/мл, p=0,02 и 6,5±2,1 пг/мл против 3,9±1,3 пг/мл, p=0,04 соответственно.
Тенденция к ИР возникает в результате модификации рецепторов инсулина, что обусловливает нарушение взаимодействия с ними инсулина. Очевидно, метаболическое воспаление, оцениваемое по уровню ИЛ-6, нарастает по мере ухудшения чувствительности к инсулину у пациентов с ожирением. Среди провоспалительных цитокинов ИЛ-6 является ключевым в процессе активации иммунного ответа. Он служит фактором дифференцировки лимфоцитов и синтеза белков острой фазы в печени, оказывает влияние на гормональные изменения при эндокринных нарушениях [16]. Предполагается, что ИЛ-6 может способствовать увеличению содержания свободных жирных кислот. Концентрация ИЛ-6 была повышена у пациентов с сахарным диабетом 2 типа с ИР [17]. Ряд исследователей утверждают, что во время начала физических упражнений происходит выраженное повышение концентрации ИЛ-6 в мышечной ткани. Возможно, скелетные мышцы являются важной мишенью действия этого цитокина [18], так как он может способствовать захвату и утилизации глюкозы работающими мышцами [19].
Среди пациентов с нормальной и повышенной гликемией натощак статистически значимых различий в концентрации ИЛ-6 в крови выявлено не было, хотя и отмечалась тенденция к увеличению ее у лиц с повышенной гликемией натощак (3,9±1,33 и 4,5±1,86 пг/мл соответственно). Существенных различий в показателях ИЛ-6 между пациентами с нормальными и пониженными значениями общего холестерина, ЛПНП и ЛПВП выявлено не было, однако определялась тенденция к увеличению концентрации ИЛ-6 у лиц со сниженными значениями ЛПВП (р=0,07). Достоверно различался уровень ИЛ-6 в крови подростков с повышенной концентрацией ТГ (>1,7 мм/л) в сравнении с пациентами с нормальным содержанием ТГ (р=0,023) (табл. 3).
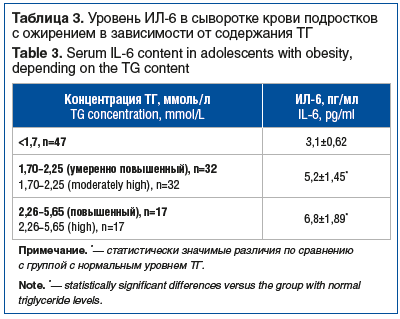
Из 49 подростков c повышенным уровнем ТГ у 17 (34,6%) содержание ТГ превышало 2,26 ммоль/л. Среднее значение концентрации ИЛ-6 в этой подгруппе было наивысшим, что свидетельствует об увеличении уровня метаболического воспаления, оцениваемого по данному цитокину, по мере нарастания патологической гипертриглицеридемии.
Содержание ИЛ-6 было достоверно повышено среди пациентов с АГ (5,5±1,54 пг/мл против 3,6±1,29 пг/мл, р=0,04), что указывает на возможное вовлечение данного цитокина в развитие сосудистых осложнений ожирения. Ранее была установлена взаимосвязь между уровнем ИЛ-6 и показателями сосудистой дисфункции, определяемой по расширению плечевой артерии у молодых пациентов, перенесших инфаркт миокарда [20].
В нашем исследовании у 49 (51,1%) подростков были выявлены признаки МС в соответствии с критериями Международной диабетической ассоциации (IDF). При этом у 22 (44,9%) обследованных определялись 3 критерия МС, а у остальных 27 (55,1%) — >3 признаков МС и, соответственно, увеличивались кардиометаболические риски.
Анализ показателей ИЛ-6 продемонстрировал тенденцию к повышению его содержания у пациентов с признаками МС, при этом его концентрация была достоверно выше у лиц с полной формой МС, включавшей в себя 4–5 его клинико-лабораторных критериев, в сравнении с подростками с неполной формой синдрома (не более 3 критериев) или у которых критерии МС не определялись (табл. 4).

Среди пациентов с МС у 23,1% концентрация ИЛ-6 составила ≥6 пг/мл, тогда как у пациентов без признаков МС подобных высоких значений ИЛ-6 не отмечалось. Индивидуальный анализ случаев с высоким содержанием ИЛ-6 показал, что у этих пациентов отмечались все 5 признаков МС. Более того, нарушения углеводного обмена у них соответствовали критериям предиабета (нарушенная толерантность к глюкозе или повышенная гликемия натощак). Следует отметить, что у пациентов с МЗО не было характерных для МС маркеров, а средний уровень ИЛ-6 был все же выше, чем у подростков с нормальной массой тела (р>0,05). Следовательно, несмотря на отсутствие клинико-биохимических признаков развития МС при ожирении у подростков, метаболическое воспаление у них уже может быть зафиксировано.
Таким образом, обнаружено достоверное повышение продукции ИЛ-6 у подростков с ожирением, нарастающее по мере увеличения степени ожирения, повышения ИР и нарастания дислипидемии.
Проведенный корреляционный анализ исследуемых метаболических показателей позволил обнаружить положительные корреляционные связи между ИМТ, уровнем базального инсулина, ЛПНП при отрицательной взаимосвязи с ЛПВП (табл. 5).
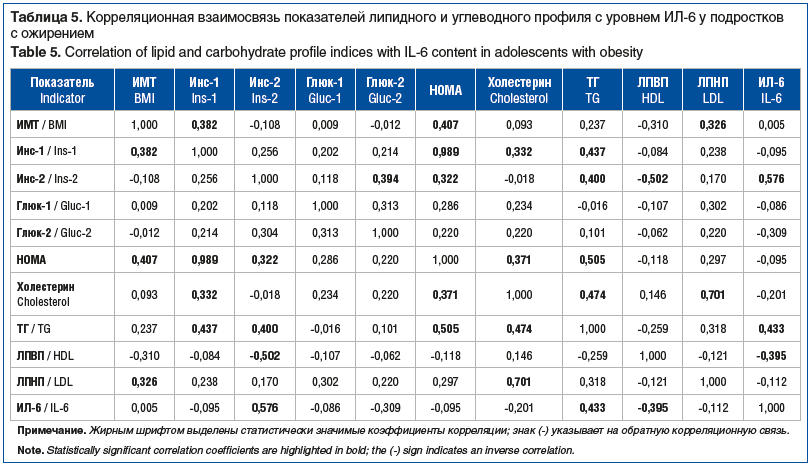
Уровень базального инсулина и, соответственно, индекс НОМА прямо коррелировали с содержанием ТГ и, в меньшей степени, с концентрацией холестерина. Уровень стимулированного в ходе ПТТГ инсулина отрицательно коррелировал с концентрацией холестерина ЛПВП и отчетливо был связан с увеличением содержания ИЛ-6.
Содержание ИЛ-6 положительно коррелировало с концентрацией ТГ в сыворотке крови подростков с ожирением и отрицательно — с уровнем ЛПВП, что подтверждало значимость ИЛ-6 как дополнительного диагностического маркера МС.
Полученные данные доказывают, что при ожирении жировая ткань приобретает иммунологические свойства, а иммуно-метаболические взаимодействия могут приводить к воспалению низкой интенсивности, которое ухудшает функцию тканей и связывает ожирение с хроническими заболеваниями [21, 22]. Реципрокные взаимодействия между иммунной и метаболической системами могут на определенном этапе развития ожирения играть физиологическую роль в адаптации к хроническому избытку энергии посредством ремоделирования жировой ткани, восстановления гомеостаза тканей и потенциального воздействия на использование энергетических субстратов [23].
Заключение
Для подростков с ожирением характерно повышение продукции провоспалительного цитокина ИЛ-6, коррелирующее со степенью дислидемии, индуцированной гиперинсулинемии и формированием АГ, и, следовательно, данный показатель можно использовать в качестве маркера формирующегося МС.
Полученные нами данные свидетельствуют об активации системной воспалительной реакции у подростков с ожирением, которая является, вероятно, одним из важнейших патогенетических звеньев формирования проатерогенных сдвигов у лиц достаточно юного возраста и, следовательно, приводит к повышению кардиометаболических рисков в дальнейшем. Вероятно, развитие терапевтических возможностей для снижения воспаления жировой ткани сможет способствовать улучшению чувствительности к инсулину при ожирении и снижению формирующегося атерогенного потенциала.
Сведения об авторах:
Пузикова Олеся Зиновьевна — д.м.н., ведущий научный сотрудник педиатрического отдела ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0002-2868-0664.
Чурюкина Элла Витальевна — к.м.н., доцент, начальник отдела аллергических и аутоиммунных заболеваний; ведущий научный сотрудник ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0001-6407-6117.
Московкина Анжела Владимировна — д.м.н., ведущий научный сотрудник акушерско-гинекологического отдела ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0003-3784-2159.
Попова Виктория Александровна — д.м.н., главный научный сотрудник педиатрического отдела ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0001-5329-7336.
Афонин Александр Алексеевич — д.м.н., профессор, главный научный сотрудник педиатрического отдела ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0003-1078-8391.
Кравченко Лариса Вахтанговна — д.м.н., ведущий научный сотрудник педиатрического отдела ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0002-0036-4926.
Контактная информация: Пузикова Олеся Зиновьевна, е-mail: olepuzikova@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 23.05.2024.
Поступила после рецензирования 17.06.2024.
Принята в печать 10.07.2024.
About the authors:
Olesya Z. Puzikova — Dr. Sc. (Med.), Leading Researcher of the Department of Pediatrics, Rostov State Medical University; 29, Nakhichevanskiy Lane, Moscow, 344022, Russian Federation; ORCID iD 0000-0002-2868-0664.
Ella V. Churyukina — C. Sc. (Med.), Associate Professor, Head of the Department of Allergic and Autoimmune Diseases, Leading Researcher, Rostov State Medical University; 29, Nakhichevanskiy Lane, Moscow, 344022, Russian Federation; ORCID iD 0000-0001-6407-6117.
Angela V. Moskovkina — Dr. Sc. (Med.), Leading Researcher of the Obstetric and Gynecological Department, Rostov State Medical University; 29, Nakhichevanskiy Lane, Moscow, 344022, Russian Federation; ORCID iD 0000-0003-3784-2159.
Victoria A. Popova — Dr. Sc. (Med.), Chief Researcher of the Department of Pediatrics, Rostov State Medical University; 29, Nakhichevanskiy Lane, Moscow, 344022, Russian Federation; ORCID iD 0000-0001-5329-7336.
Alexander A. Afonin — Dr. Sc. (Med.), Professor, Chief Researcher of the Pediatric Department, Rostov State Medical University; 29, Nakhichevanskiy Lane, Moscow, 344022, Russian Federation; ORCID iD 0000-0003-1078-8391.
Larisa V. Kravchenko— Dr. Sc., Leading Researcher at the Pediatric Department, Rostov State Medical University; 29, Nakhichevanskiy Lane, Moscow, 344022, Russian Federation; ORCID iD 0000-0002-0036-4926.
Contact information: Olesya Z. Puzikova, e-mail: olepuzikova@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 23.05.2024.
Revised 17.06.2024.
Accepted 10.07.2024.
Информация с rmj.ru






