Введение
Бактериальная инфекция переднего отдела глаза в практике врача-офтальмолога встречается довольно часто. В большинстве случаев бактериальное поражение век и конъюнктивы имеет доброкачественное течение. Однако в случаях вовлечения в воспаление роговицы — как в результате формирования осложнений бактериальной инфекции век и конъюнктивы, так и вследствие непосредственного воздействия патогена на роговицу — возможно развитие более тяжелых форм воспалительного заболевания (язв и эрозий роговицы, перфорации роговицы, эндофтальмитов, панофтальмитов). Идентификация возбудителя/возбудителей в таких случаях является обязательной, но в некоторых случаях она бывает затруднительна, поскольку бактерии могут иметь особые требования к средам и условиям роста.
Возбудителей бактериальных инфекций глаз традиционно определяют микробиологическими методами — выращиванием чаще на питательных средах, реже — на культурах клеток и тканей, в куриных эмбрионах. Последние 13 лет (первое пилотное исследование было проведено в 2011 г.) нередко с целью количественной оценки состава микробных сообществ и молекулярной идентификации отдельных штаммов используют метод секвенирования гена 16S рибосомальной РНК (рРНК) [1]. Ген 16S рРНК — уникальный, «консервативный» (сохранный), устойчивый к горизонтальному переносу генов участок нуклеотидной цепи. Исходя из указанных характеристик, по гену 16S рРНК можно идентифицировать бактерии, выделенные из образцов. В настоящее время данный метод уже следует отнести к «золотому стандарту» проведения полного анализа состава микрофлоры, в том числе и конъюнктивальной [1, 2]. Результатом использования метода секвенирования гена 16S рРНК является получение подробного «портрета» микробиома конъюнктивы человека.
Содержание статьи
Микрофлора век и конъюнктивы в норме и при патологии
Сочетанное использование микробиологических методов исследования микрофлоры и секвенирования гена 16S рРНК позволило определить «малобактериальность» конъюнктивальной полости. Даже если колонии бактерий присутствуют в здоровой конъюнктиве, количество колониеобразующих единиц (КОЕ) в одном конъюнктивальном мазке обычно не превышает 100 КОЕ. С другой стороны, исследование здоровой глазной поверхности, проведенное путем секвенирования ампликонов 16S рРНК, выявило значительное разнообразие микробного сообщества, включающего пять фил (групп микроорганизмов, объединенных общим родством) и 59 отдельных родов бактерий [3, 4]. Исследования Q. Dong et al. [1] и J. Ozkan et al. [5] показали, что более 87% последовательностей 16S рРНК конъюнктивы были отнесены к трем филам: Proteobacteria (64,0–64,4%), Actinobacteria (15,0–19,6%) и Firmicutes (3,9–15,5%). Наиболее часто встречающимися представителями данных групп бактерий являются Streptococcus, Staphylococcus, Clostridium, Enterococcus, Faecalibacterium, Neisseria, Haemophilus influenzae, Escherichia coli, Proteobacteria, Nocardia, Actinomyces. Другие авторы отмечают, что наиболее часто «ядро» конъюнктивальной микрофлоры составляют комменсалы (не вызывающие воспаление) и условно-патогенные бактерии следующих родов: Pseudomonas, Corynebacterium, Acinetobacter, Staphylococcus, Streptococcus, Millisia, Anaerococcus, Finegoldia, Simonsiella [6].
Следует отметить интересный факт: виды бактерий, обнаруженных в конъюнктиве здоровых глаз, были также идентифицированы и в конъюнктивальных мазках пациентов с бактериальной инфекцией. Так, Т.Н. Воронцова и соавт. [7] показали, что у 63,8% обследованных детей с клинически здоровой конъюнктивой результат посева оказался положительным. Наиболее часто исследователи высевали Staphylococcus epidermidis — у 48,2% обследуемых, в 7% случаев посев был положительным на наличие Staphylococcus aureus. Неожиданной находкой для авторов оказалось обнаружение в мазках здоровой конъюнктивы Enterococcus faecalis (5,2%).
E. faecalis является представителем нормальной микрофлоры кишечника, а обнаружение его в конъюнктивальной полости — возможно, следствие несоблюдения правил гигиены, что при определенных условиях может быть причиной развития инфекционного конъюнктивита. Здесь же следует упомянуть о том, что конъюнктивит, наряду с кожными инфекционными заболеваниями и кишечными инфекциями, относят к так называемым болезням «грязных рук», а представители кишечной микрофлоры наиболее часто являются причиной конъюнктивального воспаления, связанного с несоблюдением правил гигиены. В нашей клинической практике мы наблюдали случай хронического двустороннего конъюнктивита, ассоциированного с E. faecalis. Помимо классических признаков воспаления конъюнктивы (гиперемия, фолликулярная реакция, гнойное отделяемое) нами была выявлена пленка на конъюнктиве нижнего века (рис. 1). Известно, что фекальный энтерококк обладает свойством образования биопленок — сообществ микроорганизмов, которые растут, прикрепляясь к поверхности или межфазной оболочке (участок на границе двух сред, например, твердой и жидкой) [8–10]. К подобного рода межфазной среде можно отнести край века или слизистую оболочку глаза, где условно твердой средой можно считать конъюнктиву, а жидкой — слезу. В описанном выше клиническом случае мы наблюдали сформировавшуюся биопленку, что, по-видимому, и явилось причиной хронического течения конъюнктивита.
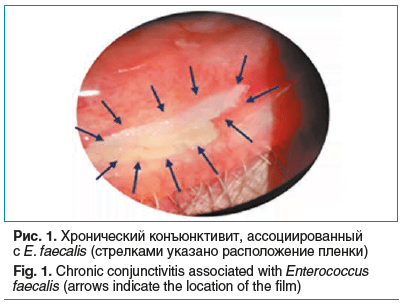
Лечебная тактика в отношении пациента была определена, исходя из результатов чувствительности к антибиотикам высеянного E. faecalis и рекомендаций врачей-инфекционистов — использование комбинаций разных групп антибактериальных препаратов в лечении инфекций, ассоциированных с фекальным энтерококком. Нами было принято решение использовать комбинацию следующих антибиотиков: офлоксацин капли глазные (Флоксал, ООО «Бауш Хелс») и нетилмицин капли глазные и мазь глазная (Неттацин и Неттависк, ООО «Бауш Хелс»). Чувствительность E. faecalis к нетилмицину и офлоксацину по результатам исследования оказалась высокой, кроме того, в инструкции по медицинскому применению вышеуказанных препаратов E. faecalis находится в антимикробном спектре действия.
Возвращаясь к работе Т.Н. Воронцовой и соавт. [7], следует отметить, что S. epidermidis, S. aureus и E. faecalis являлись самыми частыми видами бактерий, высеваемых у пациентов с различными воспалительными заболеваниями век и переднего отдела глаза (наружный и внутренний ячмень, блефарит, хронический гнойный дакриоцистит, хронический конъюнктивит). Авторы обращают внимание на тот факт, что у всех здоровых людей, вошедших в исследование, микрофлора конъюнктивальной полости была представлена монокультурой, а в группе обследованных с воспалительными заболеваниями в 4,8% случаев обнаруживали микст-инфицирование конъюнктивы. По-видимому, воспаление, запущенное одним видом патогена, открывает «входные ворота» для других инфекционных агентов, вызывая в некоторых случаях хронизацию патологического процесса.
Не менее интересным представляется исследование состава микрофлоры конъюнктивы, проведенное румынскими авторами в 2023 г. [11]. Обследовав 993 пациента в возрасте от 44 до 98 лет, готовящихся к оперативному вмешательству по поводу катаракты, офтальмологи обнаружили, что грамположительная флора выявлялась гораздо чаще (у 86,3% пациентов), нежели грамотрицательная (у 13,7%). Золотистый стафилококк метициллиночувствительный имел наибольшую распространенность среди грамположительных бактерий и высевался в 55,9% случаев, за ним следовали коагулазонегативный стафилококк (21,73%), метицилинрезистентный золотистый стафилококк (3,1%) и стрептококк (1,86%). Грамотрицательная флора была представлена в 4,3% случаев, Klebsiella, Proteus выявили у 3,72% обследуемых, а синегнойная палочка была обнаружена у 1,8% пациентов [11].
В контексте предоперационного обследования больных офтальмологического профиля следует обратить внимание на тот факт, что наиболее частой причиной развития послеоперационных эндофтальмитов являются коагулазонегативные стафилококки и золотистый стафилококк [12]. Данные о возбудителях, обнаруженных в доказанных случаях инфекционного эндофтальмита после оперативного вмешательства по поводу катаракты, представлены в таблице. Вновь обращает на себя внимание то, что нами уже было отмечено выше: указанные в таблице представители микробного мира наиболее часто обнаруживаются на клинически здоровых конъюнктиве и веках.
Несмотря на то, что заболеваемость эндофтальмитом после катарактальной хирургии незначительна (варьирует от 0,03 до 0,2% по всему миру), он продолжает оставаться самым грозным и разрушительным осложнением внутриглазной хирургии [16]. Микробиология эндофтальмита остается фактически неизменной в течение длительного периода времени, при этом наиболее распространенными являются грамположительные бактерии (94,2%), а грамотрицательные бактерии составляют лишь небольшую часть культурно-положительных случаев (5,9%). Как правило, причастная к развитию эндофтальмита флора обнаруживается на краях век и в конъюнктиве, а во время операции представители микробиоты переднего отдела глаза могут проникнуть в переднюю камеру посредством «прилипания» к внутриглазным линзам, инструментам, а также через жидкость операционного поля. M.G. Speaker et al. [17] продемонстрировали, что бактериальные изоляты из стекловидного тела генетически соответствовали бактериальным видам, выделенным из век и конъюнктивы или носа, в 14 из 17 случаев эндофтальмита. Таким образом, пациент является в большинстве случаев источником инфекции для развития послеоперационного эндофтальмита.
![Таблица. Возбудители, обнаруженные в доказанных случаях инфекционного эндофтальмита после катарак- тальной хирургии [12–15] Table. Pathogens found in defined cases of infectious endophthalmitis after cataract surgery [12–15] Таблица. Возбудители, обнаруженные в доказанных случаях инфекционного эндофтальмита после катарак- тальной хирургии [12–15] Table. Pathogens found in defined cases of infectious endophthalmitis after cataract surgery [12–15]](https://medblog.su/wp-content/uploads/2025/01/1737271967_937_Rol-bakterialnoj-flory-vek-i-konyunktivy-v-razvitii-vospalitelnoj-patologii.png)
Следует акцентировать внимание офтальмологов на возможности развития послеоперационных бактериальных осложнений у пациентов с сопутствующей ЛОР-патологией. Область лица и структуры, входящие в понятие «лицо», являются единой анатомической зоной с общим кровоснабжением, иннервацией, лимфооттоком и иммунной системой. Кроме того, конъюнктивальная полость непосредственно связана с полостью носа носослезным каналом, а слизистая оболочка глазного яблока имеет продолжение в виде слизистой носослезного канала. Следовательно, хронические воспалительные заболевания структур, прилегающих к орбите и глазному яблоку (в некоторых случаях протекающие бессимптомно или с крайне слабо выраженной симптоматикой), могут явиться источником патогенов, способных вызвать воспаление в глазу.
Ряд исследований показывает однотипный состав микрофлоры конъюнктивы и слизистой полости носа. Так, K.С. Kitazawa et al. [18], обследовав 120 пациентов перед предстоящей кераторефракционной операцией, определили, что состав микробиома конъюнктивы и полости носа идентичен и включает следующие микроорганизмы: S. epidermidis, Corynebacterium species, S. aureus Г.М. Чернакова и соавт. [19] в работе по определению микробной составляющей конъюнктивы и носоглотки у пациентов с острыми конъюнктивитами показали сходный набор изолятов, полученный из конъюнктивальных и носоглоточных мазков.
Таким образом, микрофлора век и конъюнктивы в норме и патологии имеет схожий состав, что показывают результаты большого количества исследований. Данное обстоятельство приобретает большое значение для пациентов, готовящихся к плановой операции, и делает необходимым проведение предоперационной подготовки больного. С нашей точки зрения, в рамках подготовительных мероприятий необходимо в том числе проводить микробиологическое исследование мазков, взятых из конъюнктивальной полости и полости носа, с определением чувствительности высеваемой флоры к антибактериальным препаратам, используемым в офтальмологии. Исследование чувствительности бактериальной флоры к антибиотикам позволит сделать оптимальный выбор препарата для проведения медикаментозной предоперационной подготовки.
Антибиотикотерапия бактериальной офтальмопатологии
В настоящее время врач-офтальмолог обладает разнообразным арсеналом антибактериальных препаратов. Однако массовое использование антибиотиков (как системных, так и топических) в популяции привело к формированию резистентности большого пула бактерий к некоторым антимикробным препаратам, что не может не вызывать беспокойства. Последние несколько лет мы встречаем большое количество исследований, посвященных определению чувствительности конъюнктивальной флоры к антибиотикам. Например, в исследовании A.M. Ghita et al. [11], о котором мы упоминали выше, оценивали чувствительность бактериальных изолятов, выделенных из конъюнктивальной полости пациентов (готовящихся к оперативному вмешательству по поводу катаракты), к разным группам антибиотиков. Чувствительность каждого вида бактерий авторы определяли к антибиотикам следующих классов: гликопептиды (ванкомицин), цефалоспорины (цефтриаксон, цефуроксим, цефазолин), карбапенемы (меропенем, имипенем), фторхинолоны (моксифлоксацин, левофлоксацин, офлоксацин, ципрофлоксацин), аминогликозиды (тобрамицин, нетилмицин, амикацин, канамицин, гентамицин), фениколы (хлорамфеникол), тетрациклины (тетрациклин, доксициклин), рифамицины (рифампицин), макролиды (азитромицин, кларитромицин, эритромицин) и пенициллины (ампициллин, амоксициллин). Результаты данного этапа исследования показали, что умеренная эффективность в отношении грамположительных микроорганизмов (от 80 до 90% бактерий были чувствительны к антибиотикам) была отмечена для фторхинолонов (моксифлоксацин, левофлоксацин, офлоксацин, ципрофлоксацин). Цефалоспорины, пенициллины, аминогликозиды (исключение составил нетилмицин) обнаружили снижение терапевтического эффекта в отношении грамположительных бактерий — менее 80% изолятов оказались чувствительны к данным препаратам. Грамположительные бактерии продемонстрировали довольно высокую устойчивость к аминогликозидам — только 72,9 и 62,5% бактерий были чувствительны к тобрамицину и канамицину соответственно. Нетилмицин оказался самым эффективным антибиотиком из группы аминогликозидов, оказавшимся активным в отношении 94,7% грамположительных микроорганизмов [11].
Нетилмицин является полусинтетическим аминогликозидом III поколения, производным сизомицина (продукт жизнедеятельности бактерии вида Micromonospora inyoensis). Синтез нетилмицина был описан еще в 1976 г. J.J. Wright [20–22]. В последующем активному изучению данного антибиотика способствовали его выраженная активность в отношении аминогликозидрезистентных бактерий и довольно низкая степень токсичности для животных моделей [21]. Антибактериальное действие нетилмицина связано с созданием необратимых связей со специфическими белками в 30-м сегменте рибосомы бактерии, что приводит к неправильному прочтению генетического кода, торможению синтеза белка и в итоге к гибели бактериальной клетки.
Нетилмицин обладает рядом важных свойств, что позволяет рассматривать его как возможного претендента на звание «идеального антибиотика». Во-первых, нетилмицин является бактерицидным антибиотиком широкого спектра действия. Его активность в отношении как грамотрицательных, так и грамположительных бактерий высока даже при использовании низких концентраций препарата. Д.Ю. Майчук и соавт. [23] показали, что нетилмицин превосходил другие аминогликозиды (гентамицин, тобрамицин) по значениям МПК 50/90 (минимальная подавляющая концентрация, при применении которой угнетается рост 50%/90% исследуемых штаммов) в отношении метициллиночувствительных штаммов S. aureus и коагулазонегативных стафилококков. Авторы отмечают, что, согласно формальным критериям интерпретации (EUCAST v.4.1), 98% метициллиночувствительных штаммов S. aureus и 96% протестированных штаммов коагулазонегативных стафилококков были чувствительны к нетилмицину. В работе Г.Ю. Кнорринга [24] акцентировано внимание на том, что нетилмицин имеет большее сродство к роговице и конъюнктиве по сравнению с другими антибиотиками, обеспечивая в этих тканях количество препарата, необходимое для уничтожения микроорганизмов. При инфекционных кератитах отмечена наиболее высокая чувствительность возбудителей к нетилмицину как при моно-, так и при полимикробном кератите [24].
Кроме того, по мнению Г.Ю. Кнорринга [24], нетилмицин проявляет превосходящую активность в отношении наиболее распространенных штаммов бактерий, обнаруживаемых в структурах переднего отдела глаза, демонстрируя более быструю и бóльшую ингибирующую эффективность в тканях-мишенях, чем фторхинолоны: чувствительность грамположительных бактерий к нетилмицину составляет 95,4%, при этом чувствительность к фторхинолонам не превышает 80%. Анализируя эти данные, автор заключает, что сохранение высокой чувствительности бактерий к нетилмицину связано, по-видимому, с тем, что в РФ и странах Европы этот антибиотик очень редко применяется в системной антибиотикотерапии [24].
Во-вторых, в сравнении с другими представителями группы аминогликозидов нетилмицин более устойчив к действию аденилирующих и ацетилирующих ферментов бактерий, что обеспечивает меньшую резистентность к нему бактерий. В-третьих, нетилмицин обладает низкой цитотоксичностью в отношении эпителия конъюнктивы и роговицы, что доказано рядом исследований. Так, О.И. Александрова и соавт. [25] исследовали жизнеспособность трех типов клеток (клетки постоянной трансформированной клеточной линии СНО-К1, нормальные фибробласты кожи человека и клетки нормальной конъюнктивы человека Clone 1-5С-4) после воздействия на них нетилмицина, тобрамицина, ципрофлоксацина. Влияние антибиотиков на эффективность клонирования клеток исследователи определяли в сериях экспериментов с использованием различных концентраций исследуемых препаратов — 1 и 10% от объема питательной среды. Результаты экспериментов в присутствии исследуемых препаратов в концентрации 1% от объема питательной среды показали, что эффективность клонирования в экспериментальных вариантах была ниже, чем в контроле, но наиболее близким к контролю по эффективности клонирования оказался нетилмицин — 73%. При увеличении концентрации тестируемых препаратов (10% от объема питательной среды) культуральные клетки образовали клоны только в присутствии нетилмицина (эффективность клонирования в этом варианте составила 57%), а ципрофлоксацин и тобрамицин в такой же концентрации проявили высокую степень цитотоксичности при редком посеве клеток.
И наконец, нетилмицин является антибактериальным препаратом, обладающим синергизмом с другими группами антибиотиков. Синергизм нетилмицина важен в отношении тех бактериальных инфекций, которые поддаются терапии только комбинацией антимикробных препаратов, как, например, P. aeruginosa, Neisseria gonorrhoeae, E. faecalis. Указанные патогены являются наиболее опасными для глаза вследствие того, что вызывают развитие тяжелых воспалительных заболеваний с угрозой потери не только зрительных функций, но и глазного яблока как органа, что требует от офтальмолога внимательного подхода к выбору тактики лечения подобного рода пациентов. Определение чувствительности к антибиотикам высеваемой флоры является обязательным компонентом диагностического поиска у пациентов с «коварными» бактериальными инфекциями глаз — с целью назначить эффективные препараты и не допустить развития грозных осложнений. В качестве примера хотим привести клинический случай двустороннего гонококкового конъюнктивита, развившегося на фоне гонореи у пациента 26 лет.
Пациент обратился к нам на консультацию с предварительным диагнозом: аденовирусный кератоконъюнктивит (направлен офтальмологом по месту жительства) (рис. 2). В клинической картине заболевания помимо гиперемии конъюнктивы и гнойного отделяемого наблюдали поверхностный точечный кератит.
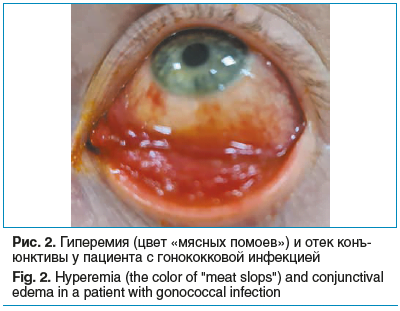
Однако из истории заболевания была получена информация о том, что симптомы воспаления конъюнктивы предшествовали появлению гнойных выделений из полового члена, что сделало необходимым направление пациента на консультацию к венерологу. Исследование мазка из уретры и конъюнктивы на наличие ДНК патогенов, передающихся половым путем, методом полимеразной цепной реакции выявило генетический материал N. gonorrhoeae. Полученные результаты позволили нам назначить топические антибиотики из разных фармакологических групп, к которым наблюдалась чувствительность обнаруженного патогена: нетилмицин (Неттацин, ООО «Бауш Хелс»), офлоксацин мазевая форма (Флоксал мазь глазная, ООО «Бауш Хелс»). Терапия глазными формами антибиотиков сопровождалась системным назначением цефтриаксона по рекомендации врача-венеролога. Активная системная и местная антибиотикотерапия в подобных случаях позволяет предупредить возможное фульминантное развитие язвы роговицы с перфорацией [26, 27].
Заключение
Подводя итог вышесказанного, следует акцентировать внимание офтальмологов на том, что наиболее часто источниками бактерий, вызывающих воспалительные заболевания переднего отдела глаза и приводящих к развитию инфекционных послеоперационных осложнений, угрожающих зрению, являются веко, конъюнктива, слизистая полости носа. Снижение количества бактерий на веках и конъюнктиве, в полости носа в рамках предоперационной подготовки позволит уменьшить риск развития воспалительных осложнений. С целью санации глазной поверхности следует использовать антибактериальные препараты с высокой чувствительностью к наиболее часто встречающимся в конъюнктивальной полости и на веках видам бактерий (S. epidermidis, S. aureus, H. influenzae). Нетилмицин является хорошо переносимым антибактериальным препаратом, эффективным в отношении большинства видов бактериальных патогенов, что позволяет его использовать в качестве препарата первой линии при лечении офтальмоинфекций. Кроме того, преимуществами данного антибиотика являются его безопасность и низкая цитотоксичность в отношении клеток переднего отдела глаза. Следовательно, нетилмицин можно применять в группе пациентов, подверженных риску развития лекарственных побочных эффектов. Таким образом, нетилмицин является превосходным антибактериальным препаратом против большинства грамположительных и грамотрицательных микроорганизмов и может быть использован в том числе в качестве эмпирической терапии глазных инфекций в тех случаях, когда требуется применение эффективного, нетоксичного и мощного антибиотика.
Сведения об авторах:
Клещева Елена Александровна — к.м.н., доцент, доцент кафедры офтальмологии ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; врач-офтальмолог ГБУЗ ММНКЦ им. С.П. Боткина ДЗМ; 125284, Россия, г. Москва, 2-й Боткинский пр-д, д. 5; ORCID iD 0000-0002-1392-3432
Чернакова Галина Мэлсовна — к.м.н., доцент, заведующая поликлиническим отделением № 2, научный сотрудник, врач-офтальмолог ГБУЗ ММНКЦ им. С.П. Боткина ДЗМ; 125284, Россия, г. Москва, 2-й Боткинский пр-д, д. 5; ORCID iD 0000-0002-9630-6076
Мельникова Наталья Владимировна — к.м.н., доцент кафедры офтальмологии ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; врач-офтальмолог ГБУЗ ММНКЦ им. С.П. Боткина ДЗМ; 125284, Россия, г. Москва, 2-й Боткинский пр-д, д. 5; ORCID iD 0000-0003-3917-0691
Клещев Александр Евгеньевич — ординатор кафедры офтальмологии ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1;
ORCID iD 0009-0008-8420-732X
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Контактная информация: Клещева Елена Александровна, e-mail: klelen@mail.ru
Конфликт интересов отсутствует.
Статья поступила 29.08.2024.
Поступила после рецензирования 23.09.2024.
Принята в печать 16.10.2024.
About the authors:
Elena A. Kleshcheva — C. Sc. (Med.), Associate Professor of the Department of Ophthalmology, Russian Medical Academy of Continuous Professional Education; 2/1, build. 1, Barricadnaya str., Moscow, 125993, Russian Federation; ophthalmologist, S.P. Botkin Moscow Multidisciplinary Scientific and Clinical Center; 5, 2nd Botkin Ave, Moscow, 125284, Russian Federation; ORCID iD 0000-0002-1392-3432
Galina M. Chernakova — C. Sc. (Med.), Associate Professor, Head of Outpatient Department No. 2, Researcher, ophthalmologist, S.P. Botkin Moscow Multidisciplinary Scientific and Clinical Center; 5, 2nd Botkin Ave, Moscow, 125284, Russian Federation; ORCID iD 0000-0002-9630-6076
Natalia V. Melnikova — C. Sc. (Med.), Associate Professor of the Department of Ophthalmology, Russian Medical Academy of Continuous Professional Education; 2/1, build. 1, Barricadnaya str., Moscow, 125993, Russian Federation; ophthalmologist, S.P. Botkin Moscow Multidisciplinary Scientific and Clinical Center; 5, 2nd Botkin Ave, Moscow, 125284, Russian Federation; ORCID iD 0000-0003-3917-0691
Alexander E. Kleshchev — Resident of the Department of Ophthalmology, Russian Medical Academy of Continuous Professional Education; 2/1, build. 1, Barricadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0009-0008-8420-732X
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
Contact information: Elena A. Kleshcheva, e-mail: klelen@mail.ru
There is no conflict of interest.
Received 29.08.2024.
Revised 23.09.2024.
Accepted 16.10.2024.
Информация с rmj.ru
