Содержание статьи
Диагностическая тактика ведения хронического синусита,
сопряженного с хламидийной инфекцией
Е. В. Белова, кандидат медицинских наук
Т. А. Капустина, доктор медицинских наук
А. Н. Маркина, кандидат медицинских наук
ФГБНУ «НИИМПС» СО РАМН, Красноярск
Хламидийная инфекция является серьезной проблемой здравоохранения вследствие
широкого распространения и негативного влияния на здоровье населения. В
последние годы зарубежные и российские ученые рассматривают хламидии в качестве
важного возбудителя, инициирующего воспалительные заболевания верхних отделов
респираторного тракта и среднего уха. Однако представленные сведения по частоте
обнаружения этой инфекции зачастую противоречивы. Так, диапазон разброса
выявления хламидий у больных с патологией носа, околоносовых пазух и глотки
колеблется в значительных пределах: от 7% до 74,4% [1–10]. Такие колебания в
частоте выявления хламидийной инфекции находят свое объяснение в применении
авторами разных по чувствительности и специфичности лабораторных тестов
идентификации хламидий, а также различными методическими подходами в организации
исследования.
Учитывая отсутствие четких патогномоничных клинических симптомов
респираторного хламидиоза, решающее значение для верификации имеет лабораторная
диагностика [4, 6–8], отличающаяся от традиционной, для клинической
бактериологии верификации возбудителей инфекционных заболеваний. Это связано с
биологическими свойствами хламидий, основным из которых является внутриклеточное
существование, подразумевающее невозможность выделения возбудителя на
питательных средах.
В настоящее время для идентификации хламидийной инфекции любой локализации
применяются разнообразные лабораторные методы, отличающиеся друг от друга
выявляемыми маркерами возбудителя, специфичностью и чувствительностью,
трудоемкостью, временными параметрами тестирования, сферой применения,
стоимостью и т. д. Причем чувствительность и специфичность методов исследования
будет разная в зависимости от локализации хламидийной инфекции.
На сегодняшний день самым достоверным и высокоспецифичным методом
непосредственного обнаружения хламидий, но в то же время самым трудоемким,
дорогостоящим и недостаточно распространенным и экстренным является
бактериологический метод культивирования возбудителя in vitro на
чувствительных клетках. Отрицательный результат бактериологического анализа
является пока единственным доказательством отсутствия живых хламидий и
объективным подтверждением эффективности проведенной эрадикационной терапии.
Методы ДНК-диагностики позволяют с высокой точностью идентифицировать
последовательность нуклеотидов в геноме исследуемого инфекционного
микроорганизма (специфичность и чувствительность метода ДНК-диагностики от 90%
до 94,8%). В настоящее время разработан ряд методов амплификации нуклеиновых
кислот, но только один из них нашел применение для выявления хламидийной ДНК (РНК)
— полимеразная цепная реакция. К преимуществам молекулярно-биологических методов
относятся: ранняя диагностика хламидийной инфекции у серонегативных больных,
выявление бессимптомных форм хламидиоза, отсроченный контроль после лечения,
возможность определения широкого спектра возбудителей в одном клиническом
образце. В настоящее время ведутся разработки по использованию методов
амплификации нуклеиновых кислот для изучения генов вирулентности и генов
антибиотикорезистентности хламидий.
Наиболее часто употребляемым методом выявления хламидийного инфицирования
является иммунофлюоресцентный анализ, который уступает по своей специфичности
(65–98%) биологическому методу, а по чувствительности (65–87%) —
генно-молекулярному методу. В основе этого метода лежит взаимодействие
хламидийных антигенов с хламидийными антителами, содержащихся в стандартных
диагностических иммунных сыворотках. Результаты этого взаимодействия
регистрируются объективно с помощью люминесцентного микроскопа, поэтому иногда
этот метод причисляют к бактериоскопическим методам. Для диагностики хламидиоза
верхних дыхательных путей и идентификации вида возбудителя можно применять как
прямой иммунофлюоресцентный метод, так и непрямой иммунофлюоресцентный метод.
Кроме того, данные тесты способны выявлять не только корпускулярные, но и
растворимые антигены хламидий.
К сожалению, отрицательные результаты иммунофлюоресцентного анализа и
ДНК-диагностики являются отсроченными маркерами выздоровления. Это обусловлено
тем, что, результаты этих тестов остаются позитивными в течение 1,5–2 месяцев
после окончания этиотропной терапии до тех пор, пока не элиминируются пассивные
следы инфекции (остатки структур хламидий, погибшие микроорганизмы).
Для серологической диагностики антител в настоящее время наиболее часто
используется иммуноферментный анализ. Применяемые сегодня иммуноферментные
тест-системы для выявления хламидийных антител этим методом более
чувствительные, чем тест-системы для выявления хламидийных антигенов этим же
методом. Это связано с тем, что в качестве антигена в диагностических системах
используются не только родоспецифические фрагменты липополисахарида, но и
видоспецифические белковые детерминанты основного белка наружной мембраны
хламидий, обеспечивающие четкую видовую диагностику. Чувствительность
иммуноферментного анализа для определения хламидийных антител колеблется в
зависимости от применяемых тест-систем от 75% до 95%, специфичность — от 70% до
95%. Достоинством метода является возможность определения иммуноглобулинов
классов G, A и М, а к недостаткам и ограничениям можно отнести
требования специального оснащения и высокой квалификации врачей-лаборантов.
Поскольку хламидии обладают слабой антигенной активностью, наработка и
накопление антител в инфицированном макроорганизме происходит в небольших
количествах, поэтому иммуноферментный анализ наиболее информативен при первичной
острой инфекции и в период реактивации хронической инфекции. Кроме того,
диагностическая значимость этого метода значительно повышается в случаях
генерализации хламидийной инфекции.
К недостаткам иммуноферментного анализа, как и других иммунохимических
методов обнаружения антител, относится то, что даже у здорового населения может
отмечаться фоновый титр антител к хламидиям в результате широких контактов с
хламидиями, не приведших к развитию инфекции, как и у переболевших и
самостоятельно выздоровевших лиц.
Цитологический метод недостаточно информативен для диагностики хламидийной
инфекции из-за низкой чувствительности (от 5% до 30%).
Учитывая недостаточно высокие операционные характеристики каждого из
лабораторных тестов, ряд исследователей предлагают одновременное использование
двух и более лабораторных методов выявления хламидийного возбудителя, однако
данные рекомендации касаются пациентов с патологией урогенитального тракта [11,
12]. В силу сказанного целью настоящего исследования явилась разработка наиболее
эффективного комплекса лабораторных методов диагностики хламидийного
инфицирования слизистой оболочки носа и околоносовых пазух у больных с
хроническим синуситом.
Пациенты и методы исследования
Всего обследовано 168 пациентов в возрасте от 18 до 65 лет, поступивших в
ЛОР-отделение с обострением хронического воспаления околоносовых пазух. Диагноз
синусита подтверждался рентгенологическим исследованием околоносовых пазух.
Шифровка диагнозов осуществлялась по статистической классификации болезней,
травм и причин смерти (МКБ-10). Диагностика ЛОР-заболеваний проводилась по
общепринятой в оториноларингологии семиотике болезней.
Всем больным проводилась верификация двух видов хламидий: Сhlamydia
trachomatis и Chlamydophila pneumoniae. Для выявления хламидийных
структур (антигенов и ДНК) применялись прямой иммунофлюоресцентный метод с
использованием тест-систем «Хламислайд» («Лабдиагностика») и полимеразная
цепная реакция с использованием тест-систем «ВектоХлами-ДНК-ампли»
(«Вектор-Бест»). Видоспецифические противохламидийные иммуноглобулины классов A,
M, G были определены иммуноферментным методом с использованием тест-системы «ХламиБест-стрип»
(«Вектор-Бест»). Материалом для прямой идентификации хламидийного антигена
являлись мазки-соскобы со слизистой оболочки носа.
Учитывая, что хламидии имеют большую тропность к цилиндрическому эпителию,
оптимальными местами для взятия мазков являются участки слизистой оболочки,
покрытые цилиндрическим мерцательным многоядерным эпителием, локализующимся в
области дна полости носа и боковых стенок носа до нижнего края средней носовой
раковины. Забор мазков со слизистой оболочки носа для последующего проведения
иммунофлюоресцентного анализа осуществлялся с помощью стерильного одноразового
зонда с ватным тампоном или стерильной одноразовой специальной щеточкой в
нескольких точках. При этом зонд или щеточка прижимались к поверхности слизистой
оболочки и смещались легким поскабливающим движением. В случаях избытка слизи
или наличия гнойного отделяемого поверхность слизистой оболочки очищалась от них
другим ватным тампоном. Обязательными условиями, определяющими качество забора
материала для исследования, является наличие в мазке неразрушенных эпителиальных
клеток и отсутствие примеси крови. Взятый материал распределялся тонким слоем по
поверхности лунок обезжиренного предметного стекла, подсушивался на воздухе. В
случае невозможности доставки в лабораторию образца в тот же день последний
фиксировался в этиловом спирте 96 °C с последующим хранением при температуре
+4–8 °C не более 7 дней.
Для диагностики хламидийных ДНК методом полимеразной цепной реакции забор
материала осуществлялся так же, за исключением того, что зонд с тампоном или
щеточка опускался в одноразовую пробирку типа «Эппендорф» со специальной
транспортной средой, где последние несколько раз ротировались, затем удалялись
из пробирки, которая плотно закрывалась и доставлялась в лабораторию не позднее
двух часов после взятия биологического образца.
Материалом для проведения серологического метода (иммуноферментного анализа)
являлась венозная кровь в объеме 2,5–3,0 мл, взятая у обследуемых лиц натощак из
локтевой вены в сухую центрифужную пробирку.
Анализируемые качественные признаки представлены в виде относительной частоты
и 95% доверительного интервала (ДИ).
Результаты исследований и их обсуждение
Хламидийные структуры в мазках, взятых со слизистой оболочки носа у больных с
хроническими синуситами, методом полимеразной цепной реакции были обнаружены у
56 исследуемых лиц (в 33,3%, ДИ 26,4–40,6%). В то время как методами прямой
иммунофлуоресценции и иммуноферментного анализа хламидии были верифицированы у
меньшего числа больных: соответственно у 47 (в 27,9%, ДИ 21,5–35%) и 42
пациентов (в 25%, ДИ 18,8–31,8%).
Причем у 7 больных (в 4,2%, ДИ 1,7–7,7%) с положительными результатами
исследования методом прямой иммунофлюоресценции ДНК-диагностика не выявила
наличие хламидийной инфекции. В то время как у 9 больных (в 5,4%, ДИ 2,5–9,3%) с
верифицированным хламидийным возбудителем тестом ДНК-обследование методом прямой
иммунофлюоресценции не подтвердило наличие хламидийной инфекции.
При положительном результате иммуноферментного анализа у 5 больных (в 3%, ДИ
1,0–6,1%) отрицательными оказались оба прямых теста. А у 3 лиц (в 1,79%, ДИ
0,3–4,3%) был отрицательный или прямой иммунофлюоресцентный анализ или
полимеразная цепная реакция.
Снижение чувствительности прямых методов может быть обусловлено неправильным
забором и хранением клинического материала, отсутствием хламидийного возбудителя
в месте забора мазка, полным или частичным разрушением специфических белков и
генома, различным качеством используемых тест-систем. Загрязнение исследуемых
образцов хламидиями при несоблюдении мер для предупреждения контаминации из
внешней среды может быть одной из причин снижения специфичности.
Ложноположительные результаты могут быть получены при отсутствии живых хламидий,
но при наличии их остатков в виде отдельных структур (антигенов, ДНК, РНК).
Кроме этого результаты иммунофлюоресцентного исследования определяются
субъективизмом и квалификацией врача-лаборанта.
Таким образом, вероятность получения как ложноотрицательных, так и
ложноположительных результатов лабораторных методов диагностики хламидийной
инфекции определяет необходимость в их комплексном применении. Одновременное
использование двух прямых и одного непрямого тестов лабораторной диагностики
позволило установить наличие хламидийной инфекции у 61 из 168 обследуемых
больных (в 36,9%, ДИ 29,2–43,7%).
Сопоставление результатов всех трех лабораторных методов исследования
определяет тактику ведения пациентов с подозрением на хламидийное инфицирование
слизистой оболочки верхних дыхательных путей (табл.).
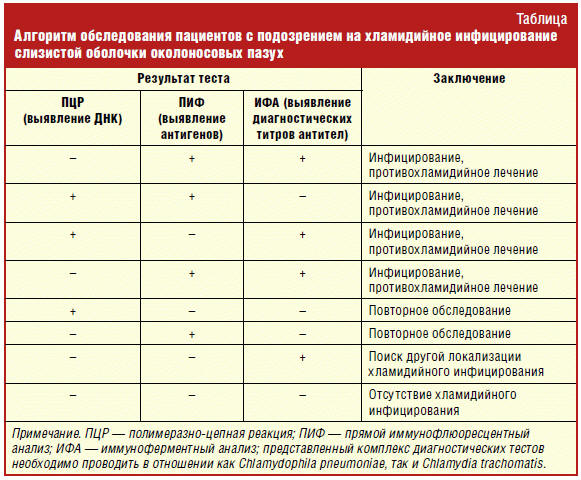
Так, положительные результаты трех или двух методов указывают на наличие
хламидийной инфекции, требующей назначения этиологического лечения. Обнаружение
хламидий в мазках со слизистой оболочки верхних дыхательных путей одним из двух
прямых тестов при отрицательном результате иммуноферментного анализа не может
трактоваться однозначно, и в этом случае необходимо повторное исследование.
Положительные результаты серологического анализа не позволяют выявить очаг
хламидийной инфекции, но при наличии отрицательного результата прямого метода
выявления хламидийного возбудителя из предполагаемого очага поражения нацеливают
врача на повторную индикацию возбудителя или на поиск другой локализации
хламидий. Необходимо учитывать и тот факт, что отрицательные результаты
серологических тестов не исключают наличие персистирующей хламидийной инфекции.
Заключение
Неравнозначное диагностическое значение разных методов лабораторной
диагностики хламидийного поражения определяет необходимость комплексного
использования диагностических тестов для верификации хламидий у больных с
воспалительными заболеваниями носа и околоносовых пазух. Наиболее оптимальным
комплексом является одновременное применение двух прямых и одного непрямого
методов. Результаты лабораторных методов идентификации хламидийного возбудителя
обязательно должны сопоставляться с анамнестическими сведениями, клиническими
проявлениями заболевания и данными объективного осмотра ЛОР-органов.
Применение лабораторного комплекса позволяет повысить эффективность
диагностики воспалительных заболеваний носа и околоносовых пазух,
ассоциированных с хламидийной инфекцией, а также определить диагностическую
тактику ведения пациентов с этой инфекцией.
Предложенный алгоритм лабораторной диагностики можно использовать не только
для доказательства или опровержения хламидийного инфицирования, но и в качестве
контроля результативности проводимых противохламидийных лечебных мероприятий. Во
избежание получения ложноположительных результатов проверку качества лечения
следует проводить по истечении 1,5 месяцев после окончания эрадикационной
терапии, т. к. только к этому сроку наступает полная элиминация пассивных следов
инфекции и смена эпителиального покрова [13–15].
Важность предложенного комплекса лабораторной диагностики хламидийной
инфекции данной локализации будет способствовать своевременному назначению
этиотропного лечения определенными группами антибиотиков (макролидами,
фторхинолонами, тетрациклинами), элиминирующими возбудителя, укорочению периода
обострения заболевания, снижению вероятности осложнений и формирования тяжелых
форм болезни, предотвращению диссеминации хламидий в организме с последующим
развитием экстрареспираторных очагов поражения [16–18].
Литература
-
Белова Е. В. Клинико-эпидемиологические аспекты хламидийного
инфицирования верхнего отдела респираторного тракта у детей: автореф. … канд.
мед. наук. Красноярск, 2008. 22 с. -
Капустина Т. А., Белова Е. В., Манчук В. Т., Кин Т. И.
Инфицированность хламидиями детей с хроническими заболеваниями носоглотки и
придаточных пазух носа // Российский вестник перинатологии и педиатрии. 2006.
Т. 51. № 6. С. 65–66. -
Маркина А. Н., Капустина Т. А., Белова Е. В., Парилова О. В. и
др. Распространенность хламидийной инфекции у взрослых лиц с заболеваниями
верхних дыхательных путей // Успехи современного естествознания. 2006. № 2. С.
50. -
Лайко А. А., Бредун А. Ю. Роль хламидийно-бактериальных
ассоциаций в развитии хронического верхнечелюстного синусита у детей // Рос.
ринология. 2005. № 2. С. 188. -
Линьков В. И., Цурикова Г. П., Нуралова И. В., Панькина Н. А.
Значение хламидийной инфекции в развитии хронических воспалительных
заболеваний глотки/Тез. докл. XV Российского съезда отоларингологов. СПб,
1995. С. 164. -
Лиханова М. А., Мингалев Н. В., Лебедева Р. Н. Роль хламидийной
инфекции при аллергической риносинусопатии // Вестн. оториноларингологии.
2006. № 5. С. 244–245. -
Нечаева С. В., Полякова Т. С., Чувиров Г. Н. Хламидийная и
микоплазматическая инфекция у больных хроническим риносинуситом/Тез. докл.
науч. конф. современные проблемы оториноларингологии. М., 2002. С. 89. -
Сидоренко И. В. Место атипичной флоры в этиологии хронических
синуситов и выявление ее методом ПЦР-диагностики // Рос. ринология. 2004. № 4.
С. 32–34. -
Andersen P. Pathogenesis of lower respiratory tract infections
due Chlamydia, Mycoplasma, Legionella and viruses // Thorax. 1998. V. 53. № 4.
P. 302–307. -
Falck G., Heyman L., Gnarpe J., Gnarpe Н. Chlamydia pneumonia and
chronic pharyngitis // Scand. J. Infect. Dis. 1995. V. 27. № 2. P. 179–182. -
Сидорович С. Ю., Латыпова М. Ф., Коликова Т. Г., Вахнина Т. Е. и
др. Сравнительный анализ методов лабораторной диагностики урогенитального
хламидиоза // Вестник дерматологии и венерологии. 2001. № 1. С. 9–10. -
Шевченко Е. А. Особенности биохимических и иммунологических
показателей при хламидиозе, микоплазмозе и уреаплазмозе. Автореф. … канд. мед.
наук. Н. Новгород, 2002, 24. -
Гавалов С. М. Хламидиоз — дисбактериоз. Интегральные
взаимоотношения. Новосибирск: РТФ, 2003. 219 с. - Гранитов В. М. Хламидиозы. М.: Мед. кн., 2002. 192 с.
-
Лобзин Ю. В., Ляшенко Ю. И., Позняк А. Л. Хламидийные инфекции.
СПб: Фолиант, 2003. 395 с. -
Белова Е. В., Капустина Т. А., Парилова О. В., Маркина А. Н.
Антибактериальное лечение детей с острым верхнечелюстным синуситом,
ассоциированным с хламидийной инфекцией // Лечащий Врач. 2014. № 10. С. 25–29. -
Страчунский Л. С., Козлов С. Н. Современная антимикробная
химиотерапия: Руководство для врачей. М.: Боргес, 2002. 429 с. -
Аверьянов А. В. Хламидийная и микоплазменная инфекция при
патологии нижних дыхательных путей // Лечебное дело. 2009. № 4. С. 52–62.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru


