Введение
Аллергический ринит (АР) — воспалительное заболевание слизистой оболочки носа, опосредованное воздействием IgE, вызванное контактом с сенсибилизирующим аллергеном и проявляющееся как минимум двумя симптомами из следующих: чиханье, зуд, ринорея, заложенность носа [1–3]. АР — наиболее часто встречающееся иммунозависимое заболевание человека с распространенностью до 50% в некоторых странах [4]. Несмотря на то, что его значимость недооценивается, это заболевание представляет собой глобальную проблему для здравоохранения, обусловленную распространенностью [2, 5], негативным влиянием на качество жизни и социальную активность пациентов [2, 6], успеваемость в школе и производительность труда [7, 8]. Кроме того, АР связан с бронхиальной астмой и патологией ЛОР-органов [9, 10]. Все перечисленные факторы определяют значительное социально-экономическое бремя этого заболевания [9, 11, 12].
Экспертами консенсуса ARIA (Allergic Rhinitis and its Impact on Asthma), международными и национальными консенсусными документами рекомендуется достижение полного контроля симптомов АР в качестве основной цели его лечения [4, 13]. К основным принципам лечения АР относят: элиминационные мероприятия, медикаментозную терапию, аллерген-специфическую иммунотерапию1.
Для фармакотерапии АР применяют препараты следующих классов (согласно точкам приложения): обратные агонисты Н1-гистаминовых рецепторов (антигистаминные препараты, АГП), интраназальные глюкокортикостероиды (инГКС), антагонисты лейкотриеновых рецепторов (АЛР), а также стабилизаторы мембран тучных клеток (кромоны). Выбор того или иного метода фармакотерапии определяется выраженностью симптомов заболевания, эффективностью воздействия лекарственного препарата на отдельные симптомы и течение заболевания в целом1.
Лечение АР основано на ступенчатом принципе, что означает увеличение объема терапии в зависимости от появления симптомов и тяжести заболевания. Согласно ступенчатому подходу, на 1-й ступени можно выбрать препарат одной из групп: АГП II поколения (системные или топические), АЛР либо кромоны; на 2-й ступени применяют препараты тех же групп либо инГКС (что предпочтительно); на 3-й ступени, часто соответствующей среднетяжелой и тяжелой формам АР (≥5 по по 10-сантиметровой визуальной аналоговой шкале (ВАШ)), в зависимости от степени выраженности назальных и глазных симптомов рекомендуется комбинация инГКС с препаратом одной или более вышеуказанных групп лекарственных средств1. Как правило, на данном этапе терапии достигают контроля симптомов. Если контроль не достигнут, переходят на 4-ю ступень: рассматривают генно-инженерную биологическую терапию, хирургическое лечение либо пересматривают диагноз1.
Таким образом, на 2-й ступени фармакотерапии врач сталкивается с ситуацией выбора группы препаратов для лечения пациента и, как правило, выбирает между АГП II поколения и инГКС. Регулярные систематические обзоры международных рандомизированных контролируемых исследований (РКИ) описывают высокую безопасность и эффективность препаратов обеих групп в отношении общих назальных и глазных симптомов [14–16].
Высокая эффективность и безопасность цетиризина доказана при сезонном и круглогодичном АР у детей, подростков и взрослых [17–20]. Многолетний положительный опыт широкого клинического применения этого препарата до сих пор позволяет ему выступать в качестве эталона при разработке новых фармакотерапевтических препаратов для лечения АР и конкурировать с ними в эффективности и безопасности [21, 22]. Несмотря на быстрое и эффективное облегчение симптомов ринита, ряд пациентов, принимавших участие в клинических исследованиях цетиризина, сообщали о развитии нежелательных явлений (НЯ). Регистрируемыми событиями, статистически не различимыми среди участников основной группы и контрольной группы (получающей плацебо), являлись дозозависимая сонливость и головная боль [23]. Кратковременность и слабая выраженность НЯ при применении неседативных АГП у пациентов с АР не сопоставимы с преимуществами быстрого устранения симптомов: зуда в полости носа, чиханья, ринореи и заложенности носа. Монотерапия цетиризином достаточна при легком и среднетяжелом течении заболевания, а также при отсутствии выраженного нарушения носового дыхания1.
Интраназальные глюкокортикостероиды ингибируют как раннюю, так и позднюю фазу аллергической реакции, редуцируя эозинофильное воспаление и влияя на все клинические проявления, включая заложенность носа. Вместе с тем они не абсорбируются в системный кровоток и не вызывают системных НЯ [24]. ИнГКС превосходят АГП системного действия, эффективно уменьшая выраженность всех симптомов за счет противоаллергического, противовоспалительного и сосудосуживающего действия. Обоснованием использования топических глюкокортикостероидов в лечении АР служит возможность достижения адекватных концентраций препарата на рецепторных участках слизистой оболочки носа. Это быстро приводит к контролю симптомов и снижает риск системных НЯ. Первый крупный мета-анализ международных клинических исследований, опубликованный в 2008 г., представил доказательства (уровень IА) эффективности инГКС при лечении АР по сравнению с плацебо [25]. Доказана также высокая профилактическая эффективность инГКС при поллинозе [26].
Доступные в настоящее время инГКС отличаются по своим фармакологическим характеристикам, определяющим их свойства [24, 27]. При сравнении эффективности инГКС используют терапевтический индекс (ТIX) — соотношение суммарной эффективности и суммарной безопасности [28]. В метаанализе 84 РКИ и отчетов по безопасности шести инГКС, назначавшихся для лечения АР в период с 1966 г. по июнь 2009 г., у мометазона фуроата оказался максимальный TIX (т. е. максимальная эффективность и минимальное количество НЯ) [28].
Ряд исследований демонстрируют преимущества мометазона фуроата, обладающего наибольшим сродством к глюкокортикоидному рецептору, выраженной быстрой противовоспалительной активностью, минимальной системной биодоступностью и хорошей переносимостью у детей, подростков и возрастных пациентов с сезонным и круглогодичным АР [29–33]. Метаанализ клинических исследований с участием 2998 пациентов четко демонстрирует достоверное устранение симптомов сезонного и круглогодичного АР при применении мометазона фуроата в стандартной дозировке 200 мкг 1 р/сут [34]. Отмечается также значительное уменьшение глазных симптомов, включая зуд и жжение в глазах и слезотечение, у пациентов при применении мометазона фуроата по сравнению с плацебо (p<0,05) [35].
Проведенные сравнительные исследования пероральных АГП и инГКС, обобщенные в метаанализах, демонстрируют превосходство назальных стероидов в улучшении общего показателя назальных симптомов (заложенность носа, зуд в носу и чиханье, качество жизни). В то же время существенных различий в отношении глазных симптомов не отмечается [36]. Сравнительная оценка мометазона фуроата и цетиризина в отношении назальных симптомов и качества жизни пациентов с АР также показала преимущества интраназального мометазона фуроата перед пер-оральным цетиризином (общая оценка назальных симптомов — р=0,001, оценка качества жизни — р=0,003) при достаточной эффективности каждого препарата [37].
Среди всех спреев мометазона фуроата можно отметить первый российский безрецептурный препарат Нозефрин Алерджи (АО «ВЕРТЕКС», Россия), который предназначен для лечения сезонного и круглогодичного АР у взрослых с 18 лет и старше и значительно облегчает симптомы заложенности носа, ринита, чиханья, зуда в носу, слезотечения. Препарат выпускают в форме назального дозированного спрея (50 мкг/доза) во флаконе 18 г (120 доз). Для изучения особенностей и результатов применения этого препарата было проведено представленное исследование. Следует отметить, что в регионах Российской Федерации (РФ), где проводилось это исследование, оно оказалось особенно актуальным в связи со значительной распространенностью пыльцевой и грибковой сенсибилизации среди местного населения [38, 39].
Цель исследования: оценить в условиях реальной клинической практики эффективность и безопасность лечения АР назальным спреем мометазона фуроата по сравнению с цетиризином у пациентов, нуждающихся в терапии 2-й ступени.
Материал и методы
Дизайн исследования
Проведено наблюдательное открытое сравнительное неинтервенционное двухцентровое исследование на базе двух российских клинических центров в соответствии с действующим законодательством РФ и Евразийского экономического союза, а также общепринятыми международными этическими принципами GCP (Good Clinical Practice). Все пациенты добровольно подписали информированное согласие на участие в исследовании.
Критерии включения в исследование: возраст 18–75 лет; подтвержденный диагноз сезонного АР; потребность в терапии 2-й ступени: интенсивность хотя бы одного назального симптома (заложенность носа, ринорея, зуд в носу, чиханье) не менее 7 см (баллов) по ВАШ.
Критерии невключения в исследование: беременность; известная гиперчувствительность к любому компоненту исследуемых препаратов; тяжелая аллергическая реакция в анамнезе на любой из исследуемых препаратов; патология носа, включая полипы, перенесенные травмы, хирургические вмешательства, анатомические аномалии, атрофический и медикаментозный ринит, хронический синусит, частые носовые кровотечения; прием запрещенных протоколом препаратов менее чем за 2 дня до включения в исследование и планируемый их прием на протяжении исследования; прием системных или топических глюкокортикостероидов и антибактериальных препаратов менее чем за 4 нед. до включения в исследование; клинически значимые патологические состояния, которые могут влиять на приверженность терапии или выживаемость пациентов в ближайшее время.
Все пациенты были распределены в 2 группы по 80 человек: основную группу (ОГ), получавшую препарат Нозефрин Алерджи по 2 впрыскивания в каждый носовой ход 1 р/сут, и группу сравнения (ГС) с применением цетиризина 10 мг 1 р/сут внутрь. Препараты назначались в соответствии с инструкцией. Пациенты могли применять деконгестанты по потребности, барьерные препараты, изотонические солевые интраназальные средства.
Наблюдение продолжительностью 1 мес. ± 2 дня включало первичный осмотр, лечение и заключительное обследование. За время участия в исследовании пациенты совершили три визита (V): V1 — первичный осмотр; V2 — осмотр на 7±3 сут терапии; V3 — заключительное обследование на 28±2 сут наблюдения и терапии.
В рамках исследования проводили физикальный осмотр пациентов (оценка общего внешнего вида, обследование кожных покровов, шеи, глаз, легких, сердца, живота, лимфатических узлов), переднюю риноскопию (обращали внимание на любые изменения носовой полости), анкетирование (оценка эффективности лечения по ВАШ, заполнение адаптированного опросника RQLQ (Rhinoconjunctivitis Quality of Life Questionnaire) о влиянии применения исследуемых препаратов на качество жизни). Также оценивали переносимость лечения и заполняли при необходимости стандартную форму по фармаконадзору.
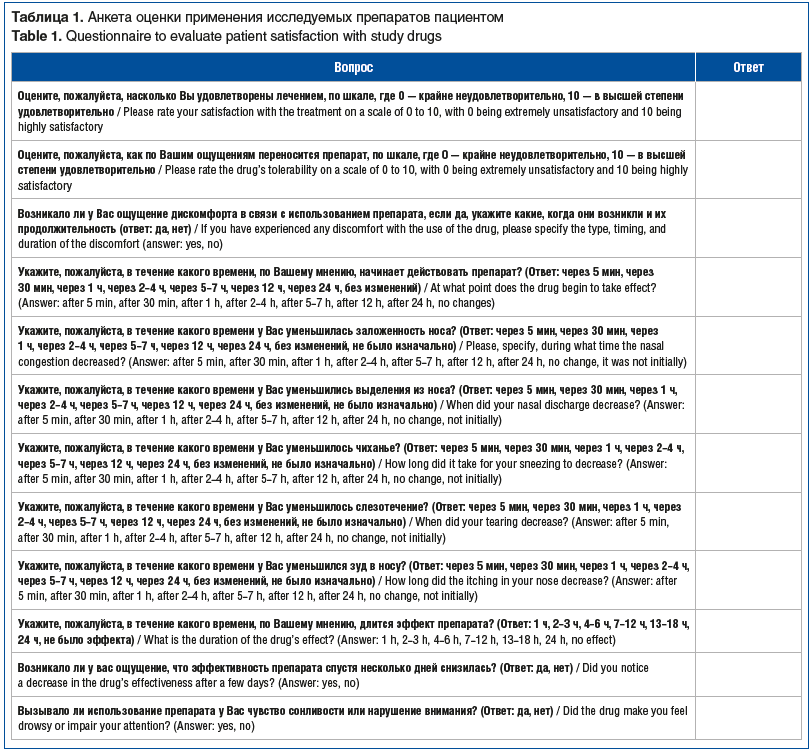
Анкета оценки применения исследуемых препаратов
Эффективность исследуемого препарата оценивали как пациент, так и врач: анкета пациента включала 12 вопросов (табл. 1), анкета врача — 5 вопросов (табл. 2).

Оценка качества жизни
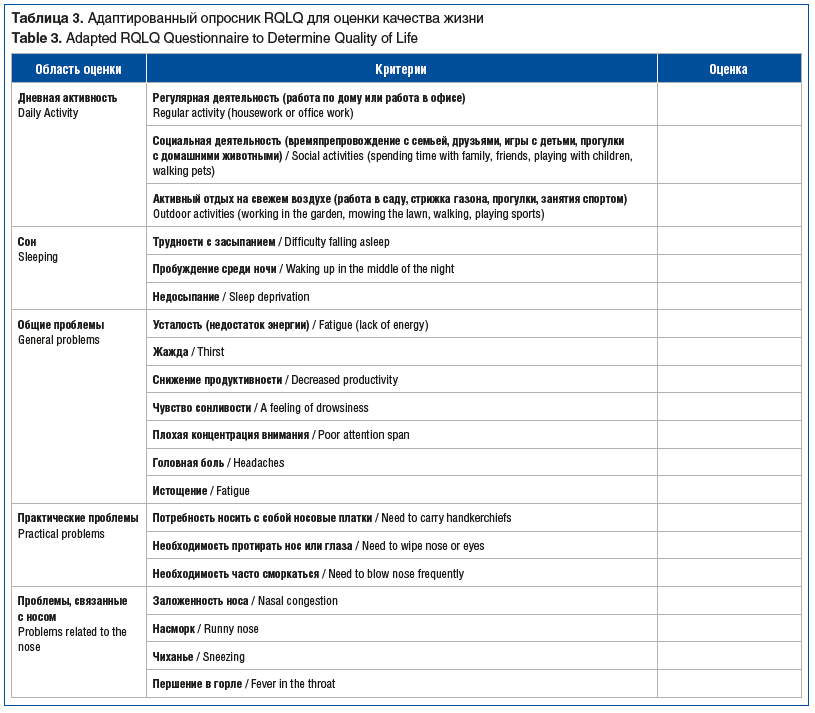
Для оценки качества жизни пациентов использовали адаптированный к реальным условиям опросник RQLQ [4]. В оригинальной версии этого опросника, разработанного E. Juniper et al. [40], элементы стандартизированы для всех пациентов с аналогичной проблемой. Адаптированный нами опросник RQLQ включал оценку следующих аспектов: дневная активность; сон; общие проблемы; практические проблемы; проблемы, связанные с носом; проблемы, связанные с глазами; эмоциональные проблемы (табл. 3).
Оценка эффективности и безопасности
Эффективность препаратов оценивали на основании данных ВАШ. Основной критерий эффективности — доля пациентов, достигших полного излечения либо полного контроля над симптомами в конце терапии (на момент окончания лечения). Полным излечением считали отсутствие симптомов по ВАШ (0 баллов), полный контроль над симптомами — ВАШ <2 баллов. Вторичные критерии: доля пациентов, достигших снижения выраженности симптомов на 7-е сутки терапии; доля пациентов с улучшением качества жизни по результатам опросника RQLQ; доля пациентов, у которых отсутствовала сонливость при применении препаратов.
Безопасность оценивали по частоте возникновения НЯ.
Статистическая обработка результатов
Статистическая обработка осуществлялась с применением программы IBM SPSS Statistics (версия 23). В качестве описательных статистик для количественных показателей рассчитаны средние значения и средние квадратичные отклонения; медиана и квартили; минимальные и максимальные значения в выборке. В качестве описательных статистик для качественных показателей посчитаны доли (%). Для сравнения показателей использовали U-критерий Манна — Уитни. Частоты в четырехпольных таблицах (2×2) сравнивали с помощью точного теста Фишера, частоты в результатах анкетирования с несколькими вариантами ответа — с помощью точного теста Фишера 2×N. Средние внутригрупповые показатели в группах в различные визиты, с целью подтверждения значимости внутригруппового клинического эффекта, сравнивали с использованием критерия Фридмана. Различия считали статистически значимыми при р<0,05.
Результаты исследования
Характеристика пациентов
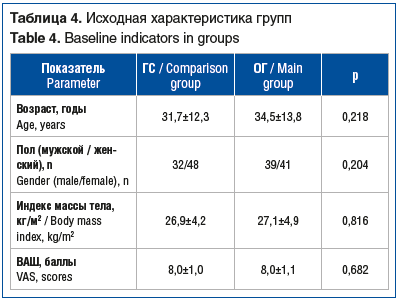
В исследование включено 160 амбулаторных пациентов (из них 87 (54,4%) мужчин) в возрасте от 18 до 67 лет (средний возраст 33,1±13,1 года).
Группы лечения статистически значимо не различались по демографическим и базовым характеристикам (пол, возраст, индекс массы тела, ВАШ) (табл. 4).
Исследование в соответствии с протоколом завершили 100% пациентов: все соблюдали режим приема препаратов, ни один пациент досрочно не прекратил участие в исследовании, в том числе с зарегистрированными кратковременными НЯ.
Сравнительный анализ показателей после лечения
Основной критерий: доля пациентов, достигших полного излечения
Доля пациентов, достигших полного излечения, в ГС составила 20,0%, тогда как в ОГ — 32,5%, однако результат оказался статистически незначимым.
В ГС эффективность терапии на момент окончания лечения оценивалась как отличная (0–1 балл по ВАШ) у 52 (65%) пациентов, в ОГ — у 76 (95%) (р<0,05); как хорошая (2–5 баллов по ВАШ) у 12 (15,0%) и у 4 (5,0%) соответственно (р<0,05); как удовлетворительная (>5 баллов по ВАШ) у 16 (20,0%) пациентов ГС, в ОГ таких пациентов не оказалось.
Вторичные критерии
Динамика выраженности симптомов
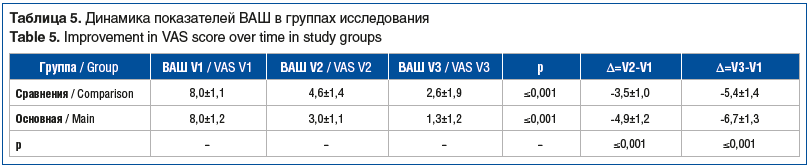
Все пациенты достигли статистически значимого снижения выраженности симптомов по ВАШ. Сравнение баллов по ВАШ (Δ=V2-V1) среди пациентов, достигших уменьшения выраженности симптомов на 7-е сутки терапии, продемонстрировало статистически значимые различия: у пациентов ОГ выраженность симптомов снизилась в большей степени. Динамика снижения выраженности симптомов по ВАШ к 28-му дню лечения в ОГ также оказалась статистически значимо более существенной (табл. 5).
Динамика качества жизни
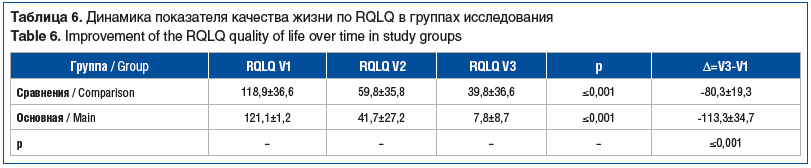
Все пациенты достигли улучшения качества жизни, что подтверждено статистически значимым улучшением показателей по опроснику RQLQ в обеих группах. Сравнение уровня снижения баллов по опроснику RQLQ (Δ=V3-V1) среди пациентов, достигших улучшения качества жизни на 28-е сутки терапии, продемонстрировало статистически значимое преимущество в пользу пациентов ОГ (табл. 6).
Сонливость после применения препарата
Отсутствие сонливости отметили 80% пациентов ГС, тогда как в ОГ этот показатель достиг 98,8% (р≤0,001).
Безопасность
Нежелательные явления на фоне проводимого лечения в ГС были зарегистрированы у 26 (32,5%) пациентов, тогда как в ОГ — у 12 (15,0%) (р=0,015). Все НЯ бы легкими и ни в одном случае не потребовали отмены препарата.
Оценка лечения пациентами
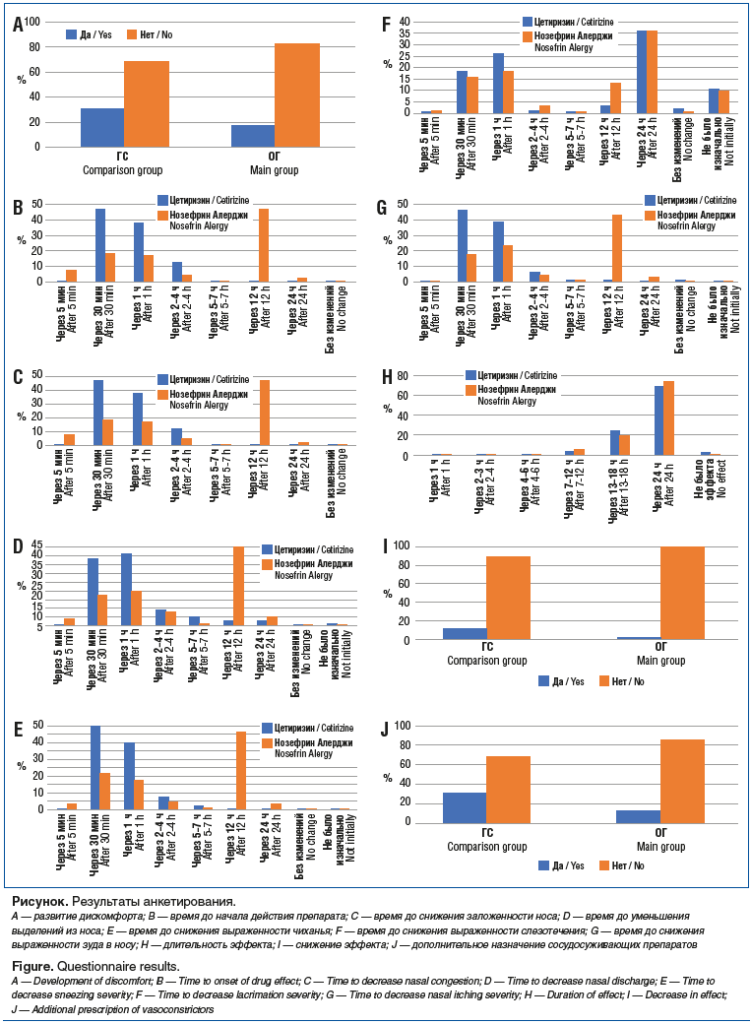
Сравнение оценки пациентами лечения различными препаратами по шкалам удовлетворенности и переносимости продемонстрировало статистически значимые различия. Так, средний показатель по 10-балльной шкале удовлетворенности в ГС и ОГ составил 7,8±1,2 и 9,2±0,9 соответственно (р≤0,001), по 10-балльной шкале переносимости — 8,3±1,3 и 9,4±0,8 соответственно (р≤0,001). Сравнение долей пациентов, у которых отсутствовал дискомфорт, не выявило статистически значимых различий: показатели составили 68,7 и 82,5% соответственно (р=0,065) (см. рисунок, А).
Сравнение групп по показателю времени до начала действия препарата продемонстрировало статистически значимые различия (р≤0,001): цетиризин начинал действовать уже в начале 1-го часа применения, быстрее, чем мометазона фуроат (см. рисунок, В). Также было установлено статистически значимое различие в отношении скорости снижения выраженности заложенности носа, выделений из носа, чиханья и зуда в носу (р=0,001) (см. рисунок, С, D, E, G). При сравнении скорости от начала действия препаратов до снижения выраженности слезотечения статистически значимых различий не выявлено (р=0,193) (см. рисунок, F). Группы не различались по продолжительности эффективного действия препарата (р=0,429) (см. рисунок, Н). Однако статистически значимо различалась скорость снижения эффективности препаратов (р=0,003). Нозефрин Алерджи начинал действовать позднее, однако его эффективность не снижалась (см. рисунок, I).
Оценка лечения врачом
Анализ данных анкетирования врачей, оценивающих результаты лечения по шкалам удовлетворенности, переносимости и эффективности в группах исследования, продемонстрировал статистически значимые межгрупповые различия. Так, средний показатель по шкале удовлетворенности в ГС и ОГ составил 7,9±1,1 и 9,4±0,8 соответственно (р≤0,001), по шкале переносимости — 8,6±1,3 и 9,7±1,4 (p≤0,001), по шкале эффективности — 7,8±1,3 и 9,3±0,8 соответственно (р≤0,001).
В ОГ по сравнению с ГС статистически значимо реже возникала потребность в дополнительном к основному лечению использовании сосудосуживающих препаратов (р=0,013) (см. рисунок, J).
Как было отмечено выше, НЯ в ОГ развивались статистически значимо (р=0,015) реже.
Обсуждение
Необходимо отметить недопустимость игнорирования сезонных обострений АР и важность своевременного лечения с целью достижения контроля симптомов заболевания, исходя из того, что АР — известный фактор риска развития бронхиальной астмы [41].
Полученное значение стандартизованной разности средних показателей снижения выраженности симптомов АР в группах исследования продемонстрировало не меньшую эффективность лечения Нозефрином Алерджи в сравнении с цетиризином. Наши данные согласуются с результатами исследования [42], продемонстрировавшего, что клинически значимый терапевтический эффект мометазона фуроата наступал в течение 3–4 ч от начала лечения и оценивался пациентами и врачами как отличный (56 и 61% соответственно) и хороший (34 и 30% соответственно).
На фоне лечения обоими препаратами нормализовался сон, восстановилась дневная активность и трудовая деятельность, в результате улучшилась оценка качества жизни пациентов (см. табл. 5). При этом 16 (20%) пациентов ГС и 1 (1,2%) пациент ОГ отмечали сонливость в течение дня, которая со временем перестала ощущаться. Метаанализ РКИ применения цетиризина за 30-летний период показал высокую вариабельность данных о седативном эффекте препарата: от 1,03 до 6,51% в зависимости от вводного периода терапии [43]. Ряд авторов отмечают, что сонливость при приеме цетиризина зависит от дозы и возникает у 6% пациентов, получающих плацебо, и у 14% пациентов, получающих цетиризин в дозе 10 мг [44]. Долгосрочные наблюдательные исследования показывают, что частота седации снижается со временем при продолжении приема препарата [45].
Таким образом, полученные результаты демонстрируют высокую эффективность препаратов 2-й ступени лечения АР. Анализ динамики клинических показателей свидетельствует о выраженном подавлении симптомов ринита и сопутствующего конъюнктивита при лечении как цетиризином 10 мг, так и назальным спреем мометазона фуроата 200 мкг/сут. Уже по истечении 1 нед. были достигнуты статистически значимые положительные изменения большинства исходных симптомов АР. Продолжение лечения до 28 дней позволило добиться полного исчезновения симптомов у 52 (65%) пациентов в ГС и у 76 (95%) в ОГ и хорошего контроля у 12 (15,0%) и у 4 (5,0%) пациентов соответственно. Даже заложенность носа, обусловленная воспалением его слизистой оболочки, при котором антигистаминные препараты недостаточно эффективны, поддавалась контролю. Лишь у 16 (20,0%) пациентов в ГС монотерапия была недостаточной, что в дальнейшем, после завершения периода наблюдения, потребовало добавления инГКС.
Потребность в дополнительном использовании симптоматической терапии АР деконгестантами отмечена у 16 (20,0%) пациентов в ГС в первые 3–5 дней лечения. Стоит отметить, что при недостаточной эффективности антигистаминных препаратов пациенты самостоятельно используют сосудосуживающие спреи для устранения заложенности носа, однако длительное их применение может привести к развитию привыкания и медикаментозному риниту [46].
В настоящем исследовании частота НЯ не превышала регистрируемую в многочисленных РКИ [42–45, 47–55]. Развившиеся побочные эффекты, будучи «класс-специфическими», соответствовали возможным НЯ, описанным в инструкции по применению препаратов. Ни одно из возникших НЯ не было серьезным, не повлекло досрочного исключения пациента из исследования, не ухудшило качество жизни, зависящее от здоровья, что подтверждают показатели опросника RQLQ, которые на протяжении всего исследования оказывались лучше, чем исходные. В целом в обеих группах отмечено стойкое улучшение качества жизни и состояния здоровья, которые оценивали с помощью надежного спе-цифического валидизированного инструмента — опросника RQLQ. Однако, с учетом легкого седативного эффекта у ряда пациентов ГС, статистически значимо лучшие показатели шкалы качества жизни получены в ОГ.
В целом переносимость препаратов и удовлетворенность лечением у подавляющего большинства пациентов были хорошими и отличными в обеих группах.
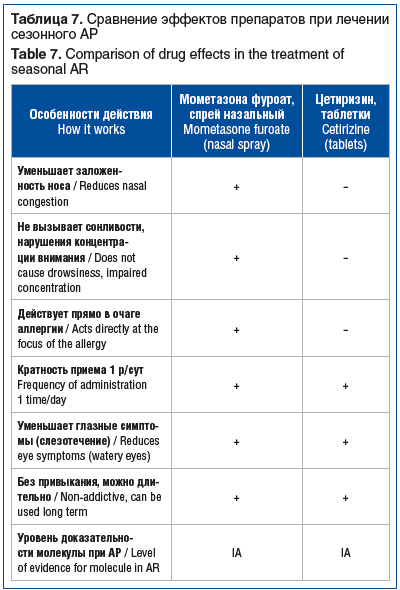
Подводя итоги, хочется обратить внимание на ряд преимуществ назального спрея Нозефрин Алерджи в сравнении с цетиризином у пациентов с сезонным АР (табл. 7)1,2,3.
Заключение
Результаты настоящего исследования говорят о том, что инГКС мометазона фуроат (Нозефрин Алерджи) превосходит по силе действия Н1-гистаминовый блокатор цетиризин, его применение позволяет эффективно контролировать симптомы АР, уменьшает заложенность носа и восстанавливает носовое дыхание, способствует уменьшению выраженности глазных симптомов у пациентов с сопутствующим аллергическим конъюнктивитом (за счет подавления назоокулярного рефлекса), способствует повышению качества жизни пациента при более низкой частоте НЯ. Препарат может быть рекомендован в качестве монотерапии у взрослых больных АР легкого и среднетяжелого течения и в комплексной терапии у больных АР тяжелого течения. Кроме того, можно рассматривать этот препарат как компонент комплексной терапии медикаментозного ринита, обусловленного чрезмерным применением топических деконгестантов. Высокая эффективность, безопасность, низкая стоимость (относительно своих аналогов), безрецептурная доступность делают выбор инГКС у взрослых пациентов с АР предпочтительным.
1Клинические рекомендации. Аллергический ринит. 2020. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/recomend/261_1?ysclid=lu5vnfmcdp107856427 (дата обращения: 18.12.2023).
2Инструкция по медицинскому применению лекарственного препарата Нозефрин Алерджи. (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=aa596026-d9a4- 40de-a50e-5a3f3a945a65 (дата обращения: 15.01.2024).
3Инструкция по медицинскому применению препарата Цетиризин-ВЕРТЕКС. (Электронный ресурс.) URL: https://www.rlsnet.ru/drugs/cetirizin-verteks-82369?ysclid=lubwx4kiwd523594028 (дата обращения: 15.01.2024).
Сведения об авторах:
Чурюкина Элла Витальевна — к.м.н., доцент, врач аллерголог-иммунолог высшей категории, начальник отдела аллергических и аутоиммунных заболеваний НИИАП ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; доцент кафедры клинической иммунологии, аллергологии и лабораторной диагностики ФПК и ППС ФГБОУ ВО КубГМУ; 350063, Россия, г. Краснодар, ул. им. Митрофана Седина, д. 4; ORCID iD 0000-0001-6407-6117.
Гамова Инна Валерьевна — к.м.н., доцент, и. о. зав. кафедрой клинической иммунологии и аллергологии ФГБОУ ВО Саратовский ГМУ им. В.И. Разумовского Минздрава России; 410012, Россия, г. Саратов, ул. Большая Казачья, д. 112; ORCID iD 0000-0002-0128-5883.
Контактная информация: Чурюкина Элла Витальевна, e-mail: echuryukina@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 08.02.2024.
Поступила после рецензирования 04.03.2024.
Принята в печать 27.03.2024.
About the authors:
Ella V. Churyukina — C. Sc. (Med.), Associate Professor, Head of the Division of Allergic and Autoimmune Diseases, Rostov State Medical University; 29, Nakhichevanskiy lane, Rostov-on-Don, 344022, Russian Federation; associate professor of the Department of Clinical Immunology, Allergy, and Laboratory Diagnostics, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD 0000-0001-6407-6117.
Inna V. Gamova — C. Sc. (Med.), Associate Professor, Interim Head of the Department of Clinical Immunology and Allergy, V.I. Razumovskiy Saratov State Medical University; 112, Bolshaya Kazach’ya str., Saratov, 410012, Russian Federation; ORCID iD 0000-0002-0128-5883.
Contact information: Ella V. Churyukina, e-mail: echuryukina@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 08.02.2024.
Revised 04.03.2024.
Accepted 27.03.2024.
Информация с rmj.ru






