Введение
По данным Федерального регистра сахарного диабета, в Российской Федерации продолжается неуклонный рост распространенности сахарного диабета (СД) не только за счет увеличения количества пациентов с СД 2 типа [1]. За 3 последних года прирост числа пациентов с СД 1 типа (СД1) достиг более 15 тыс. человек, и на начало 2022 г. количество больных с СД1, по данным регистра СД, составило 271 468 человек (5,6% от общего количества больных, зарегистрированных в РФ) [2]. Снижение трудоспособности и ранняя инвалидизация этой категории больных, обусловленные сосудистыми осложнениями, ведут к значительному снижению как качества жизни, так и ее продолжительности [3]. Хроническая гипергликемия запускает целый каскад патологических изменений, влекущих за собой дисфункцию эндотелия, дисбаланс окислительно-восстановительных процессов, способствующих не только развитию макро- и микрососудистых осложнений, но и вегетативной нейропатии сосудов и сердца, которая способствует ухудшению прогноза сердечно-сосудистых заболеваний при СД [3, 4]. Диастолическая дисфункция левого желудочка (ДД ЛЖ), которая развивается без четкой связи с атеросклеротическим поражением коронарных артерий и артериальной гипертензией у больных СД, в настоящее время рассматривается как диабетическая кардиомиопатия [4–7]. Отдельные аспекты развития диабетической кардиомиопатии на молекулярно-клеточном уровне остаются по-прежнему недостаточно изученными и дискуссионными, особенно у пациентов с СД1 [4, 8]. Поражение миокарда при СД обусловлено не только метаболическими нарушениями, микрососудистыми осложнениями, связанными в первую очередь с развитием эндотелиальной дисфункции, но и процессами фиброза [4, 8], приводящими в конечном итоге к развитию сердечной недостаточности [9]. Оксид азота (NO) является ведущим звеном вазодилатирующей функции эндотелия [9–11]. В некоторых работах показано, что полиморфизм Т(786)С гена NOS3 влияет на активность NO-синтазы, что приводит к снижению биодоступности оксида азота у больных СД [11]. Это способствует развитию и прогрессированию эндотелиальной дисфункции, усилению тонуса и проницаемости сосудов, что в конечном счете вызывает поражение миокарда у данной категории больных [11]. Значительную роль в развитии фиброза миокарда играют матриксные металлопротеиназы (МПП), особенно МПП-1, МПП-2, МПП-3 [12–15]. МПП-1 в первую очередь способствуют росту белков внеклеточного матрикса — коллагена I и III типов и расщеплению компонентов внеклеточного матрикса [13, 14]. Благодаря некоторым исследованиям, как экспериментальным, так и клиническим [13], показаны взаимосвязи маркеров фиброза миокарда и выраженности процессов ремоделирования миокарда у больных СД2 [4, 5]. Усиленная продукция ММП влияет на развитие фиброза миокарда с последующим нарушением диастолического наполнения ЛЖ [4]. Исследования, посвященные оценке влияния профибротических факторов на гемодинамические параметры ЛЖ у больных СД1, единичны и достаточно противоречивы [3, 4].
На фоне хронической гипергликемии идут процессы нейрональной дегенерации симпатических и парасимпатических волокон вегетативной нервной системы, что проявляется клинически склонностью к тахикардии, нарушениям ритма сердца, гипотензии, — развивается диабетическая кардиоваскулярная автономная нейропатия (ДКАН), что также вносит свой вклад в развитие некоронарогенного поражения миокарда при СД [4, 5]. К сожалению, истинная распространенность этого осложнения варьирует в широких пределах и, по данным различных авторов, составляет от 2,5 до 90% [3], что свидетельствует о проблемах диагностики и недостаточном внимании со стороны специалистов к данной проблеме [2].
Прогнозирование поражения миокарда у больных СД1 может повысить эффективность проводимых диагностических и лечебных мероприятий при оказании специализированной медицинской помощи этой категории больных. В данной работе представлена собственная прогностическая модель развития ДД ЛЖ у больных СД1 при помощи логарифмической регрессии. В создании модели участвовали переменные, представленные маркерами деградации коллагена, полиморфизма Т(786)С гена NOS3, ДКАН с последующей оценкой их влияния на развитие диабетической кардиомиопатии.
Цель исследования: выявить факторы риска нарушения диастолической функции ЛЖ у больных СД1 и оценить их диагностическое и прогностическое значение в создании модели прогнозирования развития диабетической кардиомиопатии.
Содержание статьи
Материал и методы
В основе работы лежат результаты комплексного обследования больных с СД1 с длительностью заболевания более 5 лет, находящихся на лечении в эндокринологическом отделении ГУЗ «Краевая клиническая больница» г. Читы, а также пациентов, получающих амбулаторное лечение в ГАУЗ «Клинический медицинский центр» г. Читы, в период 2014–2020 гг.
Для проведения исследования было получено разрешение локального этического комитета при ФГБОУ ВО ЧГМА Минздрава России в соответствии с Хельсинкской декларацией, а также информированное согласие на проведение молекулярно-генетического исследования. Тема данной работы была включена в основной план научно-исследовательской работы ФГБОУ ВО ЧГМА Минздрава России (регистрационный номер РК 018(06) 01201152866).
Изученную выборку составили 140 больных СД1 типа (72 мужчины и 68 женщин). Всем пациентам проводилась базис-болюсная инсулинотерапия, включавшая аналоги человеческих инсулинов длительного и ультракороткого действия, у 5 больных — помповая инсулинотерапия.
Критерии невключения: СД2, другие специфические формы СД, наличие диабетических макрососудистых осложнений, наличие диабетической ретинопатии препролиферативной и пролиферативной стадии, снижение скорости клубочковой фильтрации ≤45 мл/мин; нарушения ритма сердца в анамнезе и артериальная гипертензия, полинейропатия недиабетического генеза, алкоголизм и хроническая алкогольная интоксикация; беременность и лактация, сопутствующие эндокринные заболевания (патология щитовидной железы, надпочечников и др.).
Всем пациентам, включенным в исследование, проводили диагностику ДКАН согласно «Алгоритмам оказания специализированной медицинской помощи больным сахарным диабетом» [2, 16]. Диагностическими критериями ДКАН является наличие двух или более патологических результатов [2].
Всем больным СД1 методом ЭхоКГ выполняли оценку диастолической функции ЛЖ в соответствии с рекомендациями ОССН — РКО — РНМОТ [17]. Согласно указанным рекомендациям ДД ЛЖ характеризуется основными признаками: отношение Е/е’ среднее >14; скорость медиальной части фиброзного кольца МК е’ <7 см>2,8 м/с; индекс объема ЛП >34 мл/м2. Если выявлялось 3 признака, диагностировалась ДД ЛЖ.
В НИИ молекулярной медицины ФГБОУ ВО ЧГМА Минздрава России на аппарате автоматического иммуноферментного анализатора проводилось количественное определение МПП: ММП-1, МПП-2, ММП-3 в сыворотке крови больных СД1 с использованием готовых наборов AbFrontiers human ELISA, Quantikine Immunoassay, AESKULISA, поставленных для ЗАО «Биохиммак» (Москва). Точка мутации эндотелиальной синтазы азота-3 в позиции 786 (Т>С) выбрана для молекулярно-генетического исследования с выделением ДНК из цельной крови пациентов методом фенолхлороформной экстракции. В дальнейшем амплификацию полученных фрагментов генов проводили в термоциклере с использованием готовых тест-наборов праймеров HПФ «Литex».
Для решения задачи прогнозирования развития ДД ЛЖ у больных СД1 и построения прогностической модели нами был применен метод логистической бинарной регрессии, который используется для описания взаимосвязей между переменными [18, 19]. На основании клинического, лабораторного и инструментального исследований пациентов была рассчитана бинарная зависимая переменная, равная нулю, при отсутствии ДД ЛЖ, и единице — при наличии поражения миокарда в виде нарушения ДД ЛЖ. Выбор метода обусловлен особенностями полученных данных: в большинстве случаев отличием параметров-предикторов от нормального распределения, наличием среди предикторов как непрерывных, так и дискретных переменных, а также простотой приведения зависимости переменной к бинарной функции [19].
Категориальные переменные являлись бинарными, а это означает, что они имеют только два значения. Поскольку современные статистические программы работают с категориальными данными, имеющими более двух значений, была проведена трансформация их в фиктивные переменные [18]. В нашем исследовании все категориальные переменные были преобразованы в фиктивные. Фиктивные переменные записываются в бинарном виде — 1/0, где их количество — n-1 (n — количество исходных категорий) [18]. Например: переменная ДКАН имеет только 2 значения: «да» или «нет», может быть трансформирована в фиктивную переменную: 1 — диагностирована ДКАН, 0 — ДКАН отсутствует.
Искусственное создание категориальной переменной из количественной и вместо нее является другим методом трансформации. В нашем исследовании категориальную трансформацию выполнили для учета стажа СД, которая была представлена в количественном виде: стаж СД при длительности заболевания до 5 лет равен 1, от 5 до 10 лет равен 2, свыше 10 лет равен 3.
Оценка корреляции независимых количественных переменных была следующим этапом проверки на мультиколлинеарность [18, 19]. Коллинеарными являлись переменные, если коэффициенты корреляции Спирмена превышали 0,75 по наибольшему значению.
Факт наличия диабетической кардиомиопатии у больных СД1 представлен в виде бинарной переменной, где 0 — отсутствие диабетической кардиомиопатии, 1 — имеется поражение миокарда в виде нарушения диастолической функции ЛЖ.
В модель включались факторы, ранее продемонстрировавшие статистически значимые отличия при обнаружении ДД ДЖ: стаж СД (годы), наличие ДКАН, уровни ММП-1, -2, -3, аллели гена NOS3 [20, 21].
Обработку полученных результатов проводили с использованием пакета прикладных статистических программ Statistica 12.0. Результаты представлены в виде медианы и квартилей (Ме [Q1; Q3]).
Результаты исследования
Характеристики пациентов представлены в таблице 1. В изучаемой выборке пациентов с СД1 ДКАН была диагностирована у 58 больных. По результатам исследования функции релаксации ЛЖ у участников исследования ДД ЛЖ выявлена у 39 человек.
При создании модели логарифмической регрессии нами были проверены и выполнены ряд условий. Это проводилось как на этапе подготовки к выполнению анализа, так и в процессе создания модели. В нашу модель включились независимые переменные, которые показали ранее связь с развитием ДД ЛЖ у больных СД1 [21, 22]. Независимые переменные были разделены на два типа: количественные и категориальные. В количественные переменные вошли уровни МПП-1, МПП-2, МПП-3.
Категориальные показатели включали: стаж СД1, наличие или отсутствие ДКАН, аллели гена NOS3 Т(786)С (см. табл. 1).
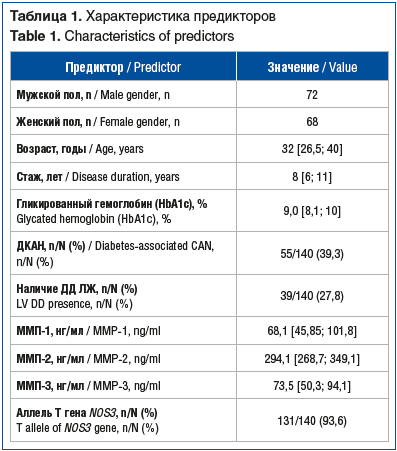
Частота положительного значения зависимой переменной — ДД ЛЖ была около 30% (см. табл. 1), что свидетельствовало об отсутствии несбалансированности данных.
Вероятность развития ДД ЛЖ (абсолютный риск) равнялась 27,8% (39 из 140), шансы — 0,386 (39/101).
Свободный член и коэффициент регрессии в многофакторной модели прогнозирования развития диабетической кардиомиопатии представлены в таблице 2. Вклад факторов, включенных в модель, составляет 66,3%, причем положительная предсказуемая ценность равна 79%.
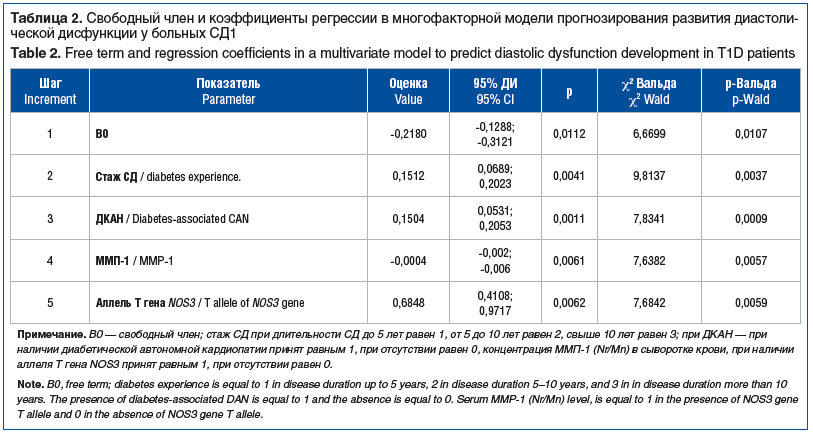
При построении итогового уравнения бинарной логистической регрессии итоговые потери составили 5,578737, χ2=75,13 для 4 степеней свободы, при уровне значимости р=0,000301, что свидетельствует о достаточно высокой достоверности данной математической модели.
По результатам проведенного исследования получено итоговое уравнение вероятности развития ДД у больных СД1:
р = 1 / 1+ e-(0,2180 + 0,1512x + 0,1504y — 0,0004z + 0,6848α)
где р — вероятность развития диабетической кардиопатии, x — стаж СД при длительности СД до 5 лет равен 1, от 5 до 10 лет равен 2, свыше 10 лет равен 3, y — при наличии ДКАН принят равным 1, при отсутствии равен 0, z — концентрация ММП-1 (Nr/Mn) в сыворотке крови, α — при наличии аллеля Т гена NOS3 принят равным 1, при отсутствии равен 0.
Для дальнейшей проверки точности новой модели и ее характеристики требуется увеличение объема валидирующей выборки с включением пациентов с СД1 из других медицинских центров.
Обсуждение
Наше исследование является примером решения проблемы прогнозирования в условиях реальной клинической практики с использованием одного из самых доступных методов анализа данных — логарифмической регрессии. Исследователям в процессе создания модели необходимо решить основные задачи, такие как поиск предикторов, которые будут влиять на изучаемый исход и, собственно, на создание прогностической модели с целью предсказания исхода заболевания [19, 22–24].
Размер выборки является важным допущением в методах многофакторного анализа, в том числе и при использовании логарифмической регрессии. Мощность статистического теста снижается при недостаточном количестве событий, и при этом увеличиваются ошибки прогнозирования [23]. При недостаточном количестве событий необходимо сокращать количество предикторов. В нашей работе при исходном значении независимых переменных (k=5) количество больных СД1 для построения математической модели должно быть от 170 до 350 человек. Исходная матрица составила 190 человек и 5 предикторов. Сбалансированность показателей изучаемых явлений является важным фактором при построении прогностических моделей. Если имеется низкая частота независимых переменных, это приведет к асимметрии выборки, а затем и к снижению качества модели [25, 26].
В проводимом исследовании наиболее значимыми факторами прогноза являлись наличие ДКАН, изменения уровня МПП-1, наличие аллели Т гена NOS3, а также стаж заболевания, представленный в виде бинарной переменной. Представленные параметры являются наиболее значимыми у больных СД1, что требует мониторинга и внимания со стороны эндокринологов, кардиологов и других специалистов. Точность описанной модели составляет 66,3%, причем положительная предсказуемая ценность равна 79%. Чувствительность модели характеризуется долей полученных положительных результатов, и это влияет на прогнозируемое событие, при этом чувствительность может быть от 0 до 100%. Доля истинно отрицательных результатов характеризует специфичность модели (от 0 до 100%) [27]. Рядом экспертов в Российской Федерации предъявляются требования к показателям чувствительности от 95% и выше, специфичности от 80% и выше, которые должны быть подтверждены при валидации в рамках клинических исследований. Созданная нами математическая модель не позволила достичь указанных параметров по ряду объективных причин из-за ограничения возможностей логарифмической регрессии как метода анализа данных. Тем не менее общая точность модели свидетельствует о перспективности дальнейших исследований в данной области.
Заключение
В условиях гипергликемии усиление экспрессии гена NOS3 при снижении защитных антиоксидантных систем у больных СД способствует снижению биодоступности оксида азота, что играет важную роль в развитии сосудистых поражений при данном заболевании. Эндотелиальная дисфункция способствует структурно-функциональной перестройке миокарда с развитием интерстициального фиброза. Изменение активности ММП ассоциируется с процессами ремоделирования миокарда. ММП-1 играет центральную роль в расщеплении компонентов внеклеточного матрикса, что способствует структурно-функциональным изменениям миокарда с развитием ДД ЛЖ. Использование метода анализа данных при помощи логарифмической регрессии, поиск предикторов поражения миокарда для определения прогноза и исхода заболевания в настоящее время имеют большое практическое значение. Представлена современная методика оценки риска развития ДД ЛЖ у больных СД1 с учетом уровня ММП-1, наличия диабетической автономной нейропатии и гомозиготного варианта ТТ гена NOS3. Эта математическая модель пригодна для прогнозирования диабетической кардиомиопатии у больных СД1.
Сведения об авторах:
Просяник Вера Ивановна — к.м.н., доцент кафедры госпитальной терапии и эндокринологии ФГБОУ ВО ЧГМА Минздрава России; 672000, Россия, г. Чита, ул. Горького, д. 39А; ORCID iD 0000-0002-9927-6829.
Серебрякова Ольга Владимировна — д.м.н., профессор, заведующая кафедрой госпитальной терапии и эндокринологии ФГБОУ ВО ЧГМА Минздрава России; 672000, Россия, г. Чита, ул. Горького, д. 39А; ORCID iD 0000-0003-4418-2531.
Серкин Дмитрий Михайлович — к.м.н., доцент кафедры госпитальной терапии и эндокринологии ФГБОУ ВО ЧГМА Минздрава России; 672000, Россия, г. Чита, ул. Горького, д. 39А.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.03.2023.
Поступила после рецензирования 24.03.2023.
Принята в печать 21.04.2023.
About the authors:
Vera I. Prosyanik — C. Sc. (Med.), associate professor of the Department of Hospital Therapy and Endocrinology, Chita State Medical Academy; 39A, Gorkiy str., Chita, 672000, Russian Federation; ORCID iD 0000-0002-9927-6829.
Olga V. Serebryakova — Dr. Sc. (Med.), Professor, Head of the Department of Hospital Therapy and Endocrinology, Chita State Medical Academy; 39A, Gorkiy str., Chita, 672000, Russian Federation; ORCID iD 0000-0003-4418-2531.
Dmitriy M. Serkin — C. Sc. (Med.), associate professor of the Department of Hospital Therapy and Endocrinology, Chita State Medical Academy; 39A, Gorkiy str., Chita, 672000, Russian Federation.
Contact information: Vera I. Prosyanik, е-mail: prosyanikv@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 02.03.2023.
Revised 24.03.2023.
Accepted 21.04.2023.
Информация с rmj.ru

