Содержание статьи
Психоэмоциональное состояние подростков с патологией
репродуктивной системы
Н. В. Болотова, доктор медицинских наук, профессор
О. Л. Коновалова
ГБОУ ВПО СГМУ им. В. И. Разумовского МЗ РФ, Саратов
Высокий риск формирования бесплодия у мужчин при заболеваниях половой системы
обусловливает внимание специалистов к этой проблеме. Среди множества причин
мужского бесплодия выделяют инфекционные заболевания, травмы половых органов,
аномалии развития гениталий, гормональный дисбаланс, а также функциональные
нарушения созревания гипоталамо-гипофизарно-гонадной оси [1–3]. В 25% случаев
причина инфертильности остается не установленной [4, 5]. У пациентов этой группы
важно изучение периода полового созревания — ключевого момента в становлении
функции репродукции. При этом менее изученными остаются их психоэмоциональные
особенности. В немногочисленных работах авторами показаны изменения
психоэмоционального состояния у пациентов с гипогонадизмом, эректильной
дисфункцией, снижением уровня тестостерона вследствие метаболического синдрома,
гипоспадией (ГС) [6–10]. Внутренняя картина болезни формируется из отношения
пациента к заболеванию, которое напрямую зависит от его психоэмоционального
состояния. Изучение течения психических процессов при различных заболеваниях
половой системы представляет научный интерес. Одним из способов выявления этих
состояний является психологическое тестирование [11].
Целью данного исследования было сравнить психоэмоциональное состояние
подростков с корригированной гипоспадией и подростков с функциональными
задержками пубертата.
Пациенты и методы исследования
Обследовано 40 мальчиков 14–15 лет, из них 20 детей (1-я группа) с
корригированной гипоспадией (10 — стволовая форма, 10 — мошоночная форма) и 20
детей (2-я группа) с функциональной задержкой полового развития. Группу
сравнения составили 20 практически здоровых мальчиков сопоставимого возраста.
Обследование включало изучение анамнеза, осмотр с оценкой физического развития,
оценку полового развития по стадиям Таннера, определение уровней
лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ),
тестостерона в сыворотке крови методом иммуноферментного анализа с
использованием наборов реагентов DRG ELISA (Техсистемс, Россия). Всем пациентам
проведено компьютерное тестирование на аппаратно-программном комплексе «НС-ПсихоТест»
(«Нейрософт», Россия) с использованием методик «Короткая версия опросника
здоровья-12» (J. Ware и соавт.) и «Шкала госпитальной тревоги и депрессии»
(адаптирована М. Ю. Дробижевым).
Статистическая обработка полученных данных проводилась с использованием
пакета программы Statistica 6.0 (StatSoft, США). Данные предоставлены в виде
среднего математического М и стандартного квадратичного отклонения SD. Характер
распределения количественных значений оценивался с помощью критерия
Шапиро–Уилкса. Для сравнения различий значений признаков двух независимых групп
использовался непараметрический U-критерий Манна–Уитни. Для выявления
взаимосвязей между переменными был использован коэффициент ранговой корреляции
Спирмена. Различия считали статистически значимыми при p < 0,05.
Результаты и обсуждение
Все дети 1-й группы имели средние показатели физического развития: SDS роста
0,45 ± 0,8 и SDS индекса массы тела (ИМТ) 0,6 ± 0,2 (табл. 1). Половое развитие
соответствовало 2–3 стадии пубертата по Таннеру: объем гонад составил 10 ± 1,2
мл и не отличался от показателей здоровых детей контрольной группы. Однако у 65%
мальчиков была установлена микропения (средняя длина полового члена в группе
составила 4,7 ± 0,9 см), 4 (20%) обследованных пациента с корригированной
гипоспадией имели инвертированный пубертат. Во 2-й группе 80% детей наряду с
задержкой полового развития имели задержку физического развития: SDS роста —
2,05 ± 1,1 и SDS ИМТ 0,35 ± 0,3, признаки пубертата отсутствовали (стадия G1 по
Таннеру): средний объем гонад по данным орхиометрии составил 3,86 ± 1,2 мл,
средняя длина полового члена — 4,6 ± 1,38 см, что достоверно ниже, чем в группе
контроля. У 5 (25%) детей отмечено адренархе.
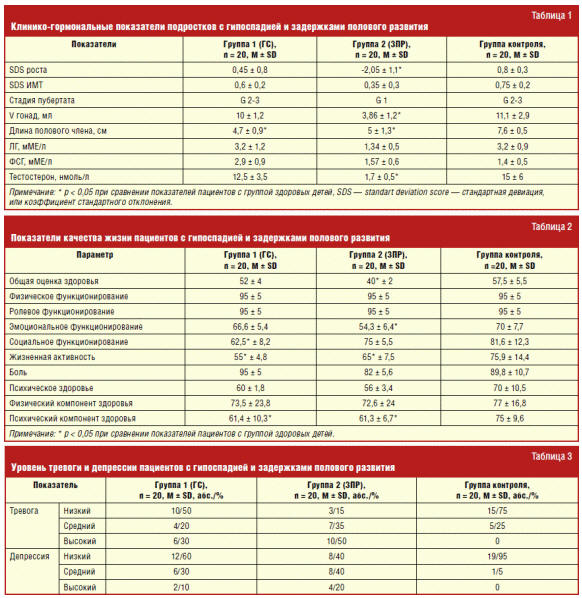
Гормональное обследование 90% пациентов 1-й группы не выявило отклонений,
уровни тестостерона, ЛГ и ФСГ соответствовали стадии пубертата. У 2 (10%) детей
этой группы диагностирован гипергонадотропный гипогонадизм, назначена
заместительная гормональная терапия. При анализе уровня гормонов сыворотки крови
пациентов с функциональной задержкой пубертата были установлены препубертатные
уровни гонадотропинов и тестостерона, что свидетельствует об отсутствии
импульсной секреции гонадотропин-релизинг-гормонов вследствие незрелости
центральных мозговых структур (гипоталамо-гипофизарной системы). В контрольной
группе детей уровни тестостерона, ЛГ и ФСГ были достоверно выше, чем во 2-й
группе, и составили 15 ± 6 нмоль/л, 3,2 ± 0,9 мМЕ/л и 1,4 ± 0,5 мМЕ/л
соответственно. Частота осмотров в год, связанных с половым развитием, с момента
обращения: в 1-й группе у пациентов с гипоспадией составила 2–3 раза, во 2-й
группе у мальчиков с задержкой полового развития (ЗПР) — 4–5 раз. Получали
лечение по поводу заболевания 2 (10%) ребенка 1-й группы (заместительная
гормональная терапия в связи с гипергонадотропным гипогонадизмом) и 6 (30%)
детей 2-й группы (стимуляционная терапия).
Следующим этапом работы явилось исследование психоэмоционального состояния по
выбранным методикам. Методика «Короткая версия опросника здоровья-12» группирует
ответы в 8 шкал:
1) общее состояние здоровья — оценка больным
своего состояния здоровья в настоящий момент и перспектив лечения;
2) физическое функционирование, отражающее степень, в которой здоровье
лимитирует выполнение физических нагрузок (самообслуживание, ходьба и т. п.);
3) влияние физического состояния на ролевое функционирование (работу, выполнение
будничной деятельности);
4) эмоциональное функционирование (насколько эмоциональное состояние мешает
выполнению работы или другой повседневной деятельности);
5) социальное функционирование, определяется степенью, в которой физическое или
эмоциональное состояние ограничивает социальную активность (общение);
6) интенсивность боли и ее влияние на способность заниматься повседневной
деятельностью;
7) жизненная активность (подразумевает ощущение себя полным сил);
8) самооценка психического здоровья (настроение, наличие депрессии, тревоги,
общий показатель положительных эмоций).
Полученные показатели группируются в два суммарных измерения — физический
компонент здоровья и психический компонент. В составе физического компонента
объединяются показатели общего здоровья, физического функционирования, ролевого
функционирования, интенсивности боли, а в составе психического компонента —
показатели эмоционального функционирования, социального функционирования,
жизнеспособности и самооценки психического здоровья.
Анализ данных компьютерного тестирования по данной методике показал
достоверное снижение уровня самооценки здоровья и качества жизни во 2-й группе:
40 ± 2 балла против 52 ± 4 балла в 1-й группе и 57,5 ± 5,5 балла в контрольной.
При этом у подростков с корригированной гипоспадией больше страдает социальный
компонент (проблемы в общении со сверстниками), а у подростков с задержкой
полового развития эмоциональный компонент (склонность к плохому настроению,
переживаниям, эмоциональная лабильность). В обследованных группах у подростков
выявлено снижение жизненной активности относительно группы контроля. Некоторое
снижение значений по шкале боли во 2-й группе, вероятно, связано с проведением
инъекций (стимуляционная терапия) у нескольких детей. Как в 1-й, так и во 2-й
группе отмечается снижение показателя психического компонента здоровья: до 61,4
± 10,3 и 61,3 ± 6,7 балла соответственно (в группе контроля 75 ± 9,6 балла).
При оценке показателей тревоги и депрессии у половины пациентов 1-й группы
отмечено повышение уровня тревоги: в 20% случаев до субклинического уровня и в
30% — до клинически выраженной тревоги. Во 2-й группе обследованных клинически
выраженную тревогу имели 50% детей, еще 35% — субклиническую. В группе контроля
у большинства мальчиков (75%) выявлен низкий уровень тревоги. Проявления
депрессии на субклиническом и клиническом уровнях имели 60% мальчиков 2-й
группы, в то время как 60% детей 1-й группы не имели признаков депрессии, как и
95% детей группы контроля.
При определении корреляционной зависимости между частотой осмотров и уровнем
тревожности статистически значимой корреляции не выявлено (коэффициент ранговой
корреляции Спирмена для 1-й группы составил 0,076, для 2-й группы составил
–0,052).
Таким образом, у мальчиков с корригированной гипоспадией (врожденной
аномалией развития уретры) внимание специалистов к течению полового созревания,
осмотры, неудовлетворенность внешним видом и размерами наружных половых органов
приводят к повышению уровня тревожности, агрессии [9]. При этом изменения в
психоэмоциональном состоянии возникают не с раннего возраста, когда проводится
хирургическая коррекция, а в период становления пубертата (10–11 лет).
Отклонения в психоэмоциональном состоянии у мальчиков с функциональными ЗПР
возникают около 14 лет и чаще связаны с отставанием в росте, маленькими
размерами гонад и полового члена, слабым оволосенением. Эти симптомы обусловлены
функциональной незрелостью гипоталамических структур и отсутствием импульсной
секреции гонадотропинов.
Выводы
- Выявлен высокий уровень тревожности у 30% мальчиков 1-й группы, у 50%
мальчиков 2-й группы. - Клинически выраженная депрессия отмечена у 10% обследованных пациентов с
гипоспадией и 20% детей с функциональной задержкой пубертата. - Не выявлена корреляция между частотой осмотров и уровнем
тревоги/депрессии. - Для получения объективной картины психического и физического состояния
пациента целесообразно проводить комплексную клинико-гормональную диагностику
с использованием аппаратно-программного комплекса «НС-ПсихоТест».
Литература
-
Синицина А. А. Клинико-гормональные нарушения и состояние
центральной нервной системы у мальчиков с задержкой пубертата. Способ
коррекции. Автореферат дис. … канд. мед. наук. Саратов, 2013. 145 с. -
Райгородская Н. Ю., Болотова Н. В. и др. Половое развитие
мальчиков с гипоспадией // Урология. 2013, № 2, с. 84–89. -
Латышев О. Ю., Лаврова Т. Р. и др. Крипторхизм — проявление
синдрома тестикулярной дисгенезии // Вестник репродуктивного здоровья. 2008, №
12, с. 2–7. -
Громенко Д. С. Особенности патогенеза идиопатической
патозооспермии при мужской инфертильности. Автореферат дис. … докт. мед. наук.
СПб, 2009. 247 с. -
Кравцова Н. С., Роживанов Р. В., Курбатов Д. Г. Современные
методы гормональной стимулирующей терапии нарушений сперматогенеза у мужчин //
Вестник репродуктивного здоровья. 2010, № 12, с. 9–13. -
Nicolino M., Bendelac N., Jay N. et al. Clinical and biological
assessments of the undervirilized male // BJU international. 2004. V. 93. P.
20–25. -
David M., Donahoe P. Sex Determination and Differentiation // N.
England Journal. 2004. V. 350. S. 4. P. 367–378. -
Гамидов С. И. Эректильная дисфункция у больных метаболическим
синдромом: эпидемиология, патогенез, диагностика, лечение и профилактика.
Автореферат. дис. … докт. мед. наук. М., 2007. 249 с. -
Болотова Н. В., Коновалова О. Л. и др. Подростки с гипоспадией:
качество жизни // Лечащий Врач. 2013, № 11. С. 43–46. -
Недогода С. В., Саласюк А. С. и др. Особенности лечения
артериальной гипертензии при метаболическом синдроме у мужчин с эректильной
дисфункцией // Медицинский совет. 2013, № 5, с. 60–69. -
Белова А. Н., Щепетова О. Н. Шкалы, тесты и опросники в
медицинской реабилитации. М.: Антидор, 2002.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru







