Роль магния и калия в комплексной терапии коморбидного больного
А. Л. Вёрткин*, доктор медицинских наук, профессор
О. Б. Талибов*, кандидат медицинских наук
А. С. Скотников*, кандидат медицинских наук
А. М. Грицанчук**
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
** ГБУЗ ГКБ № 50 ДЗМ, Москва
Магниевая терапия в кардиологии сегодня имеет надежную теоретическую основу и убедительное практическое подтверждение. Магний, впервые выделенный английским химиком Гемфри Дэви в 1808 г., — двухвалентный металл с массой 24,301, в ионизированной форме он представляет собой положительный ион — катион — с зарядом 2+ (Mg++) [1].
Вместе с еще 11 основными структурными химическими элементами человеческого организма (углерод, водород, кислород, азот, натрий, калий, кальций, хлор, фосфор, сера и фтор) магний определяет 99% элементарного состава тела. По содержанию в организме он занимает четвертое место среди других катионов (после натрия, калия и кальция), а по содержанию в клетке — второе (после калия). Mg++ необходим для нормального протекания множества биохимических реакций и физиологических процессов. Ионы Mg++ способны образовывать обратимые соединения с органическими веществами, обеспечивая возможность их участия в разнообразных биохимических реакциях и активируя более чем 300 ферментов. В роли кофактора он принимает участие во многих ферментативных процессах, в частности в гликолизе, и гидролитическом расщеплении АТФ.
Находясь в комплексах с АТФ, Mg++ обеспечивает высвобождение энергии через активность Mg++-зависимых АТФаз. В качестве кофактора пируватдегидрогеназного комплекса Mg++ регулирует поступление продуктов гликолиза в цикл Кребса и этим препятствует накоплению лактата. Он участвует в синтезе и распаде нуклеиновых кислот, синтезе белков, жирных кислот и липидов, в частности, фосфолипидов, а также контролирует синтез ц-АМФ — универсального регулятора клеточного метаболизма и множества физиологических функций. Mg++ является естественным физиологическим антагонистом ионов кальция (Ca++).
В отличие от блокаторов медленных кальциевых каналов, Mg++ конкурирует с Ca++ не только в структуре мембранных каналов, но и на всех уровнях клеточной системы. На этой конкуренции основано подавление инициированных Ca++ реакций. При изменении внутриклеточного соотношения основных катионов и преобладании Ca++ происходит активация Ca++-чувствительных протеаз и липаз, приводящая к повреждению мембран. Благодаря антагонизму с Ca++, Mg++ выступает как мембрано- и цитопротектор. Аналогичным механизмом обусловлена и способность Mg++ уменьшать разобщение дыхания и окислительного фосфорилирования в митохондриях, вследствие чего уменьшаются непроизводительные потери энергии в виде тепла, увеличивается КПД синтеза АТФ и уменьшается потребность клетки в кислороде. Антагонизмом с Ca++ объясняют также снижение под действием ионов Mg++ АДФ-индуцированной агрегации тромбоцитов и подавление других кальцийзависимых реакций в каскадах коагуляции крови.
Ионы Mg++ играют важнейшую роль в электролитном балансе и процессах мембранного транспорта, требующего больших энергозатрат. Связываясь с клеточными, митохондриальными и другими мембранами, они регулируют их проницаемость для прочих ионов. Особое значение ионы Mg++ имеют в поддержании трансмембранного потенциала. Активируя Mg++-зависимую Na+-K+-АТФазу, они определяют работу K+/Na+-насоса, осуществляющего накопление калия внутри клетки и выведение натрия в межклеточное пространство, обеспечивая таким образом поляризацию мембраны и способствуя ее стабильности. Регуляцией электролитного баланса в клетке объясняется способность Mg++ подавлять автоматизм, проводимость и возбудимость, увеличивать абсолютную и укорачивать относительную рефрактерность миокарда. Принимая участие в высвобождении требующейся для функционирования мышечной клетки энергии и играя одну из главных ролей в расслаблении миоцита, Mg++ контролирует цикл «систола/диастола». Взаимодействие между четырьмя белками сократительного аппарата кардиомиоцита начинается после поступления в клетку кальция, играющего роль инициатора в образовании из актина и миозина актомиозина. Последний, обладая АТФазной активностью, в присутствии Ca++ и Mg++ гидролизует АТФ и обеспечивает энергией сокращение мышцы, то есть систолу сердца. Высвобождаясь из комплекса с АТФ по мере потребления последней, Mg++ вытесняет Ca++ из связи с тропонином С, в результате чего прекращается взаимодействие актина и миозина и наступает диастола. АТФазная активность актомиозина исчезает, а Ca++ с использованием энергии, высвобождающейся под влиянием Ca++-Mg++-зависимой АТФазы саркоплазматического ретикулума, реабсорбируется против градиента концентрации в полость его продольных канальцев, а оттуда по градиенту концентрации — в цистерны.
Таким образом, регуляция цикла «систола/диастола» осуществляется Mg++ как за счет его участия в энергетическом обмене, так и вследствие прямого антагонизма с Са++.
Описанные механизмы играют важную роль в вазодилатирующей активности Mg++, которая, возможно, опосредуется также через синтез ц-АМФ — мощного вазодилатирующего фактора, через подавляющее влияние на ренин-ангиотензин-альдостероновую систему и симпатическую иннервацию, а также через усиление натрийуреза вследствие повышения почечного кровотока посредством активации простациклина. В эксперименте было показано ингибирующее влияние Mg++ на выброс эндотелина, повышение которого, сопровождающее тромбоз коронарной артерии при инфаркте миокарда, приводит к выраженной локальной вазоконстрикции в зоне ишемического риска.
Кроме того, в эксперименте продемонстрировано, что Mg++ ингибирует протромбин, тромбин, фактор Кристмаса, проконвертин и плазменный компонент тромбопластина, а также его антиагрегантное действие. Среди метаболических функций, проявляющихся на уровне целого организма, необходимо подчеркнуть роль Mg++ в поддержании нормального липидного спектра, его участие в обеспечении тканевого ответа на инсулин в ингибировании гормона паращитовидной железы. Несмотря на то, что магний широко распространен в природе, его дефицит в человеческой популяции встречается чрезвычайно часто. Так, гипомагнезиемия определяется у 7–11% госпитализированных кардиологических больных, причем в 2 раза чаще у пациентов отделений интенсивной терапии [2]. Тому имеется множество причин. Однако достоверное выявление недостатка магния представляет определенные технические трудности, в связи с чем его диагностика на практике обычно проводится на основании клинических признаков. Так, если в одном из скрининговых исследований, проведенных в США, было показано, что гипомагнезиемия (уровень сывороточного Mg++ ниже 0,74 ммоль/л) встречалась в 47,1% случаев [3], то клинические признаки магниевого дефицита выявляются более чем у 72% взрослых американцев. По этиологии магниевый дефицит можно подразделить на первичный и вторичный.
Первичный (конституциональный, латентный) дефицит магния — в типичной, «эссенциальной», форме проявляется судорожным синдромом, называемым «спазмофилией», «конституциональной тетанией» или «нормокальциевой тетанией». У большей части больных явные клинические симптомы наблюдаются при нормальном содержании Mg++ в крови и связаны с нарушениями трансмембранного обмена Mg++, обусловленными, по-видимому, генетически. Вторичный дефицит магния — явление, присущее практически всем обществам современного мира. Причин тому множество, и они с известным допущением могут быть разделены на две большие группы: факторы, зависящие от условий жизни и связанные с различными заболеваниями.
Пищевой стандарт, принятый в России, странах Европы и Америки, не обеспечивает достаточного поступления Mg++ в организм человека. Это не связано с недоеданием, как в слаборазвитых странах, а обусловлено качественным составом пищи. Как уже указывалось, многие основные пищевые продукты (различные виды мяса и птицы, картофель и другие овощи, молоко и молочные продукты) содержат ограниченные количества Mg++. В большинстве продуктов с высоким содержанием Mg++ имеется либо много кальция или фосфора, либо белков или жиров, либо всех этих ингредиентов, что препятствует абсорбции Mg++. Многие богатые Mg++ продукты высококалорийны, поэтому могут употребляться в пищу лишь в ограниченном количестве, не покрывая потребность в Mg++. Всеми этими отрицательными свойствами не обладают шпинат и морская капуста, однако для обеспечения физиологической суточной потребности в Mg++ ежедневно нужно съедать 400–450 г первого или 200 г второй. Казалось бы, как источник Mg++ идеальным продуктом оказывается арбуз, но и здесь можно возразить, что диуретическое свойство арбуза приведет к повышенным потерям электролитов и возрастанию суточной потребности Mg++.
В связи с вышесказанным, современная популяция характеризуется пограничным количеством Mg++ в организме, поэтому, кроме непосредственно алиментарного дефицита, любая дополнительная нагрузка, способствующая затруднению всасывания Mg++, возрастанию его потерь или увеличению суточной потребности в нем, может спровоцировать развитие магниевого дефицита. Среди таких факторов можно назвать гипокалорийные диеты при борьбе с лишним весом; стресс (как острый, так и, особенно, хронический); напряженную физическую работу и физическое перенапряжение; гиподинамию; воздействие высоких температур (жаркий климат, горячие цеха, регулярное посещение парной бани); злоупотребление алкоголем (злоупотребление алкоголем столь широко распространено в современном мире, что, являясь по сути болезнью, в данном контексте должно рассматриваться вместе с другими условиями жизни, а не с патологическими процессами); беременность и лактацию; гормональную контрацепцию.
Причины магниевого дефицита, связанные с патологическими процессами, — это нарушение абсорбции Mg++ в связи с возрастными изменениями или заболеваниями ЖКТ (от синдрома малой абсорбции при, например, болезни Крона, до относительно незначительных нарушений функции кишечника при хроническом дуодените или субклиническом течении дисбактериоза); проявления сахарного диабета и его осложнения (гипергликемия, полиурия, применение сахароснижающих средств, диабетическая нефропатия с нарушением реабсорбции); гипергликемия любого происхождения (в том числе и ятрогенная); почечный ацидоз, нефротический синдром; гиперкортицизм; гиперкатехоламинемия; гиперальдостеронизм; гипертиреоз; гиперпаратиреоз; гиперкальциемия; артериальная гипертензия; инфаркт миокарда; застойная сердечная недостаточность; факторы риска ИБС, в частности ожирение; передозировка сердечных гликозидов; диуретическая, глюкокортикоидная, цитостатическая терапия.
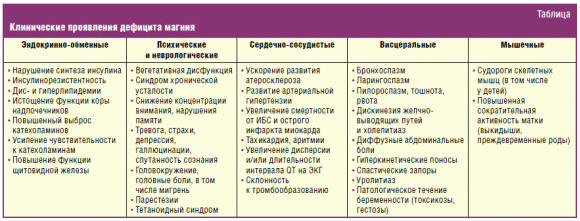
Поскольку неоднородность распределения Mg++ в тканях организма делает малоинформативным определение его содержания в сыворотке или эритроцитах, заподозрить магниевый дефицит можно на основании сочетания отдельных клинических признаков магниевого дефицита, особенно если они затрагивают различные системы и наблюдаются на фоне значимого провоцирующего фактора, например злоупотребления алкоголем. Разнообразные клинические симптомы и синдромы, связанные с дефицитом ионизированного магния, представлены в таблице.
Из множества патологических состояний, возникающих при магниевом дефиците, наиболее полно изучены сердечно-сосудистые заболевания. Инсулинорезистентность, дис- и гиперлипидемии, развивающиеся при дефиците Mg++, должны способствовать ускорению развития атеросклероза, что прогностически особенно неблагоприятно при возникающих при этом повышении активности плазменного ренина и продемонстрированного снижения выделения эндотелием вазодилатирующего фактора — окиси азота [4]. Имеются экспериментальные данные о роли дефицита Mg++ в развитии атеросклероза [5]. Эти факты хорошо объясняют, почему у жителей областей с повышенным уровнем Mg++ в воде отмечается замедление развития атеросклероза и меньшая смертность от этого заболевания. Понятна и известная связь между дефицитом Mg++ в воде и летальностью от острого инфаркта миокарда [6]. Необходимо подчеркнуть, что важен не только абсолютный уровень Mg++, но и уровень Ca++: величина отношения Ca++/Mg++ коррелирует со смертностью от проявлений ИБС [7].
Недостаток Mg++ в воде и пище служит и серьезным фактором риска развития артериальной гипертензии. Кроме самостоятельного вазодилатирущего эффекта ионов Mg++, опосредующегося многими вышеописанными механизмами, в условиях магниевого дефицита отмечена повышенная чувствительность артерий к воздействию прессорных аминов.
Весьма существенна роль магния при остром инфаркте миокарда. Потеря ионов Mg++ кардиомиоцитом является его ранней реакцией на ишемию, что приводит к истощению запасов АТФ, угнетению АТФ-зависимых реакций, в том числе угнетению функционирования K+/Na+-помпы и изменению внутриклеточного соотношения основных катионов. Повышение концентрации Ca++ в цитозоле вызывает активацию Ca++-зависимых протеаз и липаз, приводящую к повреждению клетки. До 95% больных в остром периоде инфаркта миокарда имеют сниженное содержание сывороточного магния (Святов, 1999). Одним из механизмов развития этого феномена можно считать повышенный выброс катехоламинов, который приводит к увеличению содержания свободных жирных кислот, связывающих Mg++ (что наблюдается при любом стрессе).
Дефицит Mg++ с преобладанием Са++ и неконтролируемое поступление последнего в кардиомиоцит лежит в основе реперфузионного синдрома, развивающегося после медикаментозной, инструментальной или спонтанной реваскуляризации миокарда при остром инфаркте и проявляющегося, прежде всего, нарушениями сердечного ритма.
Как при инфаркте миокарда, так и в других ситуациях внутриклеточный дефицит Mg++ может служить причиной развития синусовой тахикардии и других различных аритмий вплоть до фатальных. Выраженный магниевый дефицит сопровождается удлинением интервала QT (что, как известно, ассоциируется с развитием желудочковых нарушений ритма и внезапной смерти) и увеличением «дисперсии» QT (разницы между QTMAX и QTMIN), считающимся еще более надежным признаком высокой вероятности развития нарушений ритма, в том числе и фатальных. Наиболее характерным для дефицита Mg++ вариантом аритмии является желудочковая тахикардия типа «пируэт» (torsade de pointes), а также индуцированные дигиталисом нарушения ритма, пароксизмальная суправентрикулярная тахикардия, мономорфная желудочковая тахикардия.
У пациентов с инфарктом миокарда выявлена корреляция между дефицитом магния и разнообразными желудочковыми нарушениями ритма. При застойной сердечной недостаточности магниевый дефицит возникает как результат нейрогуморальных сдвигов (сипатоадреналовой гиперфункции, активации ренин-ангиотензин-альдостероновой системы), застоя в желудочно-кишечном тракте (ЖКТ), препятствующего абсорбции Mg++, и усугубляется вследствие диуретической и гликозидной терапии. У больных со сниженным уровнем Mg++ отмечается двукратное увеличение смертности от сердечной недостаточности.
Гипомагнезиемия ассоциируется с повышенной агрегацией тромбоцитов и возрастанием риска тромбозов и эмболий. При недостатке Mg++ ослабляется антиоксидантная защита. Магниевый дефицит (уменьшение его содержания в мышцах и эритроцитах) обнаружен у больных с пролапсом митрального клапана, для которых также характерны нарушения ритма [8].
Развивающийся при злоупотреблении алкоголем дефицит Mg++ играет определенную роль в формировании многих осложнений хронической интоксикации этанолом (от поведенческих реакций до миопатии) и существенную роль в развитии абстинентного синдрома [9].
В обычных физиологических условиях кинетический цикл Mg++ складывается из абсорбции в ЖКТ, распределения в средах организма и элиминации, осуществляемой в основном путем экскреции с мочой. Всасывание Mg++ может осуществляться во всем кишечнике вплоть до сигмовидной кишки. Его усвояемость из пищевых продуктов составляет 30–35% (то есть из 300–350 мг суточной потребности усваивается около 100 мг). Она может увеличиваться под влиянием витамина В6 и ряда органических кислот (молочной, аспарагиновой, оротовой). Молоко и некоторые молочные продукты, содержащие казеин, также способствуют увеличению абсорбции Mg++ (возможно, в связи с большим содержанием оротовой кислоты). Абсорбции Mg++ в ЖКТ препятствует большое содержание в пище веществ, с которыми он образует трудно- или нерастворимые соединения — белки, жиры. Всасывание уменьшается также при избытке ионов Ca++, конкурирующих с Mg++ на слизистой кишки, и фосфатов [10].
Общее количество магния в организме взрослого человека составляет 24–25 г или примерно 1000 ммоль. Наибольшая его часть — 60% — содержится в костях, формируя в содружестве с кальцием их структуру; в случае необходимости отсюда может быть мобилизовано не более 20–30%. Mg++ является типичным интрацеллюлярным элементом — его внутриклеточная фракция составляет 39% всего его запаса (до 80–90% внутриклеточного магния находится в виде комплекса с АТФ, в связи с чем уровень АТФ является одним из основных факторов, лимитирующих накопление этого элемента в клетке). Оставшийся 1% распределяется во внеклеточном пространстве, включая и сыворотку крови, на долю которой приходится лишь 0,3% [11].
Наибольшее количество магния содержится в тканях с высокоинтенсивными обменными процессами. Основная часть его внутриклеточной фракции практически поровну поделена между мозговой и мышечной тканями. При этом наивысшее относительное содержание Mg++ отмечается в миокарде. Концентрация магния в сыворотке крови составляет в норме 0,75–0,95 ммоль/л, а в клетках может достигать 5–10 ммоль/л. Однако в связи с неоднородностью его распределения в различных тканях внутриклеточная его концентрация варьирует в широких пределах, составляя, например, в эритроцитах лишь 2–2,6 ммоль/л. Содержание магния в сыворотке крови не отражает его запасы в организме, а зависит лишь от интенсивности его движения из депо к почкам. Также малоинформативно и его содержание в клеточных элементах крови из-за неоднородности распределения. Поэтому лабораторная оценка магниевого обмена наиболее достоверна, если анализируется экскреция Mg++ с мочой.
Обычно выведение Mg++ из организма осуществляется почками, через которые теряется примерно 100 мг/сут, то есть все всосавшееся из пищи количество. При его дефиците почечная экскреция снижается или прекращается вовсе; при увеличении поступления Mg++ увеличивается и экскреция.
Его потери с мочой возрастают под влиянием катехоламинов и глюкокортикоидных гормонов, чем объясняется возможность возникновения магниевого дефицита при стрессе. Существенные количества Mg++ могут теряться и в случае усиленного потоотделения при напряженной физической работе или тепловой нагрузке; при этом его потери с потом могут достигать 15%, в то время как в обычных условиях они не превышают 1,5 мг/сут (последним фактом при анализе магниевого гомеостаза часто пренебрегают).
Mg++ как фармакологическое средство обладает множеством разнообразных клинических эффектов, в частности антигипертензивным, антиишемическим, диуретическим и др., а также обилием показаний к применению. В большинстве случаев фармакологическое действие Mg++ проявляется и при отсутствии явных признаков его дефицита [12].
Возможно, это объясняется тем, что при многих патологических процессах развивается вторичный (общий или местный) магниевый дефицит, выступающий одним из патогенетических механизмов, способствуя прогрессированию заболевания и усугублению клинического состояния больного. Получение фармакологических эффектов Mg++ во многих случаях с недоказанным его дефицитом можно связать и с антикальциевым действием.
Положительный эффект препаратов Mg++ наблюдается как при лечении хронических заболеваний (когда Mg++ предупреждает обострения и улучшает качество жизни), так и в ургентных ситуациях (для восстановления нормального осуществления жизненно важных функций). При разных путях введения, обеспечивающих различные концентрации Mg++, на первый план выступают его разные эффекты. Например, если седативное, спазмолитическое и некоторое антигипертензивное действие при приеме внутрь проявляется довольно рано, то для заметного влияния на сердце (за исключением частоты сердечных сокращений) в этом случае требуется срок, измеряемый неделями [13].
Другим жизненно важным элементом является калий (К+), который служит основным внутриклеточным катионом и в норме концентрация которого в плазме составляет 3,5–5 ммоль/л, а в клетках — 150 ммоль/л. Обмен калия обусловлен его поступлением извне и выведением почками с мочой. Этот объем составляет 1,9–5,9 г калия в сутки. Содержание калия во внеклеточной жидкости составляет менее 2% от общего его содержания в организме. Высокое внутриклеточное содержание калия обеспечивается работой так называемого «натрий-калиевого насоса» — особой белковой структуры, расположенной в клеточной мембране, для работы которой требуются энергия молекул аденозинтрифосфата (АТФ) и присутствие ионов магния.
Натрий-калиевый насос начинает усиленно работать при повышении уровня калия в крови под действием альдостерона, «гормонов стресса» катехоламинов (адреналина и норадреналина) и инсулина [14]. Так создается трансмембранный потенциал покоя, наличие которого чрезвычайно важно для нормального функционирования нервной и мышечной ткани. Поскольку потери калия из внеклеточной жидкости быстро компенсируются за счет его притока из клеток, концентрация этого иона во внеклеточном пространстве на протяжении достаточно длительного времени изменяется очень мало. В результате критический дефицит калия, который может привести к сердечно-сосудистым и нервно-мышечным нарушениям, часто остается незамеченным при стандартных исследованиях [15].
На распределение калия в организме влияет ряд гормонов, кислотно-щелочное равновесие, скорость обновления клеток. Так, на активность Na+, K+-АТФазы опосредованно действует инсулин (способствует перемещению калия в мышечные клетки и клетки печени), повышая эту активность, поэтому больные сахарным диабетом находятся в группе риска по развитию гипокалиемии. Другими причинами гипокалиемии являются: недостаточное поступление его с пищей (голодание, диеты), интенсивная потеря жидкости (диарея, потоотделение, прием тиазидных диуретиков или слабительных), гипергликемия, гиперальдостеронизм, гипомагниемия и др. [16].
Наиболее частая причина гипокалиемии — повышенное выделение калия через желудочно-кишечный тракт (с рвотой, при поносе, при злоупотреблении слабительными) или с мочой (при длительном приеме диуретиков, а также при таких состояниях, как первичный или вторичный гиперальдостеронизм, классический дистальный ренальный канальцевый ацидоз, синдром Барттера). Кроме диуретиков, к гипокалиемии могут приводить и другие лекарственные препараты: ампициллин, пенициллин, карбенициллин, гентамицин, амфотерицин В, салицилаты. Снижение поступления калия с пищей очень редко приводит к гипокалиемии. Переход калия из внеклеточной жидкости в клетки может наблюдаться при избыточной активности минералкортикоидов, введении инсулина, при алкалозе. Периодический внезапный переход калия из внеклеточной жидкости в клетки наблюдается при периодическом гипокалиемическом параличе [17].
Возможности назначения внутрь неорганических солей магния (Mg++) и калия (К+) в терапевтических дозах ограничены, в связи со способностью таких доз вызывать нежелательные явления. Учитывая это, некоторые органические кислоты, витамины, повышая абсорбцию К+ и Mg++ в кишечнике и сокращая их потери с мочой, позволяют использовать меньшие дозы для получения отчетливых резорбтивных фармакологических эффектов. Среди таких факторов особое место занимает аспарагиновая кислота, которая, включаясь в цикл Кребса, нормализует нарушенные соотношения трикарбоновых кислот, активно участвует в синтезе АТФ, способствует поступлению калия и магния внутрь клетки и восстанавливает адекватную работу ионных насосов в условиях гипоксии. Аспарагиновая кислота представляет собой алифатическую аминокислоту, присутствующую в организме в составе белков, и в свободном виде играет важную роль в обмене азотистых веществ, участвует в образовании пиримидиновых оснований, а также мочевины. Уменьшая содержание аммиака, аспарагинат защищает ЦНС, нормализует процессы возбуждения и торможения в ней, стимулирует иммунную систему. Аспарагиновая кислота способствует увеличению запасов гликогена, что важно для нутритивной поддержки в целях обеспечения белково-энергетического гомеостаза. Соли аспарагиновой кислоты повышают выносливость, сопротивляемость организма к различным воздействиям, т. е. обладают адаптационным эффектом [18].
Таким образом, калия и магния аспарагинат (КМА) обладает следующими достоинствами: обеспечивает высокую абсорбцию К+ и Mg++ в ЖКТ при минимальных гастроинтестинальных побочных эффектах; не допускает существенного увеличения экскреции К+ и Mg++; обеспечивает накопление К+ и Mg++ в клетке; повышает клиническую эффективность ионов К+ и Mg++, что делает данное лекарство препаратом выбора при дефиците электролитов и позволяет использовать его в рутинной практике, в том числе в условиях отделений интенсивной терапии.
Литература
- Golf S. W., Bender S., Gruttner J. On the significance of magnesium in extreme physical stress // Cardiovasc Drugs Ther. 1998, Sep; 12 Suppl. 2: 197–202.
- Weiss M. J., Orkin S. H. Transcription factor GATA-1 permits survival and maturation of erythroid precursors by preventing apoptosis // Proc Natl Acad Sci USA. 1995, Oct 10; 92 (21): 9623–9627.
- Wang N. P., Chen P.-L., Huang S., Donoso L. A., Lee W.-H., Lee E. Y.-H. P. DNA-binding activity of retinoblastoma protein is intrinsic to its carboxil-terminal region // Cell Growth Diff. 1990. 1, 233–239.
- Pearson P. S., Evora P. R., Seccombe S. F., Schaff H. V. Hypomagnesaemia Nitric Oxide Release from Coronary Endothelium: Protective Role of Magnesium Infusion After Cardiac Operation // Ann.Thorac.Surg. 1998; 65: 967–972.
- Jellinek H., Takacs E. Morphological aspects of the effects of orotic acid and magnesium orotate on hypercholesterolemia in rabbits // Arzneimittelforschung. 1995 Aug; 45 (8): 836–842.
- Rubenowitz E. Magnesium in drinking water in relation to morbidity and mortality from acute myocardial infarction // Epidemiology. 2000. Vol. 11 (4). P. 416–421
- Taylor-Robinson D., Davies H. A., Sarathchandra P., Furr P. M. 1991. Intracellular location of mycoplasmas in cultured cells demonstrated by immunocytochemistry and electron microscopy // Int. J. Exp. Pathol. Vol. 72. P. 705–714.
- Cohen L., Laor A., Kitzes R. Magnesium malabsorption in postmenopausal osteoporosis // Magnesium. 1983. Vol. 2. P. 139–143.
- Durlach J. Magnesium chloride or magnesium sulfate: a genuine question // Magnes. Res. 2005. Vol. 18, № 3. P. 187–192.
- Косарев В. В., Бабанов С. А. Клиническая фармакология лекарственных средств, применяемых при сердечно-сосудистых заболеваниях. Самара, 2010, с. 140.
- Мартынов А. И., Степура О. Б., Пак Л. С., Мельник О. О. Магний и сердечно-сосудистая система // Клин. медицина. 1998. № 8. С. 63–65.
- Мартынов А. И., Остроумова О. Д., Маев И. В. Роль магния в патогенезе и лечении артериальной гипертонии // Тер. архив. 1999. № 12. С. 67–69.
- Мартынов А. И., Остроумова О. Д., Маев И. В. К вопросу о состоянии системы гомеостаза при эссенциальной гипертензии // Российские медицинские вести. 1999. № 3. С. 19–20.
- Clausen T., Everts M. E. Regulation of the Na, K–pump in skeletal muscle // Kidney Int. 1989. Vol. 35. P. 1–13.
- Вёрткин А. Л., Талибов О. Б. Обмен магния и терапия препаратами магния при гестозе // Фарматека. 2005, № 2, 13–17.
- Физиология человека: в 3-х томах; пер. с англ. / Под ред. Р. Шмидта и Г Тевса. 3-е изд. М.: Мир, 2004.
- Котова О. В., Рябоконь И. В. Патогенетическая роль дефицита калия и магния в развитии неврологических заболеваний // РМЖ. 2012. T. 29. P. 1493.
- Shechter M. Oral magnesium therapy improves endothelial function in patients with coronary artery disease // Circulation. 2000. Vol. 102. 1. P. 2353.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru