Клинико-экспертная диагностика гастроинтестинальной формы диабетической нейропатии
И.А. Курникова1, И.В. Гурьева2, Т.Е. Чернышова1, Г.И. Климентьева1
1ГОУ ВПО Ижевская государственная медицинская академия, Ижевск (ректор – д.м.н., проф. Н.С. Стрелков)
2ГОУ ВПО Российская медицинская академия последипломного образования, Москва (ректор – академик РАМН Л.К. Мошетова)
Цель. Оценить динамику секреторной и моторно-эвакуаторной функции желудка у больных сахарным диабетом 1 типа (СД1) с гастроинтестинальной формой диабетической автономной нейропатии (ДАН) и связь функционального состояния желудочно-кишечного тракта с показателями вегетативного равновесия в организме и физической реабилитации.
Материал и методы. Обследовано 32 больных СД1 без патологии желудочно-кишечного тракта, отнесенных в разные группы в зависимости от длительности СД (1 – длительность СД менее 10 лет; 2 – СД более 10 лет). Состояние вегетативного равновесия оценивалось по индексу Кердо, реабилитационные возможности организма – определением базовой составляющей реабилитационного потенциала – морфофизиологического индекса (МФИ). Моторно-эвакуаторная функция желудка изучалась с помощью сцинтилляционной гаммы-камеры, секреторная функция желудка оценивалась интрагастральной рН-метрией.
Результаты. Среди больных с длительностью диабета до 10 лет преобладали пациенты с гиперсимпатикотонией (50%). С увеличением продолжительности заболевания СД наблюдалась тенденция к преобладанию гипертонической формы тонуса желудка. По данным динамической рН-метрии выявлено прогрессирующее снижение кислотообразующей функции желудка, а по данным гастросцинтиграфии – снижение его эвакуаторной функции. Наиболее значимое снижение пропульсивной функции (выделение зон интереса при гастросцинтиграфии) отмечено в пилорическом отделе желудка. Функциональные изменения желудочно-кишечного тракта у больных СД1 не зависели от компенсации углеводного обмена, но коррелировали (r=-0,39) с давностью сахарного диабета. Эффективность реабилитации больных СД1 с гастроинтестинальной формой диабетической нейропатии была значительно хуже, чем у больных с сохраненной вегетативной функцией желудочно-кишечного тракта.
Заключение. С увеличением длительности СД1 наблюдается ослабление эвакуаторной функции желудка и двенадцатиперстной кишки, что может быть одной из причин нестабильности уровня глюкозы в крови. Гипомоторная дискинезия верхнего отдела желудочно-кишечного тракта, связанная с развитием диабетической нейропатии и недостаточностью парасимпатической иннервации, чаще наблюдалась у больных с низким реабилитационным потенциалом. Развитие гастроинтестинальной формы ДАН снижает реабилитационные возможности пациентов с СД1.
Ключевые слова: сахарный диабет, диабетическая вегетативная нейропатия, клинико-экспертная диагностика, гастросцинтиграфия
Диабетическая нейропатия является частым осложнением сахарного диабета (СД), при котором в патологический процесс вовлекаются различные отделы нервной системы, приводя к развитию соответствующих клинических проявлений [1, 2]. В основе гастроинтестинальных нарушений при СД лежит вегетативная дисфункция, связанная с прогрессированием диабетической автономной нейропатии (ДАН) [3, 4]. Хорошо известно, что наибольшую опасность для жизни больного представляет кардиальная автономная нейропатия [5, 6, 7], однако и другие формы вегетативной нейропатии, развиваясь вследствие СД, способствуют более тяжелому течению заболевания.
Таблица 1. Распределение больных СД1 по данным оценки вегетативного равновесия
|
|
Вегетативный индекс Кердо | ||
| Группы наблюдения | ВИ=0 | ВИ<0 | ВИ>0 |
| 1-я группа (n=18) | 6 (33,3%) | 3 (16,7%) | 9 (50%) |
| 2-я группа (n=15) | 2 (13,3%) | 8 (53,3%) | 5 (33,4%) |
Таблица 2. Распределение больных СД1 по данным оценки гастросцинтиграфии
|
|
Тип эвакуации пищи из желудка | ||
| Группы наблюдения | ускоренный | замедленный | нормальный |
| 1-я группа (n=18) | 7 (39%) | 9 (50%) | 2 (8%) |
| 2-я группа (n=15) | 4 (26,7%) | 11 (73,3%) | 0 |
Появление у больного гастроинтестинальной формы диабетической нейропатии влияет на процессы переваривания и всасывания пищи в желудочно-кишечном тракте, формирование патологических рефлюксов, дисфагии и диареи, что создает сложности в подборе инсулинотерапии и таблетированных лекарственных препаратов, снижает эффективность лечения и реабилитации этих пациентов [4, 8, 9]. Клинические проявления гастроинтестинальной формы диабетической нейропатии разнообразны, не всегда явно выражены, часто недооцениваются как самим пациентом, так и лечащим врачом, поэтому достаточно поздно диагностируются и редко подвергаются целенаправленной терапии. Клинические симптомы зависят от уровня поражения желудочно-кишечного тракта и проявляются дисфагией, гастропарезом, гипо- или гиперкинезией кишечника и желчного пузыря. Как правило, диагноз устанавливается, когда пациентов, на фоне потери веса, беспокоят тошнота и рвота [1, 4, 5], не обусловленные органическими нарушениями со стороны желудка и кишечника. Отдельной проблемой является диагностика вегетативной недостаточности желудочно-кишечного тракта у больных СД [4]. Как правило, это – «диагноз исключения», как и «синдром раздраженного кишечника» у больных без диабета. Методы, используемые для исследования вегетативных функций в желудочно-кишечной системе, основаны на изучении моторики желудочно-кишечного тракта, находящегося под контролем парасимпатического и симпатического отделов вегетативной нервной системы [10]. К методам определения состояния парасимпатического эфферентного пути относятся: исследование экскреторной функции и определение кислотности желудочного сока.
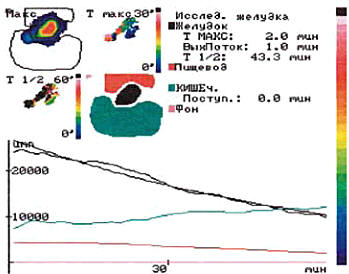
Рис. 1. Удовлетворительный тип опорожнения желудка, моторно-эвакуаторная функция близка к норме – Т1/2 43,3 мин (норма 45 мин)
Цель
Оценить динамику секреторной и моторно-эвакуаторной функции желудка у больных СД 1 типа (СД1) с гастроинтестинальной формой ДАН и связь функционального состояния желудочно-кишечного тракта с показателями вегетативного равновесия в организме и физической реабилитации.
Материал и методы
Было обследовано 32 больных СД1 обоего пола в возрасте от 18 до 49 лет. У 18 больных длительность диабета была от 2 до 10 лет (1-я группа), у 15 – более 10 лет (2-я группа). Основным критерием отбора больных для исследования было отсутствие жалоб и заболеваний со стороны желудочно-кишечного тракта. Состояние вегетативного равновесия определялось в соответствии с вегетативным индексом Кердо (ВИ): ВИ=0 – состояние эйтонии, ВИ<0 характеризовал состояние гиперпарасимпатикотонии, ВИ>0 – состояние гиперсимпатикотонии.
Методы исследования вегетативных функций в желудочно-кишечной системе: моторно-эвакуаторная функция изучалась с помощью сцинтилляционной гамма-камеры МВ-9200, оснащенной ЭВМ «Микросегамс» (Венгрия). Пробный завтрак включал 200 г сметаны + 150 г белого хлеба + радионуклид ная метка (коллоидный раствор In113 с общей активностью 4–7 МВк). Величина дозы облучения желудка – 0,7 mGy. Исследование проводилось в течение часа в положении лежа.

Рис. 2. «Гипертоническая» форма желудка. Ускоренная эвакуация пробного завтрака из желудка, быстрое поступление пищи в 12-перстную кишку и быстрое продвижение меченого завтрака по тонкой кишке. Демпинг-синдром 2 ст. (T1/2 24,1 мин)
Рис. 3. Ортотоническая форма желудка, замедленная эвакуация пробного завтрака из желудка в кишечник (Т1/2 73,4 мин)
Таблица 3. Показатели кислотообразующей функции желудка
| Критерии | Кислотообразующая функция желудка (рН-метрия) | ||
| Группы наблюдения | Гиперацидность | Гипоацидность | Нормоацидность |
| 1-я группа (n=18) | 9 (50%) | 5 (28%) | 4 (22%) |
| 2-я группа (n=15) | 8 (53,4%) | 2 (13,3%) | 5 (33,3%) |
Методы оценки функционального состояния пищеварительной системы: секреторная функция желудка изучалась с помощью интрагастральной рН-метрии (аппарат «АГМИ-01», «Исток-система», Фрязино, Московская область). Оценивали рН антрального отдела, тела желудка и нижней трети пищевода.
Методы оценки вегетативного равновесия и реабилитационных возможностей организма: вычисление ВИ Кердо; определение базовой составляющей реабилитационного потенциала – морфо-физиологического индекса (МФИ) (патент № 2344751 от 27.01.2009 г.).
Все пациенты подписали информированное согласие на участие в исследовании.
Результаты
Результаты вегетативного равновесия представлены в таблице 1.
У 50% пациентов 1-й группы наблюдалась гиперсимпати-котония (табл. 1). Полученные результаты идеально совпадают с показателями скорости эвакуации пищи из желудка – замедленный тип эвакуации также наблюдался у 50% пациентов 1-й группы (Т1/2=51,1±5,7 мин). Распределение пациентов по типу эвакуации (по данным гастросцинтиграфии) представлено в таблице 2.
Графическое изображение, полученное при проведении динамической гастросцинтиграфии (ГСГ), представлено на рисунках 1-3 с отражением наиболее распространенных вариантов нарушений.
В 1-й группе у 39% больных наблюдался ускоренный тип эвакуации (Т1/2=31,8±4,5 мин), у 8% – нормальный (Т1/2=43,3±2,1 мин). У больных 2-й группы моторно-эвакуаторная функция желудка не соответствовала вегетативному тонусу сердечно-сосудистой системы, что свидетельствовало о грубом нарушении регуляторных процессов у больных с длительным течением СД.
Наблюдался ускоренный тип эвакуации пищи из желудка (Т1/2=24,1±3,9 мин) с наличием желудочно-пищеводного рефлекса у 26,7% и замедленный (Т1/2=73,4±6,3 мин) у 73,3% больных. При эйтонии отмечена ускоренная эвакуация радиоактивной метки из желудка у 2 чел. (25%); замедленная эвакуация радиоактивной метки из желудка у 6 чел. (75%).
На втором этапе исследования все больные были распределены на две группы в зависимости от уровня компенсации СД: 1-я группа (10 человек) – хорошая компенсация СД (НbА1с ср. = 6,14±1,1%), 2-я группа (22 человек) – неудовлетворительная компенсация СД (НbА1с=11,8±1,2%). При сравнении данных динамической ГСГ в зависимости от уровня компенсации CД не было получено достоверных различий: 1-я группа – Т1/2=46,6±8,0 мин, 2-я группа – Т1/2=44,1±6,4 мин. С увеличением продолжительности заболевания СД наблюдалась тенденция к преобладанию гипертонической формы тонуса желудка. В то же время нами не было выявлено связи между выраженностью проявлений гастроинтестинальной автономной нейропатии и уровнем компенсации углеводного обмена.
По оценке желудочной секреции у больных с неудовлетворительной компенсацией СД чаще наблюдалось снижение секреторной функции желудка: рН тела желудка – 2,28±0,46, антрального отдела – 2,57±0,54. Желудочная секреция изменялась дифференцированно в зависимости от длительности СД. В 1-й группе больных рН тела желудка была 1,72±0,32, во 2-й группе – 1,98±0,13 (р≤0,05), на уровне пилорического отдела различия еще достовернее (р≤0,001) (табл. 3).
Таблица 4. Корреляции между функциональными нарушениями желудочно-кишечного тракта и давностью СД (r)
| Критерии | Длительность СД | ГСГ Т1/2 | рН |
| Длительность СД | 1,0 | -0,39 | -0,44 |
| ГСГ Т1/2 | -0,39 | 1,0 | 0,52 |
| рН | -0,44 | 0,52 | 1,0 |
Таблица 5. Корреляции основных показателей, характеризующих вегетативную функцию желудочно-кишечного тракта (r)
| Критерии | МФИ | ГСГ Т 1/2 | ВИ |
| МФИ | 1,0 | -0,52 | -0,29 |
| ГСГ Т1/2 | -0,52 | 1,0 | 0,08 |
| ВИ | -0,29 | 0,08 | 1,0 |
Обсуждение результатов
Понижение секреторной функции желудка у больных СД связано, с одной стороны, с уменьшением содержания или отсутствием собственной продукции одного из физиологических стимуляторов желудочной секреции – инсулина, с другой – с развитием поздних осложнений СД. Как показали ранее опубликованные нами данные, при гистологических исследованиях биоптатов слизистой желудка у больных СД с явлениями гастроинтестинальной формы автономной нейропатии нарушается регуляции желудочной секреции со стороны n. vagus и выявляются характерные для «вагусных» нарушений изменения: исчезновение миелиновых и снижение количества немиелиновых волокон [11]. Несомненно, что в этом случае имеет место и микроангиопатия слизистой оболочки желудка, что приводит к уменьшению ее кровоснабжения, развитию дистрофически-атрофических изменений. С увеличением длительности СД прогрессировала секреторная недостаточность желудка. Снижение секреторной функции сопровождалось ускоренной эвакуацией у 48% больных 1-й группы и у 80% – 2-й группы. Наличие ДАН проявлялось дистрофически-атрофическим процессом в слизистой оболочке желудка и лабильным течением СД, что коррелировало с явлениями диабетической гастропатии (r=0,54) и нарушением метаболизма лекарственных препаратов.
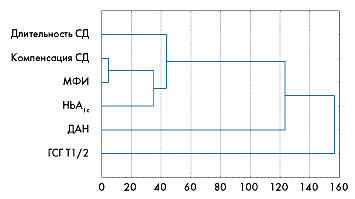
Рис. 4. Иерархическая диаграмма распределения статистически значимой взаимосвязи между МФИ и ГСГ Т1/2 (кластерный анализ)
По данным динамической рН-метрии выявлено прогрессирующее снижение кислотообразующей функции желудка, а по данным ГСГ – снижение его эвакуаторной функции. Наиболее значимое снижение пропульсивной функции (выделение зон интереса при ГСГ) отмечено в пилорическом отделе желудка. Эндоскопическая картина характеризовалась тенденцией к формированию атрофических изменений слизистой оболочки желудка. Частота регистрации эрозивно-язвенных дефектов слизистой оболочки желудка составила за первые 5 лет мониторинга 22,7%, за последующие 5 лет – 63,6%. По данным фиброгастроскопии, проведенной в 2003-2006 г., только в 7 случаях не было зарегистрировано эрозивно-язвенных дефектов слизистой оболочки. Функциональное состояние желудочно-кишечного тракта не зависело от компенсации СД, но выявило достаточный уровень корреляции с длительностью диабета (табл. 4).
Отмечено значительное взаимное влияние гастроинтестинальной формы диабетической нейропатии и биологической составляющей реабилитационного потенциала – МФИ (табл. 5).
Эффективность реабилитации больных СД1 с гастроин-тестинальной формой диабетической нейропатии была значительно хуже, чем у больных с сохраненной вегетативной функцией желудочно-кишечного тракта. Полученные данные подтверждены результатами кластерного анализа (рис. 4).
Выводы
1. Отмечена прямая корреляция между длительностью заболевания, лабильным течением СД и снижением секреторной функции желудка вследствие ДАН.
2. Преобладание парасимпатической активности сопровождалось гиперацидностью и ускоренной эвакуацией на уровне желудка и двенадцатиперстной кишки и наблюдалось у больных с низким реабилитационным потенциалом.
3. Функциональные изменения желудочно-кишечного тракта у больных СД1 не зависели от компенсации углеводного обмена, но коррелировали (r=-0,39) с длительностью СД.
Литература
1. Клинические рекомендации. Эндокринология / Под ред. И.И. Дедова, Г.А. Мельниченко. – М.: ГЭОТАР-Медиа, 2008. – 304 с.
2. Кеттайл В.М., Арки Р.А. Патофизиология эндокринной системы – М., 2001. – 336 с.
3. Балаболкин М.И., Чернышова Т.Е., Трусов В.В., Гурьева И.В. Диабетическая нейропатия: патогенез, диагностика, классификация, прогностическое значение, лечение: учебно-методическое пособие. – М.: Экспертиза, 2003. – С. 3–105.
4. Строков И.А., Аметов С.А., Козлова Н.А., Галеев И.В. Клиника диабетической невропатии // Русский медицинский журнал. – 1998. – Т. 6, № 12. – С. 787–801.
5. Neuropathies. Pathomechanism, clinical presentation, diagnosis, therapy / Ed. by P. Kempler. – Springer, 2002. – 208 p.
6. Watkins P.J., Thomas P.K. Diabetes mellitus and the nervous system // J. Neurol. Neurosurg. Psychiatr. – 1998. – Vol. 65. – P. 620–633.
7. DCCT Research Group. The effect of intensive diabetes therapy on the development and progression of neuropathy // Ann. Jntern. Med. – 1995. – № 122. – Р. 561–568.
8. Antioxidants in Diabetes Management / Eds. L. Packer et al. – New York, 2000. – P. 1–15.
9. Sima A.A.F., Zhang W., Sugimoto K., Henry D., Li Z., Wahren J., Grunberger G. C-peptide prevents and improves chronic The I diabetic polyneuropathy in the BB.Wor rat. // Diabetologia. – 2001. – № 44.
10. Вегетативные расстройства: Клиника, диагностика, лечение / Под ред. А.М. Вейна. – М.: ООО «Медицинское информационное агентство», 2003. – 752 с.
11. Этапы формирования диабетической гастропатии / Т.Е. Чернышова [и др.] [Электронный ресурс] – Режим доступа: http://www.gastro. h12/nogr4.htm.
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru



