Содержание статьи
Введение
Распространенность сахарного диабета (СД) в мире ежегодно неуклонно возрастает. По данным Международной диабетической федерации (The International Diabetes Federation, IDF), в 2021 г. около 537 млн человек имели данное заболевание, а по прогнозам, к 2045 г. ожидается увеличение этой популяции пациентов до 783 млн человек [1]. Сахарный диабет 2 типа (СД2) в значительной степени связан с атеросклеротическими сердечно-сосудистыми заболеваниями (АССЗ) и является фактором риска развития сердечной недостаточности (СН); пациенты с СД госпитализируются по поводу СН в 4 раза чаще, чем пациенты без нарушения углеводного обмена [2–5]. Кроме того, СД2 является фактором риска развития хронической болезни почек (ХБП) и терминальной ХБП [6–8]. Результаты крупных рандомизированных клинических исследований продемонстрировали способность относительно нового класса препаратов — ингибиторов натрий-глюкозного котранспортера 2 типа (иНГЛТ-2) не только эффективно влиять на показатели гликемического контроля, но и снижать частоту неблагоприятных сердечно-сосудистых событий и почечных исходов у пациентов с СД2. В связи с этим применение иНГЛТ-2 в повседневной клинической практике вызывает интерес не только у эндокринологов, но и у врачей смежных специальностей.
Ингибиторы натрий-глюкозного котранспортера 2 типа — от фармакодинамики к клинической эффективности
Канаглифлозин является представителем класса иНГЛТ-2, который не только оказывает блокирующее влияние на НГЛТ-2, но и вызывает умеренное ингибирование НГЛТ-1 (отношение констант ингибирования НГЛТ-2/НГЛТ-1 около 1:200) [9]. Почки фильтруют и реабсорбируют около 180 г глюкозы в сутки, при этом у пациентов с СД2 почечная реабсорбция глюкозы увеличивается [10]. Основную роль в почечной реабсорбции глюкозы играет НГЛТ-2, который является высокоаффинным мощным транспортером и располагается в S1- и S2-сегментах проксимального извитого канальца нефрона и опосредует большую часть (90%) реабсорбции почечной глюкозы из первичного клубочкового фильтрата; НГЛТ-1 локализуется в S3-сегменте проксимального почечного канальца и отвечает за реабсорбцию 10% глюкозы [11]. На фоне сахароснижающей терапии неселективными иНГЛТ-2 дальнейшая реабсорбция глюкозы в проксимальном извитом канальце нефрона происходит при помощи НГЛТ-1, которым захватывается до 45% глюкозы (рис. 1) [12]. Таким образом, канаглифлозин, являясь представителем класса иНГЛТ-2, обладает двойным механизмом действия в отношении ингибирования НГЛТ-1 и -2, вызывая дополнительное увеличение суточной экскреции глюкозы с мочой.
![Рис. 1. Механизм действия неселективного ингибитора НГЛТ-2 в почках [12] Рис. 1. Механизм действия неселективного ингибитора НГЛТ-2 в почках [12]](https://medblog.su/wp-content/uploads/2022/04/preimushhestva-ingibirovaniya-natrij-glyukoznogo-kotransportera-1-tipa-v-povsednevnoj-klinicheskoj-praktike-maloletkina-e-s-fadeev-v-v.png)
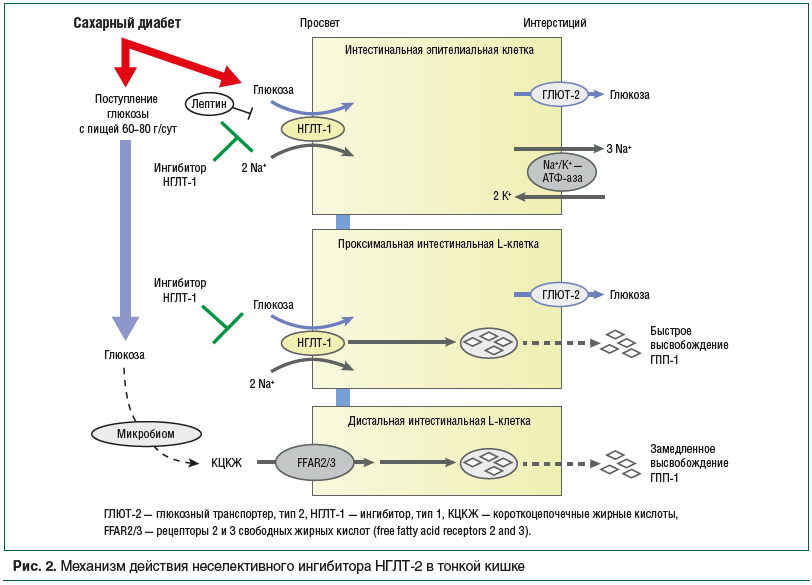
Натрий-глюкозный котранспортер 1 типа экспрессируется во многих клетках организма, в том числе в почках, тонкой кишке, миокарде, легких, печени. НГЛТ-1 в тонкой кишке локализуется на апикальной поверхности энтероцитов щеточной каемки, принимая активное участие в реабсорбции глюкозы, поступающей в просвет тонкой кишки вместе с пищей. Также НГЛТ-1 локализуются в субапикальных отделах энтероцита, тем самым обеспечивая быстрое увеличение количества белка-переносчика в случае поступления большого количества глюкозы в просвет кишки, увеличивая эффективность ее всасывания. Экспрессия НГЛТ-1 на поверхности энтероцита регулируется несколькими сигнальными каскадами: активируется при СД (экспрессия НГЛТ-1 на энтероците в 4 раза выше при СД, чем у лиц без нарушений углеводного обмена); подавляется лептином и фармакологическими препаратами [11]. Механизм работы НГЛТ-1 в тонкой кишке представлен на рисунке 2. Глюкоза из просвета кишки совместно с двумя ионами натрия поступает в просвет энтероцита, а далее при помощи Na+/K+-АТФ-азы и глюкозного транспортера типа 2 (ГЛЮТ-2) — в системный кровоток. Фармакологическое ингибирование НГЛТ-1 в проксимальных отделах тонкой кишки приводит к увеличению поступления глюкозы в дистальные отделы тонкого кишечника. Микробиота дистальных отделов тонкой кишки способствует метаболизму глюкозы до короткоцепочечных жирных кислот, которые при взаимодействии с рецептором свободных жирных кислот на поверхности L-клетки проникают в нее и запускают устойчивую секрецию глюкагоноподобного пептида-1 (ГПП-1) [12]. Таким образом, канаглифлозин за счет ингибирования НГЛТ-1 приводит к снижению абсорбции глюкозы в проксимальном отделе тонкой кишки, способствуя значительному снижению пиков постпрандиальной гликемии, вызывая отсроченное всасывание глюкозы в тонкой кишке, препятствуя возможной мальабсорбции.
Оценка эффективности канаглифлозина в достижении оптимального гликемического контроля (гликированный гемоглобин (HbA1c), глюкоза плазмы натощак (ГПН)) и других метаболических показателей (масса тела, АД, липопротеины высокой плотности) по сравнению с плацебо и другими классами сахароснижающих препаратов представлена во многих РКИ [13–19].
K. Stenlof et al. [13] оценивали эффективность канаглифлозина в дозах 100 мг/сут или 300 мг/сут по сравнению с плацебо у пациентов с СД2, не достигших компенсации на фоне модификации образа жизни. Через 26 нед. у пациентов из групп канаглифлозина 100 мг/сут и 300 мг/сут было отмечено снижение уровня HbA1c на 0,81% (95% ДИ 0,94; 0,68) и 1,11% (95% ДИ 1,24; 0,98) соответственно, в группе плацебо динамики показателя не было выявлено. Также наблюдалось снижение уровня глюкозы плазмы натощак и постпрандиальной гликемии в группах канаглифлозина 100 мг и 300 мг по сравнению с плацебо. T. Yang et al. [14] в ходе метаанализа оценивали эффективность канаглифлозина при дополнительном назначении пациентам с СД2, находящимся на монотерапии метформином. Прием канаглифлозина в дозах 100 мг/сут или 300 мг/сут по сравнению с приемом плацебо статистически значимо снижал уровень HbA1c (-0,59%, 95% ДИ от 0,67% до 0,51%; 0,74%, 95% ДИ от -0,82% до -0,66% соответственно, p<0,00001 в обоих случаях), а также значения ГПН на 1,49 ммоль/л и 1,80 ммоль/л соответственно. J.P. Wilding et al. [15] оценивали эффективность канаглифлозина при дополнительном назначении с препаратами сульфонилмочевины и метформином. Через 26 нед. наблюдения было продемонстрировано снижение HbA1c в группах канаглифлозина 100 мг/сут и 300 мг/сут на 0,85% и 1,06% соответственно, тогда как в группе плацебо показатель снизился на 0,13% (p<0,001). Аналогичную эффективность в достижении показателей гликемического контроля канаглифлозин в суточных дозах 100 мг и 300 мг продемонстрировал в рамках РКИ при добавлении к двухкомпонентной схеме, включающей метформин и тиазалидиндионы [16], метформин и ингибиторы дипептиди лпептидазы-4 [17], а также к инсулинотерапии [18]. Результаты проведенных РКИ свидетельствуют о наличии у препарата четкого дозозависимого эффекта — максимальное снижение уровня HbA1c, ГПН наблюдалось на фоне приема канаглифлозина в суточной дозе 300 мг. Вместе с тем сравнительная оценка эффективности разных представителей класса препаратов иНГЛТ-2 между собой в рамках РКИ не проводилась. По результатам ретроспективного исследования, проведенного L. Blonde et al. [20], у пациентов с СД2 на фоне терапии канаглифлозином 300 мг/сут по сравнению с пациентами, получающими дапаглифлозин 10 мг/сут, наблюдалось более значительное снижение уровня HbA1c; доля пациентов с приемлемым уровнем HbA1c в группе канаглифлозина также была выше. В исследовании проанализированы показатели гликемического контроля 1116 участников (по 558 участников в группе канаглифлозина 300 мг/сут и дапаглифлозина 10 мг/сут) за 6-месячный срок лечения. Через 6 мес. наблюдения доля пациентов, достигших уровня HbA1c<8%, в группе канаглифлозина 300 мг/сут составила 70,8% против группы дапаглифлозина 10 мг/сут 59,1% (ОР 1,6; 95% ДИ от 1,26 до 2,04; р=0,0001). Доля пациентов с уровнем HbA1c<7% составила 36,7% против 24,1% для канаглифлозина и дапаглифлозина соответственно (ОР 1,75; 95% ДИ от 1,34 до 2,2; р<0,001); динамика снижения уровня HbA1c за 6 мес. в группе канаглифлозина 300 мг/сут составила -1,17%, в то время как в группе дапаглифлозина 10 мг/сут — -0,91% (р=0,0049).
F. Zaccardi et al. [21] провели метаанализ РКИ и продемонстрировали преимущества терапии канаглифлозином в суточной дозе 300 мг по сравнению с другими изученными препаратами этого класса (канаглифлозин 100 мг/сут, дапаглифлозин 5 мг/сут или 10 мг/сут, эмпаглифлозин 10 мг/сут и 25 мг/сут) в различных дозах за счет наибольшего влияния на снижение HbA1c, глюкозы плазмы натощак и систолического АД. При этом терапия самыми высокими дозами всех представителей класса иНГЛТ-2 не различалась в отношении динамики массы тела, снижения диастолического АД и уровня ЛПВП [21]. Преимущества канаглифлозина 300 мг/сут по влиянию на показатели гликемического контроля по сравнению с другими представителями этого класса сахароснижающих препаратов можно объяснить, исходя из двойного механизма его действия. Дополнительное ингибирование НГЛТ-1 в почках ‘e8 тонкой кишке способствует большей экскреции глюкозы почками и снижению пиков постпрандиальной гликемии за счет замедления всасывания глюкозы в тонкой кишке.
Сердечно-сосудистые и почечные исходы у пациентов с СД2 на фоне терапии канаглифлозином
Влияние канаглифлозина на сердечно-сосудистые и почечные исходы у пациентов с СД2 и высоким сердечно-сосудистым риском изучалось в рамках программы CANVAS. В ней оценивалось влияние препарата на частоту развития серьезных неблагоприятных сердечно-сосудистых событий (major adverse cardiovascular events, MACE), к которым относились нефатальный инфаркт миокарда, нефатальный инсульт, сердечно-сосудистая смерть, а также влияние канаглифлозина на суточною альбуминурию. В исследование вошли 10 145 участников, из них 65% имели сердечно-сосудистые заболевания, 35% — факторы риска, период наблюдения пациентов составил 7 лет. Результаты исследования демонстрируют снижение риска МАСЕ в группе канаглифлозина по сравнению с плацебо на 14% (ОР 0,86; 95% ДИ от 0,75 до 0,97). У пациентов с доказанными сердечно-сосудистыми заболеваниями отмечено снижение МАСЕ на 18% (ОР 0,82; 95% ДИ от 0,72 до 0,95), при этом была продемонстрирована тенденция к снижению каждого из компонентов МАСЕ. При оценке вторичных конечных точек было доказано снижение рисков госпитализации по поводу СН в группе канаглифлозина по сравнению с плацебо на 33% (ОР 0,67; 95% ДИ от 0,52 до 0,87); а снижение доли пациентов, которым требовалась госпитализация по поводу СН и сердечно-сосудистой смертности, — на 22% (ОР 0,75; 95% ДИ от 0,67 до 0,91) [22].
При оценке терапии канаглифлозином на почечные исходы у пациентов с СД2 и относительно сохранным функциональным состоянием почек по сравнению с группой плацебо наблюдалось снижение риска прогрессирования альбуминурии на 27% (ОР 0,73; 95% ДИ от 0,67 до 0,79); уменьшение риска снижения рСКФ, терминальной ХБП и смерти от почечных причин на 40% по сравнению с плацебо. Также продемонстрировано увеличение вероятности регресса альбуминурии на 70% на фоне терапии канаглифлозином (ОР 1,7; 95% ДИ от 1,5 до 1,9), что может способствовать нефропротекции у пациентов с СД2 на ранних стадиях нефропатии [23].
Результаты, полученные в рамках РКИ, подтверждаются рядом наблюдательных клинических исследований. Так, в исследовании CVD-REAL Study сравнивалось влияние инициации терапии иНГЛТ-2 в сравнении с другими классами сахароснижающих препаратов на сердечно-сосудистые исходы у пациентов с СД2. В анализ включено 309 056 пациентов из Дании, Норвегии, Швеции, Великобритании и США, из них 154 528 пациентов получали препараты иНГЛТ-2 (канаглифлозин — 53%, дапаглифлозин — 42%, эмпаглифлозин — 5%). По результатам исследования инициация сахароснижающей терапии препаратами класса иНГЛТ-2 у пациентов с СД2 приводила к снижению рисков госпитализации по поводу СН (ОР 0,61; 95% ДИ от 0,51 до 0,73; р<0,001), снижению смертности от всех причин (ОР 0,49; 95% ДИ от 0,41 до 0,57; р<0,001) [24]. В последующем наблюдательном исследовании CVD-REAL-2 приняли участие 235 064 пациента. По результатам работы продемонстрировано, что терапия иНГЛТ-2 по сравнению с иными классами сахароснижающих препаратов также ассоциирована с более низкими рисками сердечно-сосудистых исходов, включая статистически значимо (p≤0,001) более низкий риск развития инфаркта миокарда (ОР 0,81; 95% ДИ от 0,74 до 0,88,); инсульта (ОР 0,68; 95% ДИ от 0,55 до 0,84); госпитализации по поводу СН (ОР 0,64; 95% ДИ от 0,74 до 0,8) и смерти (ОР 0,51; 95% ДИ от 0,37 до 0,7) [25]. В исследовании CVD-REAL-3, в котором приняли участие пациенты из Израиля, Италии, Японии, Тайваня и Великобритании (n=65 321), наблюдались более низкие темпы снижения почечной функции в группе иНГЛТ-2 по сравнению с препаратами других классов [26].
Исследование CREDENCE [27] представляло собой двойное слепое плацебо-контролируемое РКИ, целью которого являлась оценка влияния канаглифлозина на почечные исходы у пациентов с СД2 с высоким, очень высоким риском сердечно-сосудистых событий и ранее диагностированной ХБП. В работу был включен 4401 пациент с СД2 с расчетной скоростью клубочковой фильтрации (рСКФ) от 30 (включительно) до 90 мл/мин/1,73 м2, альбуминурией от ≥300 мг/г до <5000 мг/г; все пациенты получали терапию, направленную на блокаду ренин-ангиотензин-альдостероновой системы; продолжительность исследования составила 2,6 года. Пациенты были рандомизированы в 2 группы: 1-я — канаглифлозин 100 мг/сут; 2-я — плацебо, а также были стратифицированы в соответствии с исходной рСКФ (от ≥30 до <45, от ≥45 до <60 и от ≥60 до <90 мл/мин/1,73 м2). Исследование закончилось досрочно, поскольку соответствовало заранее установленным критериям эффективности для преждевременного прекращения. Согласно полученным результатам на фоне терапии канаглифлозином наблюдалось снижение риска первичной комбинированной кон ечной точки (терминальная ХБП, повышение в 2 раза уровня креатинина крови, смерть от почечных или сердечно-сосудистых причин) на 30% по сравнению с группой плацебо (ОР 0,7; 95% ДИ от 0,59 до 0,82; р=0,00001). Также в группе канаглифлозина наблюдались существенные различия по вторичным точкам по сравнению с группой плацебо: на 34% ниже риск развития почечных осложнений (терминальная ХБП, удвоение креатинина плазмы, смерть от почечных причин) (ОР 0,66, 95% ДИ от 0,53 до 0,81; р<0,001); на 39% ниже риск госпитализаций по поводу сердечной недостаточности (ОР 0,61; 95% ДИ от 0,47 до 0,80; р<0,001); в группе канаглифлозина риск сердечно-сосудистых осложнений (инсульт, инфаркт миокарда, сердечно-сосудистая смерть) на 20% ниже по сравнению с группой плацебо (ОР 0,8; 95% ДИ от 0,67 до 0,95; р=0,01). Частота нежелательных/серьезных явлений была за время исследования между группами канаглифлозина и плацебо сопоставимой: риск ампутации нижних конечностей — 12,3 против 11,2 на 1000 пациенто-лет в группе канаглифлозина и плацебо соответственно (ОР 1,11; 95% ДИ от 0,79 до 1,56). Таким образом, результаты проведенного исследования свидетельствуют о замедлении прогрессирования ХБП у пациентов с СД2 и ранее диагностированной ХБП. Особый интерес в повседневной клинической практике представляет назначение иНГЛТ-2 пациентам с СД2 и уже имеющимся существенным снижением рСКФ ввиду возможного дальнейшего снижения этого параметра в течение первых недель терапии.
Вторичный анализ исследования CREDENCE был посвящен эффективности канаглифлозина у пациентов с СД2 в зависимости от стратифицированного значения рСКФ. Так, терапия канаглифлозином была ассоциирована с замедлением темпов снижения рСКФ в группе пациентов с ХБП С3а на 60%, в группе пациентов с ХБП С3б — на 65% [28].
Целью другого субанализа исследования CREDENCE являлась оценка эффективности и безопасности назначения канаглифлозина пациентам с рСКФ <30 мл/мин/1,73 м2. В группе канаглифлозина по сравнению с плацебо наблюдалось снижение темпов прогрессирования ХБП (различие в скорости снижения рСКФ составило 66%, снижение альбуминурии — на 33%). Частота развития острого почечного повреждения на фоне терапии канаглифлозином между группой пациентов с рСКФ <30 мл/мин/1,73 м2 и группой с рСКФ ≥30 мл/мин/1,73 м2 была сопоставимой; различий по влиянию на сердечно-сосудистые исходы и смертность между группами пациентов с ХБП С3б и ХБП С4 также выявлено не было [29].
Таким образом, в реальной клинической практике рекомендации по продолжению ранее подобранной терапии канаглифлозином пациентам с СД2 и ХБП С4 могут быть оправданными с точки зрения достижения существенного нефропротективного эффекта без увеличения риска острого почечно го повреждения. Вместе с тем стоит заметить, что инициация сахароснижающей терапии канаглифлозином при рСКФ <30 мл/мин/1,73м2 не рекомендуется.
Изменение подхода к выбору стратегии сахароснижающей терапии у пациентов с СД2
Результаты клинических исследований по влиянию сахароснижающих препаратов на сердечно-сосудистые и почечные исходы у пациентов с АССЗ и высоким сердечно-сосудистым риском при СД2 отражены в клинических рекомендациях ведущих эндокринологических сообществ [30–33]. Важна не только эффективность терапии в отношении достижения гликемического контроля, но и ее безопасность, а также персонифицированный подход к выбору терапии, исходя из стратификации сердечно-сосудистого риска у пациента.
Российская ассоциация эндокринологов рекомендует в случае высокого риска АССЗ или наличия у пациента АССЗ, ХСН, ХБП включать в схему лечения препараты класса агонистов рецепторов ГПП-1 (арГПП-1) и иНГЛТ-2 (см. таблицу). Вместе с тем стоит отметить, что, если у обсуждаемой категории пациентов с СД2 целевые параметры гликемического контроля достигнуты на фоне терапии иными классами сахароснижающих препаратов, целесообразно рассмотреть коррекцию проводимого лечения с заменой на препараты группы иНГЛТ-2 и арГПП-1 с подтвержденными преимуществами в улучшении кардиоренального прогноза.

Таким образом, иНГЛТ-2 в современных рекомендациях по лечению коморбидных пациентов с СД2 являются препаратами первой линии выбора во многих клинических ситуациях. У пациентов с ХБП и выраженной альбуминурией (альбумин-креатининовое соотношение 30 мг/моль) среди имеющихся иНГЛТ-2 препарат первой линии — канаглифлозин, так как он имеет доказательную базу в замедлении прогрессирования ХБП у этой категории пациентов.
Заключение
На сегодняшний день иНГЛТ-2 обладают обширной доказательной базой с подтвержденными кардио- и нефропротективными эффектами у пациентов с СД2. Канаглифлозин является иНГЛТ-2 с дополнительным по отношению к другим представителям этого класса двойным инсулинонезависи ecым механизмом действия, связанным с ингибированием не только НГЛТ-2 почек, но и НГЛТ-1 в кишечнике и почках, что может способствовать лучшему контролю гликемии, в том числе постпрандиальной. Канаглифлозин обладает доказанной эффективностью в отношении снижения риска неблагоприятных сердечно-сосудистых событий (нефатальный инфаркт миокарда, нефатальный инсульт и сердечно-сосудистая смерть у широкого круга пациентов), а также снижает риски, связанные с СН, у пациентов с СД2. Доказанные нефропротективные свойства канаглифлозина легли в основу зарегистрированного показания по снижению риска прогрессировани я почечных и сердечно-сосудистых исходов у пациентов с СД2 и диабетической нефропатией. Кроме того, благоприятный профиль безопасности и переносимости препарата делает возможным его широкое применение для лечения СД2.
.
Информация с rmj.ru





