Введение
В последние 15 лет значительно возросло использование генно-инженерных биологических препаратов в онкологии, гематологии, ревматологии, гастроэнтерологии и в других областях медицины. Расширение применения таргетных противоопухолевых и иммуносупрессорных препаратов сопровождается возрастанием как риска редких оппортунистических инфекций, так и частоты необычного течения распространенных.. Такая ситуация ставит перед врачами различных специальностей новые задачи по своевременному распознаванию и лечению ранее практически не встречавшихся клинических синдромов. Тяжелое течение энтеровирусной инфекции с формированием специфической клинической картины может быть проиллюстрировано следующим клиническим наблюдением.
Клиническое наблюдение
Пациентка З., 38 лет, обратилась в клинику 06.07.2020 с жалобами на выраженные диффузные отеки, увеличение размеров живота, осиплость голоса, повышение температуры тела до 39 °С без озноба, распространенные мышечные боли.
В 2018 г.. у пациентки выявлена В-клеточная лимфома, фолликулярная, 1–2 типа с нодулярно-диффузным ростом. Проведено 6 курсов полихиомиотерапии по схеме G (обинутузумаб) — СНОР. Переносила химиотерапию без особенностей.. Поддерживающая терапия проводилась обинутузумабом, последнее введение — 19.04.2020 в дозе 1000 мг. Спустя 7 дней после введения пациентка отметила появление мышечной боли, отеков ног и рук.. С течением времени боль нарастала, пациентка не могла садиться на унитаз. Постепенно нарастали отеки, отмечалась прибавка массы тела на 11 кг за 2 мес. после последнего введения обинутузумаба, появилась осиплость голоса. С середины июня пациентка отметила повышение температуры тела до 39 °С без озноба. Самостоятельно принимала антипиретики (ибупрофен, парацетамол) — без эффекта. Объективно при осмотре кожные покровы горячие и бледные, температура тела повышена до 39,6 °С. Обращали на себя внимание выраженные тестоватые диффузные отеки, выявлявшиеся и в проксимальных, и в дистальных частях конечностей, на туловище, лице. Аускультативно над поверхностью обоих легких выслушивалось жесткое везикулярное дыхание, которое не проводилось слева ниже VII ребра, справа — ниже V ребра. ЧСС 110–120 в минуту, ритм правильный.. АД 100/70 мм рт. ст. Живот увеличен в объеме за счет асцита, при пальпации безболезненный. Диурез снижен (со слов пациентки). Стул без особенностей.
В лабораторных данных отмечалось значительное повышение показателей острофазового воспалительного ответа (повышение уровней прокальцитонина, ферритина), признаки повреждения поперечно-полосатых мышц (повышение уровней креатинфосфокиназы (КФК), миоглобина), а также увеличение активности АЛТ, АСТ и лактатдегидрогеназы (ЛДГ), источником которых могли быть различные ткани и органы (табл.. 1).
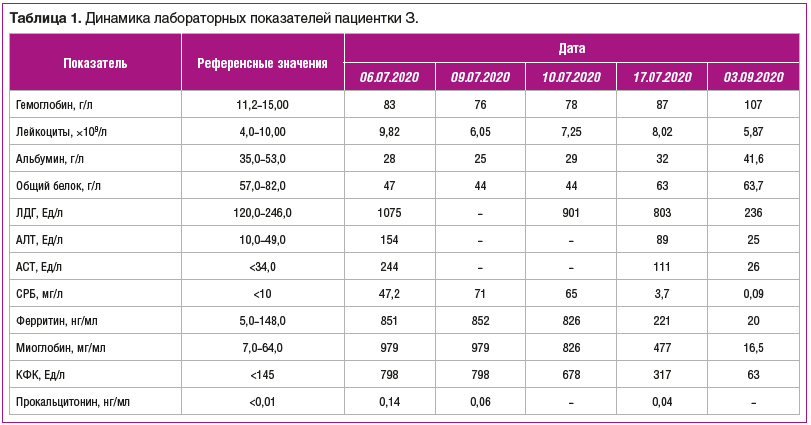
По данным ПЭТ/КТ с 18-фтордезоксиглюкозой и внутривенным контрастированием были выявлены: выраженный отек всей подкожной клетчатки (грудной стенки, брюшной стенки, спины, нижних конечностей), мезентериальной и забрюшинной клетчатки; отек стенки желчного пузыря; лимфоаденопатия забрюшинных, мезентериальных и тазовых лимфоузлов; умеренный выпот в брюшной полости и полости таза; минимальный двусторонний гидроторакс, повышенное накопление радиофармпрепарата в мышцах всех групп (рис. 1).
С учетом анамнеза длительной иммуносупрессивной терапии были проведены ПЦР-тесты на различные вирусные (учитывая изолированное повышение СРБ без выраженного повышения прокальцитонина) инфекции: парвовирус B19, вирус Эпштейна — Барр, цитомегаловирус (ЦМВ), герпесвирусы, бокавирус, аденовирус, вирус парагриппа, респираторно-синцитиальный вирус, SARS-CoV-2. Проведены серологические реакции на вирусы гепатитов.. Получены положительные результаты ПЦР-анализа крови и кала на энтеровирус 09.07.2020. Кроме того, была выявлена гипоглобулинемия: IgA 1,82 г/л (референсный интервал 0,4–3,5), IgM 0,4 г/л (0,5–3,0), IgG 5,33 г/л (6,5–16,0) и полная деплеция B-лимфоцитов (абсолютное число CD3/CD19 клеток 0×109/л). С учетом подтвержденной активной энтеровирусной инфекции и гипоглобулинемии начата терапия человеческим иммуноглобулином в суммарной дозе 0,8 г/кг массы тела в виде ежедневных внутривенных инфузий по 10 г. На фоне проводимой терапии отмечен выраженный положительный эффект: температура тела нормализовалась в течение 3 дней, отеки регрессировали, масса тела снизилась с 64 кг до 55 кг за 7 дней. Отмечена выраженная положительная динамика показателей острой фазы воспаления: уровень прокальцитонина снизился
с 0,14 нг/мл до 0,04 нг/мл, С-реактивного белка — с 71,2 мг/л до 3,7 мг/л, ферритина — с 852 нг/мл до 221 нг/мл, КФК — с 799 Ед/л до 317 Ед/л, миоглобина — с 980 нг/мл до 477 нг/мл (табл. 1). При контрольном исследовании 22.07.2020 ПЦР энтеровируса в крови и кале не обнаружено.. Пациентка была выписана на амбулаторное лечение.. В течение последующих 3 нед. отмечала субфебрильную температуру и боли в мышцах только при значительной физической нагрузке. Была повторно осмотрена через 4 мес.. после выписки: жалоб не предъявляет, состояние удовлетворительное, отеков нет, мышцы безболезненны..
Обсуждение
В настоящее время зарегистрировано в качестве лекарственных препаратов 5 моноклональных антител (табл. 2), направленных против В-лимфоцитов, из них четыре направлены против поверхностного маркера CD20 и одно (инебилизумаб) связывается с антигеном CD19.

Можно предполагать, что частота и структура инфекционных осложнений при их использовании будут одинаковыми, принимая во внимание схожий механизм действия. Однако точно это не известно, так как сравнительных исследований не проводилось. Данные о безопасности накоплены преимущественно в отношении ритуксимаба, поскольку его начали использовать раньше других препаратов.
В долгосрочном 11-летнем исследовании наблюдали 3595 пациентов с ревматоидным артритом: серьезные инфекционные осложнения возникали в группе ритуксимаба не чаще, чем в группе плацебо (3,76 события на 100 пациенто-лет в группе ритуксимаба и 3,79 события в группе плацебо) [1]. Самым частым осложнением была пневмония, которая развилась у 74/3595 (2%) больных. Однако наиболее опасными у пациентов, получавших ритуксимаб, представляются реактивация хронических вирусных инфекций и грибковые инфекции.. Монотерапия ритуксимабом довольно редко осложняется грибковыми инфекциями [2]. Наиболее важной из них следует считать пневмоцистную пневмонию.. Хотя частота развития инфекции, вызванной Pneumocystis jirovecii, не очень высока, летальность достигает 30% [3]. В 2011 г. Управлением по надзору за качеством пищевых продуктов и медикаментов США (U.S. Food and Drug Administration, FDA) в инструкцию по медицинскому применению ритуксимаба было добавлено особое предупреждение о возможности опасной реактивации вирусного гепатита B. Имеются сообщения о летальных исходах [4]. Риск реактивации вирусного гепатита B был выше при лечении лимфом, при комбинировании ритуксимаба с другими химиотерапевтическими препаратами или глюкокортикоидами [5].
В 2007 г. FDA выпустило еще одно предупреждение об опасности развития на фоне лечения ритуксимабом прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ) — инфекции головного мозга, вызываемой JC-вирусом.. K.R. Carson et al. [6] описали 57 случаев ПМЛ. Болезнь диагностировали в среднем через 5,5 мес. после введения ритуксимаба, время до наступления летального исхода в среднем равнялось 2 мес. J.R. Berger et al. [7] указали, что при лечении ревматоидного артрита ритуксимабом ПМЛ выявляется в 2,56 случая на 100 000 пациентов, при лечении гранулематоза с полиангиитом — в менее чем 1 случае на 10 000 больных.. У всех пациентов выявлялись и другие факторы риска (прием высоких доз кортикостероидов, комбинация с другими иммуносупрессантами и т. д.).
Терапия ритуксимабом может осложняться ЦВМ-инфекцией, вызывающей пневмонит, эзофагит, гастрит, энтероколит, менингоэнцефалит, ретинит [8]. Применение ритуксимаба также увеличивает частоту инфекции вирусом Varicella zoster, иногда с летальным исходом [9].
Описано значительное число случаев тяжелой энтеровирусной инфекции на фоне ритуксимаба.. Так, S. Grisariu et al. [10] представили 6 собственных и проанализировали еще 10 наблюдений, описанных ранее, в которых энтеровирусная инфекция протекала с преимущественно неврологическими проявлениями. Во всех случаях диагноз был подтвержден выявлением РНК вируса в спинномозговой жидкости методом ПЦР.. Ритуксимаб в большинстве случаев использовался для лечения лимфом в сочетании с другими противоопухолевыми препаратами. Только в двух случаях он применялся у пациентов с аутоиммунными заболеваниями. Среди проявлений инфекции чаще всего были лихорадка, мышечные боли, мышечная слабость, когнитивные нарушения, снижение слуха, речевые нарушения.. В некоторых случаях упомянуты отеки. Среди лабораторных показателей часто регистрировались гипоглобулинемия и гипоальбуминемия.. В спинномозговой жидкости во всех случаях обнаруживался лимфоцитоз и повышенное содержание белка. В большинстве обсуждаемых случаев проводилось лечение внутривенным иммуноглобулином (ВИГ). Из 5 пациентов, не получавших ВИГ, умерли 4; среди 11 пациентов, которым вводили ВИГ, отмечено 4 летальных исхода.
Позже был описан еще один случай генерализованной энтеровирусной инфекции у пациентки, получавшей поддерживающую терапию ритуксимабом и ибратинибом по поводу лимфомы клеток мантийной зоны. В клинической картине превалировали явления полимиозита, распространенного отека подкожной клетчатки с последующей нарастающей сонливостью и психическими нарушениями. Миозит был подтвержден данными магнитно-резонансной томографии и биопсии. В спинномозговой жидкости также обнаруживались лимфоцитоз, повышенный белок и РНК энтеровируса.. Энтеровирус был также обнаружен в крови, стуле и биоптате мышцы. Лечение ВИГ привело к быстрому и полному регрессу симптомов [11].
Применение других анти-CD20 препаратов также повышает риск некоторых инфекционных осложнений, спектр и частота которых предположительно схожи с таковыми при использовании ритуксимаба, однако данных в отношении новых препаратов накоплено гораздо меньше.
Риск инфекций при применении обинутузумаба изучали V. Goede et al. [12] в рамках рандомизированного клинического исследования по применению препарата для начального лечения хронического миелолейкоза.. В исследование был включен 781 пациент.. Участников рандомизировали в 3 группы: группу хлорамбуцила, группу комбинации обинутузумаба и хлорамбуцила и группу комбинации ритуксимаба и хлорамбуцила.. Частота развития инфекционных осложнений 3–5-й степени составляла 11–14% и не отличалась во всех трех группах.. Наиболее часто развивались бактериальные осложнения.. Оппортунистических инфекций в этом исследовании зарегистрировано не было.
Как осложнение лечения обинутузумабом описана также жизнеопасная энтеровирусная инфекция. J.M. Heger et al. [13] сообщили о больной, погибшей от диссеминированной энтеровирусной инфекции на фоне лечения обинутузумабом по поводу фолликулярной лимфомы. Обинутузумаб использовался в качестве монотерапии для поддержания ремиссии после индукции бендамустином и ритуксимабом.. Попытка терапии внутривенным введением иммуноглобулина оказалась безуспешной.
C. Dendle et al. [14] описали 2 случая диссеминированной энтеровирусной инфекции, возникших в ходе монотерапии лимфомы обинутузумабом в качестве средства для поддержания ремиссии.. Клиническая картина включала развитие гепатита, генерализованных отеков и полимиозитоподобного синдрома. В обоих случаях назначение внутривенного иммуноглобулина привело к клиническому выздоровлению и исчезновению виремии. T. Eyckmans et al. [15] описали также случай развития энтеровирусного энцефалита у пациентки, которая получала обинутузумаб в качестве монотерапии для поддержания ремиссии неходжкинской лимфомы. Ее госпитализировали с нарушениями сознания, выраженной лимфопенией и гипогаммаглобулинемией. Лечение внутривенным иммуноглобулином привело к практически полному регрессу неврологических симптомов.
В приведенном нами клиническом наблюдении, в отличие от большинства вышеупомянутых случаев энтеровирусной инфекции, обинутузумаб на момент развития осложнения применялся в режиме монотерапии. Клиническая картина в целом соответствовала вышеописанной (лихорадка, полимиозит, мышечная и общая слабость, гипоглобулинемия, гипоальбуминемия). В нашем наблюдении обращал на себя внимание выраженный отечный синдром, который не мог быть объяснен гипоальбуминемией, поскольку развился раньше и не имел характерного гравитационного распределения: отеки не перемещались в ниже расположенные части тела, что характерно для гипоонкотических отеков. Более вероятным механизмом происхождения отечного синдрома представляется повреждение эндотелия и утечка белков плазмы в ткани.. Это предположение удовлетворительно объясняет и нарастающую гипоальбуминемию..
Клинический эффект от применения ВИГ у пациентки З. не вызывает сомнения. Положительная динамика состояния наблюдалась уже после первой инфузии. Через 3 дня после начала лечения у пациентки с высокой лихорадкой в предшествующие 2 нед. была достигнута полная нормализация температуры тела.
Заключение
Обсуждаемое клиническое наблюдение может представлять интерес для врачей различных специальностей, поскольку демонстрирует нечастую и непростую в диагностике причину лихорадки, полимиозита и необычного отечного синдрома. С другой стороны, данное описание может оказаться полезным для врачей, наблюдающих пациентов в процессе лечения анти-В-клеточными препаратами. Высокая значимость энтеровирусной инфекции у таких больных обусловлена неблагоприятным прогнозом при отсутствии специфического лечения и, вследствие этого, критическим значением своевременности установления диагноза для выживания пациента.
.
Информация с rmj.ru






