Содержание статьи
Введение
Хроническая боль продолжает по-прежнему оставаться одной из актуальных проблем современной медицины.. Боль — неприятное или мучительное ощущение, сложное, многофакторное, зависящее от взаимодействия ряда биопсихосоциальных факторов. Более 90% людей в мире подвержены болевым синдромам. От 15% до 25% взрослого населения страдают от хронической боли [1].
Болезни опорно-двигательной системы, сопровождающиеся болевым синдромом, занимают 1‑е место по обращаемости за медицинской помощью. В последние годы распространенность боли в спине и суставах достигла масштабов медико-социальной проблемы. Боль в суставе (артралгия) как синдром может быть спровоцирована различными патологическими состояниями (ревматоидный артрит, системные заболевания, постинфекционные и посттравматические осложнения и др.). Представленность болевых синдромов в общей популяции: коленные/тазобедренные суставы — до 57,8% [2], плечевой сустав — от 26% (с вовлечением периартикулярных тканей — до 48–84% [3–5]), боль в нижней части спины (БНЧС) — до 85% [6], боль в шее (цервикалгия) — 10,4–21,3% [7]. Приблизительно треть взрослых лиц в популяции в течение года испытывают боли в спине, при этом 14% страдают от боли и в шее, и в пояснице, 12% — только в пояснице, 5% — только в шее [8]. Через год после дебюта БНЧС 33% больных беспокоит умеренная, а 15% — сильная боль [9], у 75% пациентов после перенесенного эпизода острой боли в спине наблюдается рецидив [10].
Распространенность хронической боли в старшей возрастной группе варьирует от 27% до 86% [11]. Согласно исследованию ROAD (Research on Osteoarthritis / Osteoporosis Against Disability) отмечается высокая частота встречаемости (до 50%) дегенеративной патологии суставов (в частности, остеоартрит, ОА) в популяции лиц старше 60 лет [12].
Рекомендации Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (ESCEO)
В России ориентируются на клинические рекомендации Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis, ESCEO). В 2019 г.. появился обновленный Европейский алгоритм ведения пациентов с ОА коленного сустава [13, 14], согласно которому применение хондропротекторов (ХП) составляет базовую часть лечения ОА (шаг 1). В предложенных рекомендациях было впервые подчеркнуто, что 1) начинать терапию ОА надо с хондроитина сульфата (ХС) и глюкозамина сульфата (ГС), а уже потом добавлять топические нестероидные противовоспалительные препараты (НПВП); 2) ХС и ГС должны быть фармацевтического качества; 3) пероральные формы ХС и ГС должны применяться длительно (рис. 1) [13]. Согласно рекомендациям Американской коллегии ревматологов (American College of Rheumatology, ACR) 2019 г.. [15] терапию ОА следует начинать с топических НПВП как препаратов с меньшими системными побочными эффектами.. Именно такую терапию ACR считает предпочтительной: сначала топические, затем (при их неэффективности) пероральные НПВП.. И только при ОА тазобедренного сустава сразу рекомендуются пероральные НПВП, что связано с глубиной залегания структур, задействованных в патогенезе ОА. Согласно рекомендациям Российского общества по изучению боли (РОИБ) при острой БНЧС (средний уровень доказательности) назначаются НПВП [16], и применяться они должны коротким курсом, в минимальных эффективных дозах, с учетом риска возможных побочных эффектов [17].
![Рис. 1. Алгоритм терапии ОА согласно рекомендациям ESCEO 2019 г. (сокращенный вариант) [14] Рис. 1. Алгоритм терапии ОА согласно рекомендациям ESCEO 2019 г. (сокращенный вариант) [14]](https://medblog.su/wp-content/uploads/2021/12/shtrihi-k-portretu-patsienta-s-bolevym-sindromom-raznye-podhody-k-terapii-v-zavisimosti-ot-lokalizatsii-boli-i-vozrasta-bolnogo-shavlovskaya-o-a.png)
Цель данной статьи — помочь врачу сориентироваться в выборе тактики лечения, ориентируясь на «портрет» пациента с болевым синдромом, с учетом локализации болевого синдрома и возраста больного.
Возможные варианты терапии пациента молодого возраста с болями в шее (цервикалгией) вертеброгенной природы
Традиционно локальную боль в позвоночнике подразделяют в соответствии с его отделами. Особенности анатомо-физиологических отделов позвоночника определяют распространенность и клинические проявления болевых синдромов.. Чаще всего боли в спине локализуются в шейном и поясничном отделах позвоночника.
Согласно исследованию «Глобальное бремя болезней» (Global Burden of Disease, 2010) боль в шее находится на 4-м месте среди причин инвалидности при оценке по показателю «годы, прожитые с инвалидностью» (Years Lived with Disability, YLD) и на 21-м месте «по общей обременности заболеванием» из 291 заболевания [18], что приводит к снижению производительности труда, увеличению числа невыходов на работу и увеличению расходов на страхование [19].
Общая распространенность боли в шее среди населения в целом колеблется от 0,4% до 86,8% (в среднем 23,1%), распространенность цервикалгии — в пределах от 0,4% до 41,5% (в среднем 14,4%), распространенность за 1 год — от 4,8% до 79,5% (в среднем 25,8%) [7, 20]. Более высокая частота возникновения цервикалгии отмечена у женщин, повышенный риск развития наблюдается в возрастной группе 35–49 лет, после чего риск развития цервикалгии начинает снижаться [7].
Выраженные дегенеративные изменения дисков шейных позвонков обнаруживаются у 25% взрослых людей до 40 лет, у 50% людей после 40 лет и, наконец, у 85% людей в возрасте 60 лет [21]. Наиболее часто поражается диск C5–С6 и в несколько меньшей степени — диски C6–С7 и C4–С5 [22]. Однако в других источниках сообщается, что развитие болевого синдрома в области шеи часто связано с поражением позвонка C2–C3 или С3–С4 [23]. Болевые синдромы в шейном отделе позвоночника в старшей возрастной группе встречаются редко. Дегенеративные изменения в шейном отделе позвоночника являются источником трех клинических синдромов: аксиальных болей в шее, цервикальной радикулопатии, цервикальной миелопатии; у некоторых пациентов наблюдается комбинация этих трех синдромов [24]. Источниками формирования цервикалгии могут быть верхние шейные мышцы, сухожилия; унковертебральные сочленения; фасеточные суставы; периост, связки [24]. Также среди факторов риска развития боли в шее рассматривают эмоциональные факторы (подавленное настроение (депрессия), высокая стрессовая нагрузка), ведущие к напряжению мышц шеи [25].
Исходя из наблюдений за пациентами с болевыми синдромами в области шеи, следует отметить, что преимуществами обладает комплексный подход, сочетающий в себе физические, поведенческие и фармакологические методы лечения [1, 26]. Одним из условий успешной терапии является купирование болевого синдрома, с этой целью назначаются НПВП. При интенсивной боли или в случае недостаточного терапевтического ответа на НПВП, в качестве альтернативной терапии или дополнительно могут назначаться симптоматические препараты замедленного типа действия (Symptomatic Slow Acting Drugs for OsteoArthritis, SYSADOA). Они включены в российские и зарубежные руководства по лечению остеоатрита (ОА) и других дегенеративно-дистрофических заболеваний. SYSADOA — это препараты со структурно-модифицирующими свойствами, ХП, среди которых наиболее известным является ХС, Хондрогард® [27].
Сообщается об успешном опыте применения комплексной терапии миорелаксантом (толперизон) в сочетании с НПВП (мелоксикам) у 81 пациента (средний возраст — 43,3 года) с острой болью в шейном отделе позвоночника [28]. Методом рандомизации пациенты разделились на 2 группы: 1-я группа (n=41) получала гелевую форму мелоксикама в сочетании с внутримышечными инъекциями толперизона 2 р/сут курсом 15 сут и постизометрической релаксацией мышц (ПИРМ); 2-я группа (n=40) получала таблетированную форму мелоксикама 15 мг/сут курсом 15 дней с ПИРМ.. Более выраженная положительная динамика (регресс миофасциальных и корешковых синдромов, нормализация биомеханических параметров) получена на фоне лечения толперизоном в сочетании с мелоксикамом и ПИРМ.
В другом исследовании с участием 120 пациентов (средний возраст — 48,8 года) с острыми болевыми синдромами на шейном, грудном и поясничном уровнях [29] также продемонстрирована эффективность терапии НПВП разных групп в течение 7 дней. Авторами сделан вывод, что НПВП разных групп могут быть препаратами первой линии при острой боли в шее и спине. Применение НПВП сопровождается быстрым противовоспалительным и обезболивающим действием, улучшает качество жизни пациентов при минимальном числе побочных эффектов..
Представляют интерес результаты клинического наблюдения ведения пациентов с вертеброгенной цервикалгией с использованием препарата Хондрогард® 400 мг/нед.
(курсовая доза 2,4 г) при стандартном внутримышечном введении [27, 30] в ягодичную мышцу в течение 6 нед. в сочетании с техникой мышечной релаксации и растяжения мышц [31]. Под наблюдением находились 57 больных, из которых 94,7% составляли женщины, средний возраст — 55,3 года. У 90% пациентов выявлен спондилоартроз шейного отдела позвоночника.. Оценивались болевые характеристики (субъективно, пальпаторно), функциональные изменения в области шеи (амплитуды ротации головы) и показатели качества жизни. Динамика состояния пациентов проводилась при включении в исследование, через 3 и 6 мес. наблюдения.. К концу наблюдения получено значимое снижение выраженности ночной боли в шее по ВАШ более чем на 80%, отмечалось уменьшение выраженности болевого синдрома при пальпации остистых отростков шейных позвонков на 97%. Амплитуда ротации головы при наклонах вправо-влево увеличилась на 40,5%, при наклонах вперед-назад — на 80%. Полученные данные продемонстрировали благоприятное соотношение эффективности и безопасности предлагаемого метода лечения.
Попробуем кратко охарактеризовать пациента с болью в шее.. Одни исследователи сообщают, что цервикалгия чаще наблюдается у женщин [19, 31], другие считают, что боль в шее в равной степени встречается и у мужчин, и у женщин [28]. Также имеются сообщения, что при детальном отборе пациентов из групп риска (опасные профессии, малоподвижная работа и др.) имеется преобладание данной патологии у мужчин, однако среди пациентов в возрастной категории 41–45 лет заболевание встречается одинаково часто среди лиц обоего пола [26]. Таким образом, можно заключить, что боль в шее в большей степени свойственна женщинам в возрасте 40 лет. Как правило, препаратом выбора является НПВП в сочетании с миорелаксантом и разными комбинациями лечебно-физкультурных тренингов, но также возможно применение ХС.
Возможные варианты терапии пациента среднего возраста с БНЧС и мышечно-тоническим болевым синдромом
Представляют интерес результаты ряда клинических исследований. В одном из них дана сравнительная оценка эффективности лечения пациентов с неспецифической БНЧС при назначении комплексной терапии (миорелаксант + НПВП) и при монотерапии НПВП [32]. В исследование вошли 60 больных (65% женщин), средний возраст — 53,7 года.. Основным критерием включения была выраженность боли более 4 баллов по численно-рейтинговой шкале (ЧРШ), костно-дистрофические изменения пояснично-крестцового отдела позвоночника при визуализации. Проводимая терапия в 1-й группе (n=30; средний возраст — 50,6 года) включала комбинированную терапию НПВП (мелоксикам 7,5 мг 2 р/сут в течение 7 дней) и миорелаксант (толперизон 150 мг 2 р/сут в течение 10 дней), в группе контроля (n=30; 56,8 года) — только НПВП (мелоксикам 7,5 мг 2 р/сут в течение 7 дней). Статистических различий между группами по возрасту не было.. Пациенты обеих групп предъявляли жалобы на боли в поясничном отделе позвоночника, усиливающиеся при движении, с иррадиацией в ногу, на ограничение подвижности в поясничном и пояснично-крестцовом отделах позвоночника из-за боли, чувство скованности и напряжения в поясничном отделе.. У большинства обследованных выявлена болезненность при пальпации остистых отростков, напряжение паравертебральных мышц, мышечно-тонический синдром (МТС) в нижней части спины. Оценка динамики болевого синдрома по ЧРШ (боль в покое, боль при движении, боль при пальпации) на 14-й и 30-й день показала, что эффективность терапии в группе НПВП + миорелаксант значимо выше, чем в группе НПВП.. Выраженность боли в группе НПВП + миорелаксант статистически значимо уменьшалась на 81,9%, в группе НПВП — на 71,8%. По шкале Освестри в группе НПВП + миорелаксант получена более выраженная положительная динамика. При назначении комплексной терапии (мелоксикам + толперизон) статистически значимо улучшились показатели функционального статуса больных — на 64,2%, в группе НПВП — на 29,4%. Полученные результаты продемонстрировали, что применение комплексной терапии БНЧС позволяет улучшить результаты лечения.
Представляют интерес результаты другого клинического исследования по ведению пациентов с неспецифической БНЧС с использованием препарата Хондрогард® при стандартном внутримышечном введении в ягодичную мышцу в сочетании с НПВП (мелоксикам) при сравнении с группой пациентов, которым назначали только мелоксикам [33]. Оценивалась степень влияния инъекционного ХС на выраженность болевого синдрома в составе комплексной терапии боли в спине.. В исследовании приняли участие 60 пациентов (61,7% женщин), средний возраст — 48,65 года. При рентгенографическом исследовании выявлены костно-дистрофические изменения в поясничном отделе позвоночника (сужение суставной щели, краевые остеофиты, гипертрофия суставного отростка, эрозивные изменения суставной поверхности). Основным критерием включения была боль более 4 баллов по ЧРШ. Проводимая терапия в 1-й группе (n=30; 48,1 года) включала внутримышечные инъекции ХС по схеме: первые 3 инъекции (1, 3, 5-й день) — по 1 мл (100 мг), с 4-й инъекции (7-й день) — по 2 мл (200 мг), в течение 6 нед. в сочетании с НПВП (мелоксикам) 7,5 мг 2 р/сут, курсом 7–10 дней.. В группе контроля (n=30; 49,3 года) назначался только НПВП (мелоксикам) 7,5 мг 2 р/сут, курсом 7–10 дней. Оценка динамики болевого синдрома по ЧРШ (боль в покое, боль при движении, боль при пальпации) на 10, 20 и 50-й дни показала, что эффективность терапии в группе НПВП + ХС выше, чем в группе НПВП. Выраженность боли в группе НПВП + ХС статистически значимо уменьшалась на 89,8%, в группе НПВП — на 68,3%. По шкале Освестри в группе НПВП + ХС получена более выраженная положительная динамика. При назначении комплексной терапии статистически значимо улучшились показатели функционального статуса больных — в 95,5% случаев по сравнению с группой НПВП — в 86,6%. Полученные результаты продемонстрировали, что применение внутримышечных инъекций исследуемого препарата в комплексной терапии БНЧС позволяет улучшить эффективность лечения.
Выполнено сравнение эффективности перорального применения ХП Сустагард® артро (порошок для приготовления раствора для приема внутрь), содержащего глюкозамина сульфат (ГС), и различных НПВП с целью уменьшения степени выраженности боли в нижней части спины. Одной из задач исследования была оценка уровня глюкозы в крови у больных, принимающих ХП [34]. Основным критерием включения была выраженность боли более 4 баллов по ЧРШ, костно-дистрофические изменения пояснично-крестцового отдела позвоночника при визуализации.. Наблюдались 60 больных (76,7% женщин) с БНЧС, разделенных на две группы: терапия пациентов из 1-й группы (n=30; средний возраст — 53 года) включала назначение Сустагард® артро (содержимое 1 пакета 1 р/сут внутрь) в течение 6 нед.; больные из 2-й (контрольной) группы (n=30; средний возраст — 49,1 года) получали инъекционные формы НПВП коротким курсом 3–7 дней. Статистических различий между группами по возрасту не было.. Уменьшение выраженности болевого синдрома по ЧРШ и оценке функционального статуса (шкала Освестри) не имело статистически значимых различий, что свидетельствует о схожей эффективности терапии болевого синдрома как при пероральном приеме препарата Сустагард® артро, так и при применении НПВП. Следует отметить, что колебания уровня глюкозы на фоне приема ХП не выходили за верхнюю границу нормы, что важно для пациентов старшей возрастной группы с коморбидными заболеваниями..
Приведем краткую характеристику пациента с БНЧС и МТС.. К данной категории больных могут быть отнесены лица в возрасте старше 50 лет, преимущественно женского пола, соответствующие критериям БНЧС, с МТС или без него. В равной степени препаратами выбора могут быть как комбинированная терапия НПВП + миорелаксант, НПВП + ХС (инъекции препарата Хондрогард®), так и, в ряде случаев, монотерапия пероральными ХП (Сустагард® артро).
Особенности терапии пациента старшего возраста с БНЧС, ОА, локомотивным синдромом и коморбидными заболеваниями
Важными моментами терапии лиц пожилого возраста с болевыми синдромами являются высокая коморбидность распространенного ОА различной локализации с отягощенным соматическим анамнезом, а также инволютивные изменения в физиологии человека, такие как саркопения (возрастное атрофическое дегенеративное изменение скелетной мускулатуры, приводящее к постепенной потере мышечной массы и силы), локомотивный синдром (неудовлетворительное состояние пациентов старше 60 лет, при котором им требуется или может потребоваться в ближайшем будущем посторонняя помощь из-за ухудшения функционального состояния опорно-двигательного аппарата, включающего патологию костной ткани, суставов, мышц и нервной системы) [35]. В основе ОА лежит деструкция всех составляющих элементов сустава (хряща, субхондральной кости, связок, капсулы, периартикулярных мышц). ОА у лиц старше 60 лет является частой причиной хронической боли с ограничением или утратой подвижности, травматизации. Для ОА любого типа характерна потеря мышечной силы (динапения) с последующим развитием саркодинапении и саркопении [36].
В одном из клинических исследований с участием 300 пациентов (средний возраст — 75,1 года, 87,3% женщин) с хроническим болевым синдромом дана оценка влияния мышечной массы и силы на интенсивность и длительность болевого синдрома у пациентов старше 60 лет [37]. При сравнении пациентов с нормальной мышечной массой и силой с пациентами с саркопенией, сниженной мышечной массой и силой выявили, что чем ниже у пациентов мышечная масса, тем интенсивнее и длительнее болевой синдром. Стратегии коррекции или замедления развития локомоторного синдрома должны включать в себя в первую очередь изменение двигательного режима и рациона питания (с добавлением в рацион витамина D, ГС и ХС) [36].
У пациентов в возрасте 60 лет артроз фасеточных суставов встречается чаще, чем у лиц более молодого возраста, как и ОА тазобедренных суставов [38, 39]. Обследование лиц в возрасте 67 лет, проведенное с использованием компьютерной томографии (КТ), выявило выраженные дегенеративно-дистрофические изменения на уровне поясничного отдела позвоночника (L4–L5, L5–S1) у 54% пациентов [40]. У пожилых пациентов при ОА и болях в спине местные формы НПВП (гели, мази, пластыри) предпочтительнее пер-
оральных, поскольку риск развития кардиоваскулярных событий (острого инфаркта миокарда) ниже [41]. У пожилых пациентов и лиц с риском развития сердечно-сосудистого заболевания (ССЗ) необходимо с осторожностью использовать НПВП, в том числе местно..
Снижение риска сердечно-сосудистых и желудочно-кишечных осложнений при лечении пациентов старшего возраста со старческой астенией может быть достигнуто путем применения ХС и ГС. Результаты метаанализов указывают на высокую эффективность ХС при лечении ОА и саркопении [42–44]. В ряде рандомизированных плацебо-контролируемых исследований была продемонстрирована эффективность ХС при болевом синдроме у пациентов с ОА коленного сустава.
В одном из исследований у пациентов с рецидивом хронической боли в коленных суставах и БНЧС (при доказанной связи боли с ОА фасеточного сустава и дегенеративными изменениями межпозвонкового диска) дана оценка эффективности и безопасности интермиттирующей схемы парентерального введения ХС и ГС в совокупности с ежедневной физической активностью (ходьбой и индивидуально подобранным комплексом физических упражнений) [45]. В исследование вошли 70 пациентов, разделенных на 2 группы: в 1-й группе (n=35; средний возраст — 52,7 года; 68,6% женщин) использовалась интермиттирующая схема парентерального введения ХС (Хондрогард®) по 2,0 мл (200 мг) в/м через день № 20 и ГС (Сустагард® артро) по 3,0 мл в/м (раствор 200 мг/мл; ампулы по 2 мл и 1 мл растворителя) через день № 20. Препараты вводили в режиме чередования: 1, 3, 5-й и т. д. день — ХС; 2, 4, 6-й и т. д. день — ГС. В группе контроля (n=35; средний возраст — 54,6 года; 65,7% женщин) применяли НПВП разных групп. Предложенная схема интермиттирующей терапии позволила добиться эффективного обезболивания в 91,4% случаев, прием НПВП — в 62,9%. В течение 6 нед. лечения ХС и ГС интенсивность боли в суставах уменьшилась на 62%, в спине — на 69%, качество жизни улучшилось на 39%, существенных нежелательных явлений не отмечено, в том числе изменений биохимических показателей, характеризующих функцию печени и почек, выявлена тенденция к снижению уровня С-реактивного белка.
Можно ориентировочно охарактеризовать пациента с БНЧС, ОА, локомотивным синдромом и коморбидными заболеваниями.. Во многих исследованиях под наблюдением находились пациенты в возрасте старше 60 лет, преимущественно женщины (от 65% до 85%). Схемы терапевтического воздействия на болевой синдром у лиц старшей возрастной группы назначаются крайне аккуратно, с учетом коморбидных заболеваний, инволютивных изменений, возможных побочных явлений от применения НПВП. С учетом последних рекомендаций европейских и американских ученых воздействие на боль у лиц пожилого возраста может быть достигнуто применением ХС и ГС..
Хондрогард® является хорошо зарекомендовавшим себя инъекционным ХП для стартовой терапии ОА, с высоким уровнем доказательной базы.. ХС включен в клинические рекомендации МЗ РФ для лечения хронической боли у пациентов пожилого и старческого возраста (уровень убедительности рекомендации – A; уровень достоверности доказательств – 1). Эксперты подчеркивают, что для купирования болевого синдрома в суставах рекомендуется использовать именно парентеральные формы ХС (100–200 мг/сут, через день, курс: 25–30 инъекций). Эффективность и безопасность применения ХС у пациентов с ОА подтверждены в многочисленных исследованиях, а также систематических обзорах и метаанализах..
Заключение
В статье была предпринята попытка представить «портрет» пациента с болевым синдромом и возможными схемами терапевтического воздействия в зависимости от локализации болевого синдрома и с учетом возрастного аспекта.
При всех перечисленных выше состояниях в клинической практике используются различные группы фармакотерапевтических препаратов. Препараты, обладающие выраженным противовоспалительным эффектом, такие как НПВП, назначают для купирования острого болевого синдрома, при обострении хронической боли. Препараты с хондропротективным типом действия используют с целью сохранить структуру хряща; ХП также обладают медленным противовоспалительным действием. Возможность длительного и безопасного курсового применения ХП (для инъекционного ХС — до 2 мес.) и существенно меньшее (практически отсутствует) количество возможных нежелательных явлений по сравнению с НПВП позволяют широко применять ХП у пациентов старших возрастных групп, в том числе с сопутствующими коморбидными заболеваниями. Указанные обстоятельства диктуют необходимость персонифицированного подхода при выборе тактики лечения болевых синдромов, с учетом ожидаемых клинических эффектов от применения препаратов, вариабельности заболевания и возраста пациента (рис. 2).
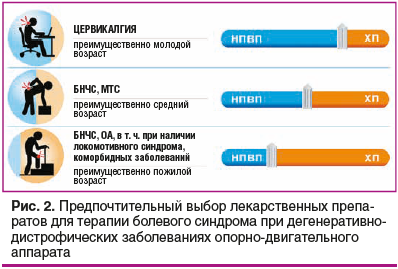
Таким образом, для купирования боли при дегенеративно-дистрофических заболеваниях суставов и позвоночника короткими курсами используются НПВП, наряду с которыми возможно длительное применение ХП. Курсовое применение инъекционного ХС, обладающего не только анальгетическим, но и структурным действием на хрящ, является хорошо зарекомендовавшей себя мерой борьбы с болевым синдромом в суставах у пациентов с ОА, с накопленной доказательной базой эффективности и безопасности (в том числе с собственным метаанализом).
Благодарность
Редакция благодарит компанию ЗАО «ФармФирма «Сотекс» за оказанную помощь в технической редактуре настоящей публикации.
.
Информация с rmj.ru






