Содержание статьи
Введение
Остеопороз (ОП) является метаболическим заболеванием скелета, которое характеризуется снижением костной массы, нарушением ее микроархитектоники, а также развитием переломов при минимальной травме (так называемые низкоэнергетические переломы) [1–3]. Установлено, что подавляющее число случаев ОП приходится на постменопаузальный и сенильный его варианты, которые составляют более 85% от всех его клинических вариантов. Так, в течение первых 5 лет после прекращения регулярного менструального цикла дефицит костной массы составляет более 30% от всего дефицита, который формируется в течение всей жизни [4, 5].
Главную роль в патогенезе постменопаузального ОП играет дефицит вырабатываемого яичниками эстрогена, который модулирует костное ремоделирование посредством регулирования процессов продукции цитокинов и факторов роста [6]. Наиболее частыми локализациями переломов в постменопаузе являются позвонки (компрессионные переломы), проксимальные отделы плечевой и бедренной костей, дистальный отдел предплечья. Показано, что при постменопаузальном ОП для женщины в возрасте 50 лет и старше риск перелома позвоночника, шейки бедра, костей запястья, а также любого из трех участков скелета составляет соответственно 15,5, 17,5, 16,0 и 39,7% [7].
Риск переломов при остеопорозе напрямую связан с факторами риска падений, среди которых выделяют эндогенные: возрастные нарушения (функции мышц, когнитивные способности и т. д.), боль, различные заболевания (остеоартрит, эпилепсия и т. д.), особенности образа жизни (алкоголизм, наркомания, прием лекарственных препаратов — морфина, антигипертензивных и т. д.) и экзогенные (неудобная обувь, особенности рельефа) [8]. Следовательно, основополагающими стратегиями ведения пациентов с ОП могут являться: профилактика первичных и повторных переломов костной ткани, стабилизация или увеличение костной массы, улучшение качества жизни. Увеличение комплаентности в лечении таких пациентов можно обеспечить использованием безопасного способа приема препарата, максимальным снижением нежелательных эффектов и стоимости, а также удобством приема препарата.
Механизмы развития постменопаузального ОП
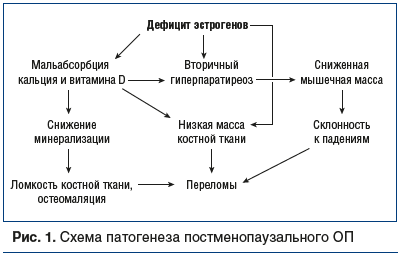
Патогенетические этапы развития постменопаузального ОП напрямую связаны с дефицитом эстрогенов и участием иммунных механизмов в регуляции остеокластогенеза. В многочисленных исследованиях продемонстрирована лидирующая роль в регуляции функции остеокластов макрофагального колониестимулирующего фактора и лиганда — активатора рецептора ядерного фактора κВ (RANKL). Определена прямая взаимосвязь между дефицитом эстрогенов, стимуляцией активности RANKL и гиперпродукцией провоспалительных цитокинов (IL-1, IL-6, TNF-α) [6]. В последние годы установлена патогенетическая роль IL-7 в инициации остеокластогенеза, пусковым фактором в увеличении продукции которого также выступает дефицит эстрогенов. Являясь фактором роста гемопоэтических клеток, этот цитокин стимулирует пролиферацию и дифференцировку Т-лимфоцитов в тимусе и костном мозге. Повышению активности Т-лимфоцитов способствует также снижение синтеза трансформирующего фактора роста фибробластов β, который формируется на фоне дефицита эстрогенов. Следствием цитокинового дисбаланса, активации Т-лимфоцитов является дефицит остеопротегирина. Известно, что последний обеспечивает баланс костеобразования и ее резорбции, а его функциональная недостаточность приводит к пролиферации остеокластов, и, следовательно, к нарушению микроархитектоники кости и к снижению ее прочности [1, 7].
В формировании ОП высока роль дефицита витамина D и недостаточного поступления кальция в костную ткань, что обусловливает развитие вторичного гиперпаратиреоза и запускает медленную потерю костной массы (рис. 1). Кроме того, в период менопаузы дефицит кальция и витамина D связан с секреторной недостаточностью кишечной лактазы и формированием синдрома мальабсорбции, которые приводят к значительному уменьшению поступления кальция с пищей. Немаловажными причинами развития ОП являются: недостаток инсоляции и нарушение синтеза витамина D в коже, нарушения координации, а также формирование дефицита α-гидроксилазы вследствие сниженной синтетической функции почек [9].
Определена роль дефицита некоторых микроэлементов в формировании ОП. Так, недостаток магния тормозит образование фосфата кальция, а дефицит марганца вызывает изменение структуры хряща и соединительной ткани. Дефицит железа связан с расширением костномозговых пространств и деформацией скелета вследствие гиперплазии костного мозга из-за неэффективного эритропоэза. Дефицит меди нарушает ковалентные поперечные связи пептидных цепей в коллагеновых и эластических волокнах соединительной ткани [1].
Таким образом, патогенез ОП носит гетерогенный, многоступенчатый характер, что предполагает комплексный подход к его терапии.
Патогенетическая роль бисфосфонатов в коррекции постменопаузального ОП
Бисфосфонаты (БФ), обладая антирезорбтивными свойствами, являются основными препаратами, используемыми для коррекции метаболических нарушений, ассоциированных с ОП [9]. Основной клеткой-мишенью для БФ выступает остеокласт. Попадая в клетку путем эндоцитоза, БФ сначала находятся во внутриклеточных везикулах, затем поступают в цитозоль и пероксисомы, где реализуют свое биохимическое действие, связываясь с фарнезилпирофосфатсинтазой, которая блокирует синтез фарнезилдифосфата, необходимого для образования геранилгеранилпирофосфата [10]. Этот путь блокирует модификацию сигнальных белков, необходимых для нормального функционирования остеокласта [11, 12]. Кроме того, БФ увеличивают выживаемость остеоцитов, что способствует уменьшению частоты их активации и предупреждению потери костной ткани у женщин в постменопаузе [13]. Анаболические эффекты БФ реализуются за счет торможения апоптоза остеобластов.
В лечении постменопаузального ПО используются следующие азотсодержащие БФ: алендроновая кислота, ризедронат в виде таблеток (кратность приема 1 р/нед.), ибандроновая кислота, доступная в виде таблеток (кратность приема 1 р/мес.) и раствора для внутривенного введения (кратность 1 раз в 3 мес.) и золедроновая кислота для внутривенного введения (кратность 1 р/год).
Эффективность всех доступных в России БФ была доказана результатами многоцентровых двойных слепых рандомизированных плацебо-контролируемых исследований (РКИ) [14–18]. Косвенные сравнения эффективности БФ в различных возрастных группах доказали свое равнозначное влияние на предупреждение повторных переломов позвонков и внепозвоночных переломов в старшей возрастной группе с переломами позвонков и выраженным снижением минеральной плотности кости (МПК) (алендронат, ибандронат, золедронат), в т. ч. у пациентов с уже имеющимся переломом бедра (золедронат). Продемонстрирована эффективность БФ в старшей возрастной группе (старше 65 лет) с переломами в анамнезе и/или со снижением МПК в шейке бедренной кости менее -2,5 (алендронат, золедронат). Интегральный анализ данных РКИ применения БФ (общее количество пациентов — 23 769) показал снижение риска переломов позвонков (-59%; ОШ 0,413, 95% ДИ 0,279–0,612), переломов бедра (-29%; ОШ 0,711, 95% ДИ 0,616–0,820), внепозвоночных переломов (-21%; ОШ 0,796, 95% ДИ 0,739–0,858).
У больных, приверженных лечению, показано снижение риска развития клинически выраженных переломов позвонков (-32%; ОШ 0,680, 95% ДИ 0,592–0,780), переломов бедра (-38%; ОШ 0,622, 95% ДИ 0,462–0,837), внепозвоночных переломов (-19%; ОШ 0,812, 95% ДИ 0,733–0,900) по сравнению с показателями пациентов с низкой комплаентностью [19].
Место ибандроновой кислоты в терапии постменопаузального ОП
Ибандроновая кислота (ИК) является азотсодержащим БФ, который стандартизирован для профилактики и лечения постменопаузального ОП. Установлено, что ИК является одним из наиболее эффективных БФ [20]. Она достоверно увеличивает МПК, снижает риск позвоночных и внепозвоночных переломов в группе больных высокого риска при ее ежемесячном пероральном приеме внутрь или внутривенном введении 3 мг 1 раз в 3 мес. [21]. Эффективность ИК представлена в рамках международного рандомизированного исследования DIVA [21, 22]. В этом исследовании было продемонстрировано отсутствие достоверных различий в динамике МПК и маркеров костной резорбции при следующих способах применения ИК: внутривенно по 2 мг каждые 2 мес., или по 3 мг каждые 3 мес., или перорально по 2,5 мг ежедневно. Через 1 год применения ИК при контрольном исследовании пациентов в группах сравнения (инъекционное внутривенное введение по 2,0 мг каждые 2 мес., или по 3,0 мг каждые 3 мес., или пероральный прием по 2,5 мг ежедневно) показатели МПК при исследовании в поясничном отделе позвоночника увеличились соответственно на 3,8, 5,1 и 4,8%.
Представленные данные четко продемонстрировали преимущество использования ИК в виде внутривенного введения 1 раз в 2 или 3 мес. по сравнению с ежедневным пероральным приемом препарата, т. е. инъекционный путь введения ИК является эффективной альтернативой его пероральному применению.
Следующим этапом оценки результатов РКИ (MOBILE и DIVA) явилось определение годовой кумулятивной дозы ИК [22, 23], которая составила 5,5 мг с учетом абсорбции. Установлено, что эта кумулятивная доза ИК позволяет существенно снизить риск позвоночных и внепозвоночных переломов у пациентов с постменопаузальным ОП.
Следовательно, внутривенное применение ИК 1 раз в 3 мес. в дозе 3 мг для лечения постменопаузального ОП обеспечивает его накопительную годовую дозу 10,8 мг
и прирост МПК в поясничном отделе позвоночника и бедренной кости. С учетом полученных данных ИК в дозе 3 мг внутривенно ежеквартально применяется для терапии постменопаузального ОП в США и Европе.
Как уже упоминалось ранее, успех лечебных стратегий ОП основан на длительной, иногда пятилетней непрерывной лекарственной терапии, а низкая комплаентность больных обусловливает сохраняющийся риск переломов.
Определены важные условия безопасного применения пероральных форм БФ: прием препарата за 60 мин до завтрака и нахождение в вертикальном положении в течение 40 мин после его приема. Пероральные БФ абсолютно противопоказаны пациентам с заболеваниями пищевода (ахалазия или стриктура). Внутривенные БФ, при введении сразу попадающие в системный кровоток, становятся препаратами выбора для пациентов с любыми проблемами ЖКТ или непереносимостью пероральных форм. Назначение этой формы ИК пациентам с ОП повышает приверженность лечению при сохранении эффективности и безопасности. В целом основными преимуществами внутривенного введения ИК и, в частности, нового российского дженерика Резовива, являются длительные (до 3 мес.) интервалы между введениями, отсутствие связи с приемом пищи и особым положением тела после приема препарата, а также безопасность применения при патологии ЖКТ. Кроме того, выбор в пользу внутривенной формы препарата следует делать при ведении пациентов с непереносимостью, тех, кто не может соблюдать требования к приему пероральных форм (рис. 2). Возможность введения препарата 1 раз в 3 мес. обусловлена 100% биодоступностью, обеспечивающей годовую кумулятивную дозу [1, 9].
![Рис. 2. Алгоритм выбора оптимального БФ при постменопаузальном ОП [19] Рис. 2. Алгоритм выбора оптимального БФ при постменопаузальном ОП [19]](https://medblog.su/wp-content/uploads/2021/10/1633255169_598_effektivnost-bezopasnost-i-priverzhennost-lecheniyu-vnutrivennymi-bisfosfonatami-pri-postmenopauzalnom-osteoporoze-belyaeva-i-b.png)
В клиническом наблюдательном исследовании Г.Н. Романов и соавт. [24] оценивали влияние внутривенной формы введения ИК на показатели МПК у 30 женщин с ОП в возрасте от 50 до 80 лет. Верификация диагноза основывалась на определении Т-критерия в исследуемых зонах согласно рекомендациям ВОЗ. Оценивали абсолютные значения МПК в поясничных позвонках (LIII–LV), в проксимальном отделе бедра и шейке бедренной кости исходно и через 1 год после лечения. После 4 инфузий ИК отмечался достоверный прирост абсолютных показателей МПК в изучаемых зонах. За весь период наблюдения не было зарегистрировано новых переломов, в то время как к началу исследования 30% пациенток имели низкоэнергетические переломы.
В последнее время большое внимание уделяется кардиоваскулярной безопасности лекарственных средств, применяемых пациентами с коморбидными сердечно-сосудистыми заболеваниями, которые выявляются у 70% пациентов с ОП. Более того, потерю МПК в настоящее время ряд авторов рассматривают как фактор риска атеросклеротического поражения коронарных артерий. В связи с доказанным риском нефатальных сердечно-сосудистых осложнений при применении стронция ранелата особое внимание уделяется кардиоваскулярной безопасности БФ. Имеются доказательства безопасности применения БФ у больных с ишемической болезнью сердца. Было показано, что БФ уменьшают кальцификацию стенок артерий, но не влияют на жесткость артерий или вероятность развития сердечно-сосудистого события. Бисфосфонаты, как правило, снижают риск сердечно-сосудистой смерти и смертность от всех причин. Следовательно, их следует рекомендовать для патогенетической терапии ОП у коморбидных пациентов с заболеваниями сердечно-сосудистой системы [25, 26].
Серьезным побочным эффектом длительного применения БФ являются атипичные субтрохантерные переломы бедренной кости [26]. Между тем это осложнение развивается крайне редко и только при длительном (5 лет и более) применении БФ. Этот факт учитывают рекомендации по рациональному применению БФ у пациентов с ОП в течение 5 лет без риска развития атипичных переломов. В дальнейшем рассматривается возможность «лекарственных каникул» у пациентов с низким риском переломов. При высоком риске переломов терапия БФ должна быть продолжена под строгим контролем маркеров костной резорбции [1, 19].
Заключение
Таким образом, применение ИК при постменопаузальном ОП в виде внутривенного введения 1 раз в 3 мес. в дозе 3 мг подтвердило свою высокую эффективность в международных рандомизированных исследованиях и наблюдательных российских исследованиях. Такой вывод основан на доказанности прироста МПК и сохраняющихся низких показателях маркеров костной резорбции в течение 12 мес. после последнего введения препарата. Важным преимуществом внутривенного введения ИК является благоприятный профиль безопасности для пациентов с поражениями ЖКТ и удобство применения, что повышает приверженность лечению. Применение ИК безопасно для коморбидных пациентов с сердечно-сосудистыми заболеваниями.
Благодарность
Редакция благодарит ООО «Фарм-Синтез» за оказанную помощь в технической редактуре настоящей публикации.
.
Информация с rmj.ru