Введение
Гиперплазия эндометрия (ГЭ) — это нефизиологическая пролиферация эндометрия, приводящая к увеличению объема эндометриальной ткани, характеризующаяся морфологическими изменениями желез и стромы эндометрия и соотношением объема эндометриальных желез к объему стромы, превышающим 1:1 [1–3]. В большинстве случаев ГЭ возникает при относительной или абсолютной гиперэстрогении: при применении эстрогенов в качестве менопаузальной гормонотерапии, при ожирении и синдроме поликистозных яичников (СПКЯ).
Полипы эндометрия (ПЭ) представляют собой новообразования, которые развиваются в результате очаговой гиперплазии базального слоя эндометрия. В отличие от ГЭ эстрогензависимость ПЭ подвергается сомнению, и в этиологическом аспекте на первый план выходит воспалительная теория. Однако при оценке экспрессии VEGF и TGFβ в эпителии и стромальных клетках ПЭ у женщин с признаками хронического эндометрита и без признаков воспаления было сделано предположение, что возможно существование двух различных видов ПЭ — гормонозависимого и воспалительного происхождения [4].
Помимо индуцирования пролиферативных изменений в матке, эстрогены приводят к морфометрическим изменениям, которые включают изменения типа стромального и железистого эпителия, количества и формы желез, соотношения желез к строме и морфологии эпителиальных клеток [5]. Результаты многих исследований доказывают сложность патогенеза как ГЭ, так и ПЭ, развитие которых происходит на фоне нарушения соотношения пролиферации клеток эндометрия и механизмов регуляции их запрограммированной гибели (апоптоза) [6]. В данном процессе участвуют как нарушения в гормональном статусе, так и изменения иммунной системы, факторов окружающей среды и т. д. [7].
Несмотря на совершенствование методов диагностики и лечения, отмечается увеличение частоты встречаемости ГЭ и ПЭ, рецидивов заболевания [8]. При этом до 40% женщин репродуктивного возраста подвергаются хирургическому лечению, что зачастую приводит к потере репродуктивной функции.
Цель исследования: описать клинические особенности пациенток с гиперпластическими процессами эндометрия (ГПЭ).
Материал и методы
Проведено ретроспективное одноцентровое исследование. В исследование были последовательно включены 86 пациенток репродуктивного и пременопаузального возраста, поступившие в гинекологическое отделение ГКБ № 1 им. Н.И. Пирогова с 2018 по 2019 г. Критерии включения: наличие жалоб на кровянистые выделения из половых путей, увеличение М-эхо при ультразвуковом исследовании (УЗИ), добровольное информированное согласие. Критерии исключения: наличие злокачественного поражения эндометрия, доказанное при патоморфологическом исследовании.
Проводили сбор жалоб, оценивали данные анамнеза. У всех пациенток уточняли возраст менархе, особенности менструальной функции, репродуктивный анамнез, наличие сопутствующей экстрагенитальной патологии. Всем больным выполняли физикальное обследование, включающее определение индекса массы тела (ИМТ). УЗИ органов малого таза выполняли на аппаратах ULTRAMARC-8 (ATL, США), снабженных секторным механическим датчиком с частотой 5,0 МГц, и ACUSON 128/ХР (ACUSON, США) с мультичастотным секторным датчиком 2,5–4,0 МГц, мультичастотным конвексным датчиком 2,5–3,5 МГц и линейным датчиком 5,0 Мгц и 7,0 МГц.
Учитывая жалобы и результаты УЗИ, всем пациенткам было выполнено раздельное лечебно-диагностическое выскабливание под контролем гистероскопии с последующим гистологическим исследованием соскобов. В дальнейшем в зависимости от результатов исследования пациентки были разделены на 3 группы: 1-ю группу составили
30 пациенток с ГЭ; 2-ю группу — 30 пациенток с ПЭ; 3-ю группу — 26 условно здоровых пациенток, у которых после патоморфологического исследования была исключена патология эндометрия (контрольная группа).
Для анализа полученных данных применяли методы описательной статистики. Вариационные ряды проверяли на нормальность распределения с использованием критериев Колмогорова — Смирнова и Шапиро — Уилка. При нормальном распределении вычисляли среднюю арифметическую (М) и ее стандартную ошибку (m). При распределении, отличающемся от нормального, вычисляли медиану (Ме) и интерквартильный размах [Q1–Q3]. Для сопоставления двух выборок по частоте встречаемости интересующего исследователя эффекта использовали критерий Фишера. Различия считали статистически значимыми при р<0,05. Для сопоставления двух групп по количественным признакам использован U-критерий Манна — Уитни, предназначенный для сравнения двух независимых выборок. Для выявления взаимосвязи переменных проводили расчет коэффициента ранговой корреляции по Спирмену.
Результаты и обсуждение
В ходе обследования пациенток были получены данные, представленные в таблице 1.
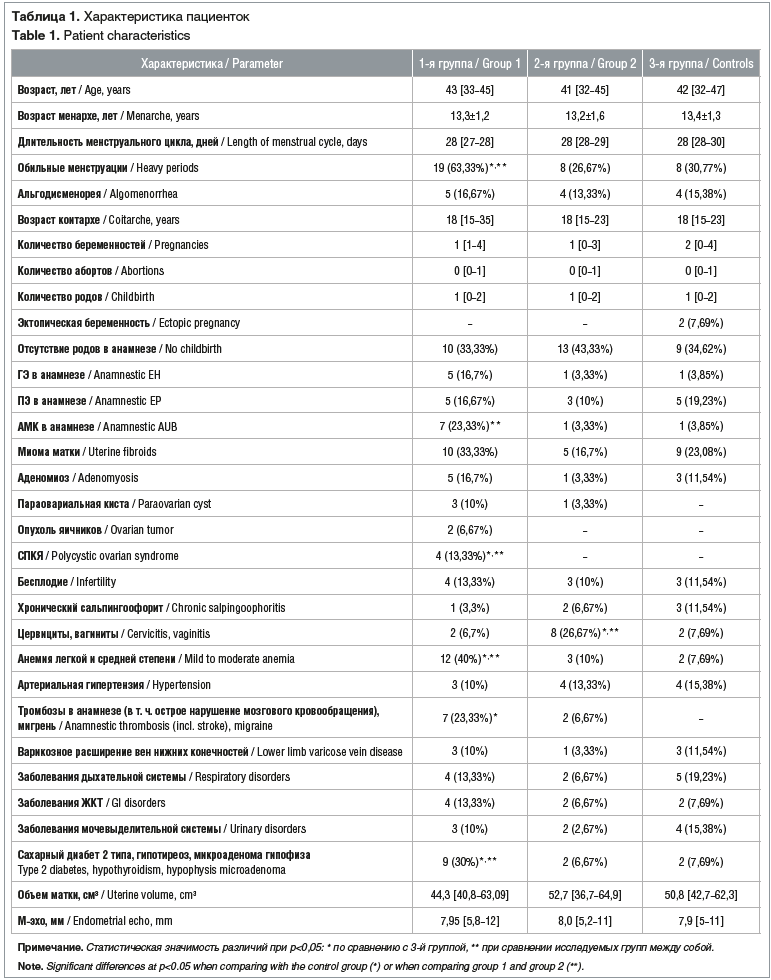
По данным ряда авторов, ранний возраст менархе относится к факторам риска развития ГЭ и рака эндометрия [9]. При этом авторы, как правило, рассматривают раннее менархе не как изолированный провоцирующий фактор развития ГЭ, а в связи с его предиктивной ролью в увеличении ИМТ (и метаболического синдрома) и формированием в дальнейшем ановуляции. В нашем исследовании не было получено достоверных различий по возрасту менархе как между группами пациенток с патологией эндометрия, так и при сравнении их с группой контроля (р>0,05). Полученные результаты соответствуют данным о том, что риск развития патологии эндометрия коррелирует не столько с возрастом менархе, сколько с недостаточностью гормонов желтого тела (при ановуляции, характерной для СПКЯ, для пременопаузального возраста; при повышенном ИМТ и т. д.), т. е. с относительной или абсолютной гиперэстрогенией.
Пациентки не различались по продолжительности менструации и длительности менструального цикла (р>0,05). Несмотря на то, что медиана длительности менструального цикла на момент их поступления в стационар составила
28 дней во всех трех группах, следует отметить, что длительность менструального цикла варьировала от 21 до 60 дней, от 24 до 62 дней и от 24 до 34 дней в 1, 2, и 3-й группах соответственно (р>0,05). Нерегулярный менструальный цикл отмечался у 4 (13,33%) пациенток 1-й группы, у 7 (23,33%) — 2-й и у 8 (30,76%) — 3-й группы (р>0,05).
При выяснении особенностей менструального цикла было выявлено, что обильные менструации (меноррагия) у пациенток с ГЭ были чаще в 2,37 и 2,6 раза, чем у пациенток 2-й и 3-й групп (р<0,05), а частота других аномальных маточных кровотечений (АМК) — в 7,06 и 6,06 раза чаще (р<0,05), что можно объяснить предполагаемым наличием абсолютной и/или относительной гиперэстрогенемии, т. е. патогенезом развития данной патологии.
При нормальном овуляторном цикле прогестерон, секретируемый в лютеиновую фазу, стабилизирует стромальный и сосудистый поддерживающий матрикс, а также стимулирует выработку стромальными клетками тканевого фактора (TF) (белка клеточной поверхности, который участвует во внешнем пути коагуляции посредством связывания активированного фактора VII), ингибитора активатора плазминогена 1 (PAI-1). PAI-1 блокирует фибринолиз, тем самым стабилизируя сгустки. В условиях ановуляторных циклов при абсолютном или относительном дефиците прогестерона снижается содержание этих прокоагулянтных факторов, отмечается повышенная фибринолитическая активность, что приводит к возникновению обильных менструаций [10].
Безусловно, количество родов и реализация репродуктивной функции влияют на риск развития внутриматочной патологии. Достоверных различий в количестве беременностей и родов у женщин с патологией эндометрия и контрольной группы выявлено не было (р>0,05). Учитывая данный факт, можно сделать вывод, что ановуляция как причина развития ГЭ и ПЭ у обследованных пациенток возникла уже после реализации репродуктивной функции, в позднем репродуктивном возрасте или непосредственно в пременопаузе, что в дальнейшем может привести к состоянию абсолютной или относительной гиперэстрогении.
При анализе гинекологической патологии было выявлено, что у пациенток 1-й группы общая частота встречаемости ГПЭ (ПЭ и ГЭ) в анамнезе была выше в 2,5 раза, чем у пациенток 2-й группы (р>0,05), и на 44,45% — чем у пациенток 3-й группы (р>0,05). На основании этого у пациенток 1-й группы можно предположить либо неэффективность проведенного лечения, либо персистенцию факторов риска развития ГПЭ.
Несмотря на отсутствие достоверных различий при анализе частоты миомы матки и аденомиоза в группах, общая частота данных заболеваний у пациенток 1-й группы (50%; n=15) была в 2,5 раза выше, чем у пациенток 2-й группы (20%; n=6; р<0,05), и на 40,43% выше, чем в группе контроля (34,62%; n=9; р>0,05). Необходимо отметить, что миома матки и аденомиоз были независимыми факторами риска наличия у пациенток ГЭ (отношение рисков 4, 95% доверительный интервал 1,27–12,58).
Обращает на себя внимание то, что СПКЯ был только у пациенток с ГЭ, что связано с особенностями патогенеза данного заболевания (р<0,05 по сравнению со 2-й и 3-й группами).
Воспалительные заболевания шейки и влагалища у пациенток 2-й группы встречались в 3,98 и 3,46 раза чаще, чем у пациенток 1-й (р<0,05) и 3-й (р>0,05) групп, что можно объяснить теорией происхождения ПЭ. Достоверных различий в частоте встречаемости другой гинекологической патологии не выявлено.
Экстрагенитальная патология наблюдалась у 19 (63,33%) пациенток 1-й группы, 18 (60%) — 2-й группы и 20 (76,92%) — 3-й группы (р>0,05). В ряде случаев наблюдалось сочетание нескольких нозологических единиц у одной пациентки. Чаще всего выявлялась анемия различной степени тяжести. Учитывая большую частоту АМК, закономерной была большая частота анемии у пациенток 1-й группы — в 4 и 5,2 раза больше, чем у больных 2-й (р<0,05) и 3-й (р<0,05) групп соответственно. Необходимо отметить, что анемии тяжелой степени ни у одной пациентки выявлено не было.
Проблема широкой распространенности тромботических осложнений в современной гинекологии остается актуальной ввиду возможности наличия у пациенток врожденной или приобретенной тромбофилии [11]. Этиология тромбоэмболических нарушений до конца не изучена, считается, что этот механизм обусловлен гиперкоагуляционным состоянием, связанным с гемостазом и тромбофилией [12]. Предрасполагающими факторами, по-видимому, являются гиперэстрогения, синдром гиперстимуляции яичников, наследственное состояние гиперкоагуляции, многоплодная беременность и т. д. Эстрогены способствуют тромбозу путем повышения количества тромбоцитов, увеличения концентрации факторов свертывания, фибриногена и фактора Виллебранда, снижения антитромбина и путем прямого влияния на стенку сосуда [13].
В нашем исследовании тромбозы в анамнезе, острое нарушение мозгового кровообращения, мигрень наблюдались только у пациенток с ГПЭ, что можно объяснить наличием нарушений со стороны гемостаза при ГПЭ и что соответствует данным литературы [14].
Общая частота встречаемости эндокринных заболеваний у пациенток 1-й группы была в 4,49 и 3,9 раза выше, чем у больных 2-й и 3-й групп соответственно (р<0,05), что подтверждает эндокринную теорию развития ГЭ.
Достоверных различий в частоте встречаемости другой экстрагенитальной патологии выявлено не было. В том числе отсутствовали различия в частоте таких составляющих метаболического синдрома, как артериальная гипертензия и ожирение.
Все пациентки имели телосложение по женскому типу. Массо-ростовые показатели варьировали в довольно широких пределах. В 1-й группе ИМТ варьировал от 20,2 до 37,2 кг/м2, во 2-й — от 19,1 до 40,6 кг/м2, в 3-й — от 19,6 до 35,6 кг/м2.
По данным УЗИ органов малого таза неоднородное М-эхо было выявлено у 23 (76,67%) пациенток 1-й группы, у 30 (100%) — 2-й и у 11 (42,31%) — 3-й группы. Данное различие было статистически значимым (р<0,05). При изучении величины М-эхо не было выявлено достоверных различий между тремя группами пациенток (р>0,05). Однако следует отметить наличие статистически значимой отрицательной корреляции (R=-0,41) между показателем М-эхо и днем менструального цикла у пациенток 3-й группы (р=0,04), в то время как у пациенток 1-й и 2-й групп данная корреляция отсутствовала. Возможно, корреляция у пациенток 3-й группы связана с наличием так называемой переходной зоны (junсtional zone). В норме толщина этой зоны у женщин репродуктивного возраста не превышает 2–8 мм [15]. Установлено [15], что в период менопаузы при отсутствии гормонов сигнал с зоны наружного миометрия также может быть гипоэхогенным по типу сигнала с переходной зоны и, следовательно, давать эффект ее утолщения. Было также выявлено, что ультраструктура миоцитов переходной зоны претерпевает характерные циклические изменения в зависимости от фазы менструального цикла. Диаметры миоцитов и их ядер в пролиферативной фазе значительно больше, чем в секреторной, а ядерно-цитоплазматический коэффициент в пролиферативной фазе — существенно меньше, чем в секреторной. Следовательно, линейное увеличение М-эхо, характерное для пролиферативной фазы, отсутствует в секреторной фазе. Отсутствие корреляции у пациенток 1-й и 2-й групп свидетельствует о нарушении в цепи гипоталамус — гипофиз — яичники — матка.
Исходя из полученных данных, можно сказать, что значение М-эхо не всегда является показателем патологии эндометрия, и следует искать дополнительные молекулярно-генетические предикторы, которые в совокупности с другими показателями могли бы предсказать необходимость внутриматочного вмешательства.
На основании патоморфологического исследования биоптатов эндометрия после раздельного лечебно-диагностического выскабливания было выявлено, что у 12 (40%) пациенток 1-й группы была простая ГЭ без атипии, у 11 (36,67%) — сложная ГЭ без атипии, у 7 (23,33%) — атипическая ГЭ. При гистологическом исследовании материала во 2-й группе у 2 (6,67%) пациенток был обнаружен железистый ПЭ, у 28 (93,33%) — железисто-фиброзный ПЭ. В 3-й группе в 10 (38,6%) наблюдениях был выявлен эндометрий в фазе пролиферации, в 16 (61,54%) — в фазе неполноценной секреции. При этом воспалительная инфильтрация у пациенток 2-й группы (63,33%; n=19) выявлялась достоверно чаще — в 3,16 и 3,29 раза, чем у пациенток 1-й (20%; n=6) и 3-й (19,23%; n=5) групп соответственно (р<0,05).
Выводы
Больные с ГЭ имеют следующие клинические особенности: статистически значимо высокую частоту аномальных маточных кровотечений, обменно-эндокринных соматических заболеваний, нарушений в системе гемостаза по сравнению с пациентками с ПЭ и пациентками группы контроля.
Пациентки с ПЭ имеют следующие клинические особенности: статистически значимо большую частоту цервицита и вагинит в анамнезе по сравнению с пациентками с ГЭ и пациентками группы контроля.
Профилактика патологии эндометрия должна складываться не только из своевременного выявления и контроля ановуляции, коррекции эндокринных нарушений, но и коррекции воспалительных заболеваний женских половых органов. При наблюдении пациенток с миомой матки и аденомиозом, с тромбозами в анамнезе следует проявлять настороженность по отношению к ГЭ, в т. ч. проводя первичную и вторичную профилактику ГЭ.
Сведения об авторах:
Саламова Камилла Курбановна — аспирант кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-1137-5492.
Сапрыкина Людмила Витальевна — к.м.н., ассистент кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-2931-0956.
Рамазанова Алена Магомедовна — аспирант кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-0927-8562.
Мильдзихова Зарина Таймуразовна — студентка 6-го курса лечебного факультета ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0003-4328-4843.
Столярова Елизавета Валерьевна — студентка 6-го курса лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва,
ул. Островитянова, д. 1.
Контактная информация: Саламова Камилла Курбановна, e-mail: kami_812@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 04.02.2021, поступила после рецензирования 03.03.2021, принята в печать 29.03.2021.
About the authors:
Kamilla K. Salamova — postgraduate student of the Department of Obstetrics & Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0003-1137-5492.
Lyudmila V. Saprykina — Cand. of Sci. (Med.), assistant of the Department of Obstetrics & Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-2931-0956.
Alena M. Ramazanova — postgraduate student of the Department of Obstetrics & Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0003-0927-8562.
Zarina T. Mildzikhova — student of the 6th course of the Medical Faculty, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0003-4328-4843.
Elizaveta V. Stolyarova — student of the 6th course of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation.
Contact information: Kamilla K. Salamova, e-mail: kami_812@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 04.02.2021, revised 03.03.2021, accepted 29.03.2021.
.
Информация с rmj.ru