Введение
Формирование плаценты — это сложный и многоэтапный процесс, полноценность которого во многом определяется васкуло- и ангиогенезом. Васкулогенез — это образование новых кровеносных сосудов из мезодермальных клеток-предшественников эндотелиальных клеток (гемангиобластов), которое начинается в конце 3-й недели гестации [1]. Ангиогенез — это образование сосудов из уже существующих структур за счет механизмов элонгации, инвагинации и капиллярного почкования [2].
Элонгация — это удлинение сосуда за счет пролиферации эндотелиальных клеток, которое представляет собой неразветвляющийся ангиогенез. Инвагинация и капиллярное почкование являются разветвляющимся ангиогенезом. При инвагинации происходит образование нового сосуда внутри просвета предыдущего за счет миграции эндотелиальных клеток, а при капиллярном почковании новая боковая ветвь сосуда формируется при помощи ее латерального роста.
Васкулогенез и ангиогенез регулируются цитокинами и факторами роста [3]. Одним из наиболее значимых является сосудистый эндотелиальный фактор роста
(VEGF) [4–6]. Установлено, что рецепторы VEGFR1 и VEGFR2 экспрессируются в плацентарном синцитиотрофобласте, эндотелиальных клетках капилляров плацентарных ворсин [7, 8]. VEGF, связываясь с мембранными тирозинкиназными рецепторами VEGFR1 (нерастворимая форма), запускает каскад реакций, дающих старт ангиогенезу. Активация VEGFR2 способствует повышению сосудистой проницаемости, миграции и пролиферации эндотелиальных клеток Установлено, что уровень VEGF увеличивается со сроком гестации и к III триместру в 5 раз превышает исходные показатели [9]. На поздних стадиях ангиогенеза макрофаги, фибробласты и гладкомышечные клетки секретируют антиангиогенные факторы, тормозящие миграцию и пролиферацию эндотелиальных клеток, обеспечивая оптимальный баланс между ангиогенезом и апоптозом эндотелиальных клеток, который необходим для нормального функционирования плаценты [10, 11].
В ходе иммуногистохимических исследований плацент было обнаружено, что VEGF и его рецепторы VEGFR1 и VEGFR2 локализуются не во всех слоях плаценты, а только в цитотрофобласте, ангиогенных клетках, клетках Гофбауэра и преэндотелиальных клетках, формирующих примитивную сосудистую сеть. На фоне гипоксии экспрессия VEGF и VEGFR1 в плаценте несколько повышается [12, 13], а экспрессия VEGFR2 снижается [14].
Тонус сосудов фетоплацентарного комплекса контролируется несколькими вазоактивными медиаторами, главным из которых является оксид азота (NO), синтезируемый под влиянием эндотелиальной синтазы (eNOS). Основное предназначение продукции NO заключается в поддержании низкой сосудистой резистентности в плацентарных артериях не только посредством паракринного эффекта, но и за счет ангиогенеза [15, 16]. Экспериментально доказано, что участие NO более значимо в процессах ангиогенеза, нежели васкулогенеза. Во II и III триместрах продукция эндотелиальной синтазы происходит в синцитио-трофобласте. Образование NO плацентарной NOS в межворсинчатом пространстве может препятствовать адгезии и агрегации тромбоцитов и способствовать расслаблению гладкомышечных клеток ворсин [17]. Иммуногистохимически было обнаружено, что в III триместре беременности троекратно повышается экспрессия eNOS в эндотелии плацентарных сосудов по сравнению с другими отделами кровеносного русла [18], eNOS индуцирует пролиферацию эндотелиальных клеток и ангиогенез В эндотелиальных клетках VEGF индуцирует eNOS-зависимый синтез NO путем активации VEGFR1 и VEGFR2. Обнаружено, что очень высокий уровень NO может предотвратить ангиогенез, а его влияние на клеточную пролиферацию зависит от концентрации [19].
Важную роль в процессах неоваскуляризации играют ангиогенные Т-лимфоциты (CD31) [20, 21]. Они локализуются между эндотелиальными клетками кровеносных сосудов, обеспечивают клеточную адгезию и регулируют эндотелиальную проницаемость CD31 характеризуют активность процессов ангиогенеза [22]. Маркером ранней дифференцировки клеток-предшественников гемопоэза и эндотелиальных клеток является трансмембранный белок CD34, он локализуется в ворсинках плацент и сосудистой сети [23]. Данный белок определяет сосудистую плотность, а его уровень коррелирует с процессами васкулогенеза [24]. На фоне плацентарной недостаточности, задержки роста плода и переношенной беременности уровень экспрессии CD34 в капиллярах ворсин цитотрофо-бласта снижается [25]. Маркеры CD34 и CD31 используются для иммуногистохимической детекции кровеносных сосудов и оценки их плотности в ткани [26].
Проведение химиотерапии во время беременности допустимо со II триместра, но сопряжено с рядом рисков [27, 28], прежде всего формированием плацентарной недостаточности Плацента выступает в качестве биологического барьера, все химиопрепараты проникают через нее путем пассивной или облегченной диффузии и путем активного транспорта [29]. Скорость проникновения определяется молекулярным весом лекарственного препарата, его липофильностью и связью с белками-переносчиками Частично происходит абсорбция химиопрепаратов в тканях плаценты, что позволяет снизить концентрацию лекарства в плодовом кровотоке
Исследований, посвященных изучению влияния химиопрепаратов на структурные и функциональные изменения в плаценте, недостаточно.
Цель исследования: изучить процесс васкуло- и ангиогенеза в плацентах на фоне химиотерапии.
Материал и методы
Проведено проспективное исследование по дизайну «случай — контроль», одобренное Локальным этическим комитетом ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. Все пациентки дали информированное согласие на участие в исследовании. В исследование были включены 57 беременных Первую группу составили 10 беременных с онкопатологией, которым проводилась химиотерапия (n=10), 2-ю группу — 32 беременные с онкопатологией без химиотерапии, 3-ю группу, контрольную, — 15 здоровых пациенток с физиологически протекающей беременностью.
Возраст пациенток 1-й группы был от 22 до 38 лет (29±3,81 года). У 2 женщин во время беременности была диагностирована лимфома Ходжкина II и IV стадии (проведено 3 и 6 курсов химиотерапии по схеме BEACOPP-14 в 29, 32, 35-ю недели гестации и в послеродовом периоде). У 6 пациенток во время беременности диагностирован плоскоклеточный неороговевающий рак шейки матки T1аN0M0–T2bN0M0, IА–IB стадии, проведено 3 курса химиотерапии по схеме: доцетаксел 75–100 мг/м2, карбоплатин 500 мг (AUC-5) — у трех пациенток в сроки 26, 29 и 32 нед. и у остальных трех в сроки 27, 30 и 33 нед гестации. У 2 пациенток во время беременности диагностирована светлоклеточная карцинома молочной железы Т3N2M0–T4bN3M1, тройной негативный тип, проведено
2 курса химиотерапии по схеме АС доксорубицин 80 мг/м2, циклофосфан 800 мг/м2 у одной пациентки в сроки 22 и 25 нед. и у второй — в сроки 24 и 27 нед. гестации
Течение беременности в группе пациенток с онкопатологией на фоне химиотерапии было физиологическим у 4 (40%) женщин. Во II–III триместрах у 3 (30%) пациенток диагностирована угроза преждевременных родов, у 3 (30%) — развилось нарушение маточно-плацентарного кровотока (НМПК) IA степени, у 2 (20%) — задержка роста плода 1-й степени, у 4 (40%) — анемия легкой и средней степени
Во всех случаях было проведено оперативное родоразрешение путем операции кесарева сечения в сроки 32,1±2,9 нед
Возраст беременных 2-й группы был от 22 до 39 лет (33±3,99 года). У 6 пациенток беременность протекала на фоне рака молочной железы (in situ (n=2); инвазивный неспецифический рак T1cN2M0–T4bN1Mx, тройной негативный тип (n=2); низкодифференцированный инфильтративный протоковый неспецифический рак T2N0M0 (n=1); апокринная карцинома T2NхMx, люминальный тип В (n=1)), при этом в 1 случае заболевание выявлено в послеродовом периоде, в остальных случаях — во время беременности Онкоконсилиумом было принято решение родоразрешить беременных в сроки, близкие к доношенному, и назначить химиотерапию в послеродовом периоде
У 13 пациенток во время беременности был выявлен: плоскоклеточный рак шейки матки in situ (n=4) и инвазивный плоскоклеточный рак шейки матки T1bNxM0–T1b2N1M0, IB–IB2 (n=9). У 2 пациенток во время беременности диагностирован светлоклеточный рак почки T1bN0M0-T2bN0M0 II стадии и еще у 2 пациенток — папиллярный переходно-клеточный рак мочевого пузыря T1NхM0. У 3 пациенток беременность наступила после консервативного лечения высокодифференцированной аденокарциномы эндометрия T1аN0M0. По одной пациентке было с муцинозной цистаденокарциномой T1aN0M0, IА, высокодифференцированной эндометриоидной цистаденокарциномой T1aN0M0, аденокарциномой околоушной слюнной железы T2N2M0, лимфомой Ходжкина I стадии, папиллярным раком щитовидной железы T1аN0M0 и меланомой бедра T2aN0M0, диагностированными во время беременности Поскольку во время беременности онкологическое заболевание не прогрессировало, онкоконсилиумом было принято решение назначить химиотерапию после родоразрешения.
Во 2-й группе течение беременности у 9 (28,1%) пациенток осложнилось анемическим синдромом, у 19 (59,4%) — угрозой преждевременных родов и плацентарной недостаточностью (НМПК IА и II степени и задержкой роста плода 2–3-й степени) в 3 (9,4%) случаях.
Роды в срок и через естественные родовые пути произошли у 13 (40,6%) пациенток, путем операции кесарева сечения — у 19 (59,4%). Средний срок оперативного родоразрешения составил 37,8±2,19 нед.
Третью, контрольную, группу составили 15 здоровых женщин с физиологически протекающей беременностью в возрасте от 23 до 37 лет (29,0±4,1 года). Все были родоразрешены влагалищным путем в срок 39,6±1,4 нед.
Морфологическое и иммуногистохимическое (ИГХ) исследование проводилось на базе отделения патоморфологии ГБУЗ «ГКБ № 40 ДЗМ». После родоразрешения из центральной части плаценты вырезали участок размером 2×2 см и фиксировали в 10% растворе нейтрального формалина После стандартной парафиновой проводки изготавливали срезы, которые окрашивали гематоксилином Майера и эозином. После стандартного гистологического исследования проводили ИГХ-исследование на депарафинированных срезах толщиной 4–5 мкм Депарафинирование, демаскировку антигеном и ИГХ-исследования проводили по стандартным протоколам с использованием автостейнера Leica Bond Max. В качестве первичных антител использовали мышиные моноклональные антитела к CD31 (клон JC70, Cell Marque, разведение 1:100), CD34 (клон QBEnd/10, Cell Marque, разведение 1:100), VEGF (клон C12, Cloud-Clone Corp., разведение 1:100) и кроличьи поликлональные антитела к VEGFR1 (GeneTex, разведение 1:100), VEGFR2 (GeneTex, разведение 1:100) и eNOS (Cloud-Clone Corp., разведение 1:100). После проведения ИГХ-реакции ядра клеток докрашивали гематоксилином Майера
Оценку ИГХ-реакции проводили с использованием полуколичественных и количественных методов Для CD31, CD34 оценивали интенсивность реакции по шкале от 0 до 3 баллов (0 баллов — реакция отсутствует, 1 балл — слабая реакция, 2 балла — умеренная реакция, 3 балла — выраженная реакция) — это объективная оценка, она проводится с помощью автоматизированной аппаратуры (микроспектрофотометры, денситометры) с использованием единого принципа измерения по закону Ламберта — Бэра на основе поглощения света. Для VEGF, VEGFR1 и VEGFR2, помимо оценки интенсивности реакции, также подсчитывали количество позитивно окрашенных клеток в 1 поле зрения (при увеличении 200). Подсчет позитивно окрашенных клеток выполняли в 10 полях зрения при увеличении 200 и рассчитывали среднее арифметическое Для eNOS по такой же методике определяли среднее значение позитивно окрашенных клеток отдельно в эпителиальных клетках и клетках стромы
Статистическую обработку данных проводили с использованием программы IBM SPSS Statistics 25 (IBM, США). Рассчитывали средние значения, стандартное отклонение, стандартную ошибку среднего, 95% доверительный интервал. Так как распределение показателей соответствовало нормальному, для определения различий между группами использовали T-критерий Стьюдента и критерий χ2. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
Материалом для морфологического исследования служили участки центральной части плацент, полученных от 42 женщин с онкологическими заболеваниями и 15 здоровых пациенток.
При гистологическом изучении препаратов плацент здоровых беременных (контрольная группа), окрашенных гематоксилином и эозином, отмечались соответствие степени созревания ворсинчатого дерева сроку гестации, умеренно выраженные компенсаторно-приспособительные и инволютивно-дистрофические процессы.
В 10 (100%) плацентах из 1-й группы и 15 (46,8%) плацентах из 2-й группы отмечалось несоответствие созревания ворсинчатого дерева сроку гестации с отставанием от гестационного срока на 2–4 нед. При этом во всех плацентах из 1-й группы выявлялись разной степени выраженности отек стромы ворсин и широкое межворсинчатое пространство. Основную массу ворсинчатого дерева составляли ворсины крупного диаметра с небольшим количеством капилляров.
При ИГХ-исследовании гистологических препаратов плацент в структуре трофобласта и эндотелии сосудов оценивали интенсивность реакции и количество позитивно окрашенных клеток (табл. 1). Интенсивность реакции — это качественный показатель, а среднее количество клеток (плотность) — это количественный показатель, который рассчитывается по числу позитивно окрашенных клеток в 1 поле зрения
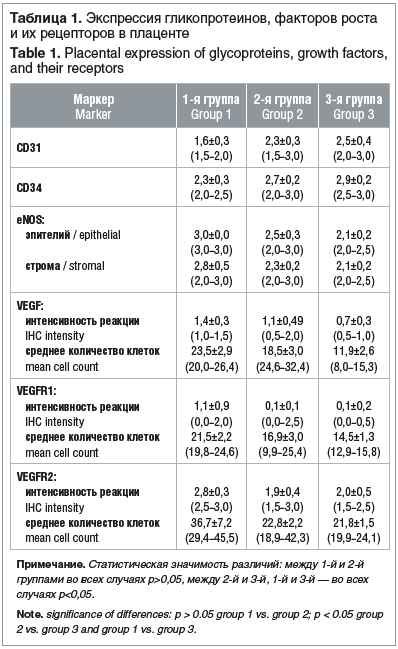
В результате нами не было выявлено значимых отличий в концентрациях CD31, CD39, eNOS, VEGF, VEGFR1 и VEGFR2 в ткани плацент от пациенток с онкопатологией без химиотерапии и пациенток контрольной группы (p>0,05).
В плацентах пациенток, получавших химиотерапевтическое лечение, обнаружено значимое повышение уровня VEGF и его рецепторов Интенсивность реакции VEGF и плотность клеток с положительным окрашиванием в 2 раза превышали показатели в контрольной группе В 11 раз была повышена активность VEGFR1 и в 1,4 раза — VEGFR2. Среднее количество клеток, экспрессирующих VEGFR1 и VEGFR2, в 1 поле зрения возросло в 1,5 и 1,7 раза соответственно Эти результаты могут свидетельствовать о развитии компенсаторной реакции на гипоксию [30, 31]. Гипоксия обусловлена несколькими факторами: а) как следует из ИГХ, в группе беременных с химиотерапией снижено количество CD31 и CD34, которые являются показателями ангиогенеза, соответственно, на фоне лечения онкопатологии химиопрепаратами образование сосудов (ангиогенез, васкулогенез) в развивающейся плаценте не такое активное, как в здоровой плаценте; б) у беременных с онкопатологией на фоне химиотерапии выявлены НМПК в 30% случаев и анемия легкой и средней степени в 40%: НМПК может быть спровоцировано нарушенным ангиогенезом в плаценте, а анемия может быть как следствием подавления эритроцитарного ростка кроветворения вследствие химиотерапии, что является одним из частых осложнений этого лечения, так и следствием гемодилюции при беременности, что является физиологическим процессом.
Весьма интересные данные получены при анализе соотношений интенсивности экспрессии рецепторов и самого фактора роста В нормальных плацентах при анализе иммуногистохимического распределения рецепторов по сравнению с самим фактором роста наблюдаются более низкие уровни их экспрессии для VEGFR1 и более высокие для VEGFR2. В группе пациенток с химиотерапией отношение интенсивности VEGFR1/VEGF было выше нормальных показателей в 5,5 раза, а отношение интенсивности VEGFR2/VEGF было ниже, чем в контрольной группе, в 1,4 раза (рис 1–3).

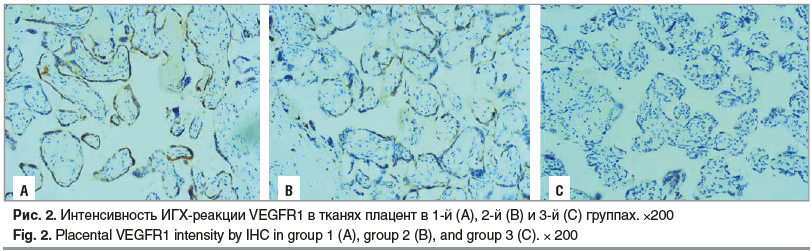
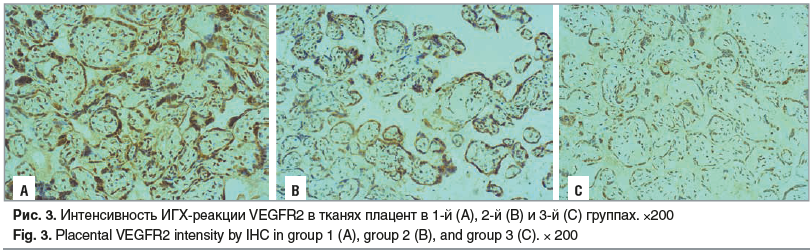
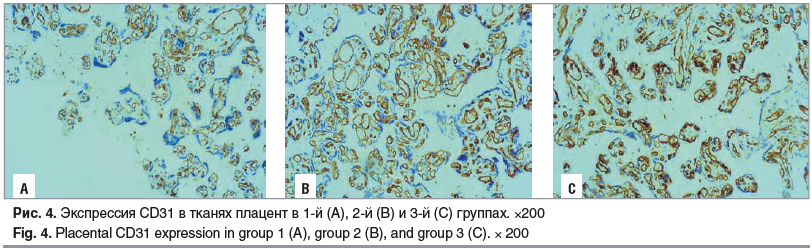
CD31 является показателем активности процессов ангиогенеза, т. е. образования сосудов из уже имеющихся, а СD34 отражает процессы васкулогенеза. В тканях плацент от пациенток, получавших химиотерапию, по сравнению с контрольной группой выявлено снижение количества CD31 (в 1,6 раза) и CD34 (в 1,3 раза) (рис. 4, 5). Полученные результаты позволяют предположить, что химиотерапевтические средства в большей степени влияют на процесс ветвления сосудов и образования капиллярной сети, нежели на формирование сосудов de novo.

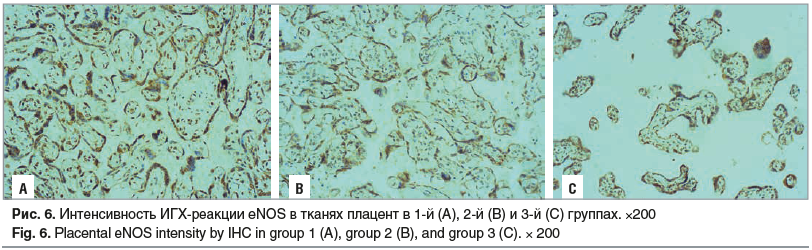
Экспрессия еNOS коррелирует с увеличением содержания VEGF, поскольку только при активации рецепторов к VEGF запускаются процессы образования еNOS и синтеза NO. В тканях плацент от пациенток после химиотерапии выявлено повышение уровня еNOS в эпителии и строме ворсин в 1,4 и 1,3 раза соответственно (рис. 6).
 Вопрос ангиогенеза в плаценте в условиях химиотерапии требует дальнейшего изучения с выполнением исследований, включающих большую выборку пациентов, а также влияние различных схем химиотерапии на сосудистую сеть плаценты.
Вопрос ангиогенеза в плаценте в условиях химиотерапии требует дальнейшего изучения с выполнением исследований, включающих большую выборку пациентов, а также влияние различных схем химиотерапии на сосудистую сеть плаценты.
Заключение
Полученные результаты иммуногистохимического исследования нормальных плацент в целом согласуются с данными литературы о распределении VEGF и его рецепторов [2]. Полученные в ходе сравнительного анализа данные свидетельствуют об отсутствии самостоятельного влияния онкологических заболеваний на процессы ангио- и васкулогенеза
Нами установлено, что в плацентах беременных на фоне химиотерапии преобладает ангиогенез без ветвления сосудов При этом отмечается более выраженная экспрессия VEGF и его рецепторов VEGFR2 по сравнению с нормальными плацентами. В нормальных условиях связывание VEGF с VEGFR2 активирует процессы ангиогенеза путем усиления пролиферации эндотелиоцитов и их роста. В условиях умеренной гипоксии связывание VEGF с его рецептором VEGFR2 вызывает гиперкапилляризацию промежуточных ворсин по классическому механизму обратной связи, что сопровождается выраженной экспрессией VEGF и VEGFR2 в эндотелиальных клетках сосудов ворсин
Несмотря на то, что на фоне химиотерапии создаются условия для развития преплацентарной гипоксии и выявляется сочетанное повышение экспрессии VEGF и VEGFR2, гистологическое изучение препаратов показало преобладание ангиогенеза без ветвления сосудов. Подобные изменения, по-видимому, обусловлены влиянием факторов и механизмов, препятствующих связыванию VEGF с его рецептором и, соответственно, ингибирующих характерные для гипоксии процессы ангиогенеза с ветвлением
Выявленные нами особенности иммуногистохимического распределения экспрессии VEGF и его рецепторов в ткани плаценты беременных, получающих терапию цитостатиками, в определенной мере отражают процессы компенсации и нарушения функционирования системы мать — плацента — плод в условиях преплацентарной гипоксии.
Сведения об авторах:
Боровкова Екатерина Игоревна — д.м.н., профессор кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-7140-262X.
Арутюнян Анна Меружановна — аспирант кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул Островитянова, д. 1; ORCID iD 0000-0002-6392-5444.
Данелян Соня Жоровна — к.м.н., врач высшей квалификационной категории, заведующая родильным домом ГБУЗ «ГКБ № 40 ДЗМ»; 129336, Россия, г. Москва, ул. Таймырская, д. 6; ORCID iD 0000-0002-8594-6406.
Малышева Евгения Михайловна — к.м.н., заведующая патологоанатомическим отделением ГБУЗ «ГКБ № 40 ДЗМ»; 129301, Россия, г. Москва, ул. Касаткина, д. 7; ORCID iD 0000-0003-0974-0403.
Жарков Николай Владимирович — к.б.н, биолог Централизованного патологоанатомического отделения ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия,
г. Москва, ул. Трубецкая, д. 8, стр. 2; врач-патологоанатом
ГБУЗ «ГКБ № 40 ДЗМ»; 129301, Россия, г. Москва, ул. Касаткина, д. 7; ORCID iD 0000-0001-7183-0456.
Аксенова Татьяна Николаевна — врач-патологоанатом ГБУЗ «ГКБ № 40 ДЗМ»; 129301, Россия, г. Москва,
ул. Касаткина, д. 7; ORCID iD 0000-0001-6848-0459.
Контактная информация: Арутюнян Анна Меружановна, e-mail: annochka21.90@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует Статья поступила 07.12.2020, поступила после рецензирования 30.12.2020, принята в печать 29.01.2021.
About the authors:
Ekaterina I. Borovkova — Doct. of Sci. (Med.), professor of the Department of Obstetrics & Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0001-7140-262X.
Anna M. Arutyunyan — postgraduate student of the Department of Obstetrics & Gynecology of the Medical Faculty, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0002-6392-5444.
Sonya Zh. Danelyan — Cand. of Sci. (Med.), obstetrician gynecologist of the highest qualification category, Head of the Maternity Hospital, City Clinical Hospital No. 40; 6, Taimyrskaya str., Moscow, 129336, Russian Federation; ORCID iD 0000-0002-8594-6406.
Evgeniya M. Malysheva — Cand. of Sci. (Med.), Head of the Department of Morbid Anatomy, City Clinical Hospital No. 40; 7, Kasatkin str., Moscow, 129301, Russian Federation; ORCID iD 0000-0003-0974-0403.
Nikolai V. Zharkov — Cand. of Sci. (Biol.), biologist of the Centralized Department of Morbid Anatomy, I.M. Sechenov First Moscow State Medical University (Sechenov University), 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; morbid anatomist of the Department of Morbid Anatomy, City Clinical Hospital No. 40; 7, Kasatkin str., Moscow, 129301, Russian Federation; ORCID iD 0000-0001-7183-0456.
Tat’yana N. Aksenova — morbid anatomist of the Department of Morbid Anatomy, City Clinical Hospital No. 40; 7, Kasatkin str., Moscow, 129301, Russian Federation; ORCID iD 0000-0001-6848-0459.
Contact information: Anna M. Arutyunyan, e-mail: annochka21.90@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 07.12.2020, revised 30.12.2020, accepted 29.01.2021.
.
Информация с rmj.ru





