Содержание статьи
Введение
Заложенность носа (обструкция) является одним из основных симптомов аллергического ринита (АР) среднетяжелого и тяжелого течения. Снижение обоняния или аносмия характерны для тяжелого АР и способствуют риску развития бронхиальной астмы у таких больных [1–3]. Однако данные симптомы отмечаются и при других заболеваниях, перечень которых аллерголог и оториноларинголог исключают одновременно при междисциплинарном взаимодействии. К таким заболеваниям относятся: инфекционный ринит; ринит, обусловленный аномалиями внутриносовых анатомических структур, полипозный риносинусит; неинфекционный неаллергический ринит (НАР), лекарственно-индуцированный НАР (вследствие применения нестероидных противовоспалительных средств, ингибиторов ангиотензинпревращающего фермента и деконгестантов); гормональный НАР (связанный с беременностью, половым созреванием, менструальным циклом, приемом контрацептивов, акромегалией, гипотиреозом); ринит пожилых людей (атрофический) и др. [4]. Оценка назальной обструкции и обонятельной дисфункции в качестве дополнительной информации о степени тяжести заболевания традиционно возлагается на оториноларинголога. Однако не все ЛОР-врачи располагают временем и технической возможностью проводить функциональные тесты (отсутствие риноманометра и обонятельных тестов в медицинском учреждении). Мы решили представить наш опыт работы с вышеперечисленными функциональными тестами в качестве дополнительных рутинных инструментов для работы аллергологов-иммунологов в надежде на то, что он будет использоваться коллегами в сложных клинических случаях не только для дифференциальной диагностики заболеваний носа, но и для объективной оценки эффективности проводимой терапии АР.
Собственные результаты
Цель исследования: комплексное использование трех дополнительных инструментов оценки назальной обструкции и дисфункции обоняния (UPSIT (University of Pennsylvania Smell Identification Test — тест Пенсильванского университета «Исследование качественного распознавания запахов»), измерение пикового потока вдоха через нос (ППВН)) и тест с использованием комбинации топического деконгестанта и неседативного антигистаминного препарата (АГП)) в специализированном аллергологическом обследовании пациентов, страдающих среднетяжелым и тяжелым АР.
Материал и методы
Нами было обследовано 47 пациентов в возрасте от 18 до 67 лет (средний возраст — 31,2±2,7 года), из них женщин — 24 (51,06%), мужчин — 23 (48,94%), с АР среднетяжелого (16 человек) и тяжелого течения (31 человек). У всех пациентов отмечалась мультисенсибилизированность к бытовым, пыльцевым, грибковым и эпидермальным аллергенам. Диагностика аллергии проводилась путем определения специфических IgE методами ИФА (иммуноферментный анализ) и ImmunoCap ISAC.
Основные причины повторной обращаемости пациентов за специализированной помощью к аллергологу-иммунологу — отсутствие контроля над симптомами ринита, сомнения относительно точности диагноза и дифференциальная диагностика. Следует отметить, что большинство пациентов обратились на прием в период обострения АР, они предварительно получали системную терапию АГП. Помимо стандартных общеклинических исследований и консультации ЛОР-врача были проведены функциональные тесты для оценки назальной обструкции и UPSIT [5, 6]. Оценка степени назальной обструкции проводилась врачом аллергологом-иммунологом с помощью прибора In-Check Nasal (Sensonics International, США) [7] и препарата Фринозол (рис. 1). С помощью In-Check Nasal выполнялось объективное измерение ППВН до применения препарата Фринозол и после его применения — с целью исследования реверсивности назальной обструкции на фоне местного применения интраназального деконгестанта в сочетании с АГП (фенилэфрин + цетиризин). Исходный диапазон ППВН (до применения препарата Фринозол) измеряется в спектре от 30 до 370 л/мин. Исследование проводится индивидуально, по полученному лучшему результату из 3 показаний после поочередных форсированных вдохов пациента через нос с разницей в 2 мин. После инсуффляции Фринозола по 2 впрыскивания в каждый носовой ход повторное измерение ППВН проводится через 20 мин в той же последовательности.
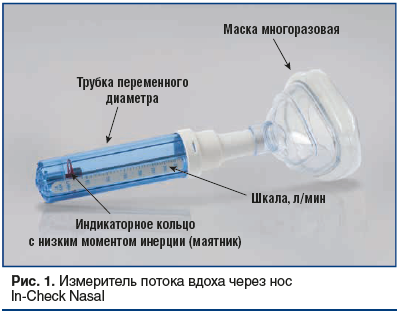
UPSIT позволяет определить обонятельную дисфункцию у человека. Он является «золотым стандартом» среди тестов для распознавания запахов, имеет низкий уровень погрешности — ±5 л/мин (надежность теста r=0,94). Тест разработан в 1980 г. Ричардом Доти и переведен на 40 языков [6, 7]. UPSIT основан на сравнительной способности людей распознавать запахи на надпороговом уровне. Он состоит из 4 тестовых буклетов по 10 страниц каждый. На каждой странице внизу справа расположена микрокапсулированная подушечка с кристаллами аромата. Пациент простым карандашом скарифицирует поверхностный слой подушечки, нюхает ее и указывает на один из 4 вариантов ответов (названий ароматов), перечисленных на каждой странице. Требуется ответ даже в случае отсутствия запаха (тест с принудительным выбором). Общий индекс обоняния определяется в баллах. Общая оценка испытуемого проводится по 40 пунктам с помощью специальных ключей. 19–30 баллов в результате тестирования оцениваются как гипосмия, менее 18 баллов — как полная функциональная аносмия, 30–40 баллов — как нормосмия.
Результаты исследования
Вышеперечисленные инструменты были просты и доступны, их использование на приеме занимало небольшое количество времени, нравились пациентам благодаря вовлеченности в исследование и объективности полученных данных. У всех пациентов по результатам исследований была выявлена аносмия — общий индекс обоняния по UPSIT составил 11,9 балла (95% ДИ 8,5–15,4 балла). Исходные показатели назальной обструкции у пациентов с АР варьировали от 50 до 120 л/мин (95% ДИ 85–110 л/мин),
что свидетельствует о среднетяжелой и тяжелой степени заложенности носа (норма — от 150 до 370 л/мин). Наиболее часто (до 75%) пациенты идентифицировали следующие одоранты: бензин, дым, мята, апельсин, лайм и арбуз. Наименее узнаваемыми (не более 25%) были запахи клубники, шоколада, сыра чеддер, розы, имбиря и травы. Таким образом, пациенты определяли наиболее сильные и знакомые запахи. Более нежные и редко встречающиеся в повседневной жизни ароматы пациенты не идентифицировали.
Реверсивность назальной обструкции через 20 мин использования препарата Фринозол составила прирост от 35 до 50 л/мин, увеличив таким образом воздушный поток вдоха через нос от 85 до 170 л/мин. Улучшение показателей после использования назального спрея Фринозол объясняется его фармакологическими свойствами (сочетание фенилэфрина и цетиризина). Фенилэфрин — α1-адреномиметик, при местном применении оказывает селективное умеренное сосудосуживающее действие за счет стимуляции α1-адренорецепторов, расположенных в сосудах; мало влияет на β-рецепторы сердца. Обладая мягким вазоконстрикторным эффектом (длительность — до 6 ч), не вызывает значительного снижения кровотока в слизистой оболочке носовой полости и реже провоцирует развитие «синдрома рикошета» [8]. С учетом особенностей патогенетического механизма воспаления при АР, включающего выброс биологически активных медиаторов и высвобождение гистамина, целесообразно применение препаратов, блокирующих данные эффекты и оказывающих противовоспалительное действие. К таким препаратам относят АГП 2-го поколения, эффективность которых при патологии носа представлена в метаанализах и рандомизированных клинических исследованиях [9–11]. Одним из АГП 2-го поколения является хорошо известный селективный блокатор Н1-гистаминовых рецепторов цетиризин, представляющий собой карбоксилированный метаболит гидроксизина. Препарат обладает антигистаминным, противоаллергическим и противовоспалительным эффектом. Последний заключается в снижении хемотаксиса эозинофилов и нейтрофилов; уменьшении экспрессии адгезивных молекул на мембране эозинофилов; угнетении экспрессии ICAM1 на эндотелиальных клетках, что приводит к торможению миграции клеток-эффекторов в зону аллергического воспаления. Противовоспалительный эффект цетиризина проявляется также в подавлении IgE-опосредованной активации тромбоцитов и выделения цитотоксических биоактивных медиаторов [9–11].
Так, в ряде работ были представлены доказательства эффективности интраназального применения цетиризина у пациентов с сезонным аллергическим ринитом (САР). В этих работах также проводилось сравнение спрея и таблетированной формы цетиризина. При одинаковой эффективности обеих лекарственных форм цетиризина в отношении назальных и глазных симптомов при САР в ответ на провокацию аллергена только интраназальное введение цетиризина подавляло экссудацию плазмы в слизистой носа [8, 12]. Эффективность интраназального 0,125% цетиризина в сравнении с плацебо в отношении назальных симптомов (обструкции, ринореи, чихания, аносмии) показана в исследовании 360 пациентов с круглогодичным АР (КАР) [8, 13].
Применение топического цетиризина предопределяет безопасность и успех лечения, поскольку препарат доставляется непосредственно в очаг воспаления, в частности в полость носа, хорошо переносится больными, позволяет избежать возможных осложнений системной терапии [8]. При этом, согласно общепринятой ступенчатой стратегии лечения АР [4], применение сосудосуживающих средств при АР допускается при обязательном назначении неседативных АГП — топических (интраназальных) или системных. Фиксированная комбинация агониста α1-адренорецепторов и блокатора гистаминовых H1-рецепторов 2-го поколения уменьшает проницаемость капилляров, предотвращая развитие отека слизистой оболочки полости носа и придаточных пазух. Быстрое уменьшение отека слизистой оболочки полости носа является основой терапии АР, обеспечивая хороший доступ к слизистой топическим глюкокортикостероидам (ГКС). Фринозол включен в действующие рекомендации Минздрава России по лечению АР в качестве стартовой терапии у взрослых для быстрого снятия симптомов АР [15], входит в алгоритм комплексной терапии АР.
Алгоритм комплексной терапии АР
Врачи должны руководствоваться алгоритмом комплексной терапии АР, рекомендованным основными согласительными документами: программой ARIA (Allergic Rhinitis and its Impact on Asthma — Аллергический ринит и его влияние на астму) 2019, Консенсусом PRACTALL (Pharmacotherapy Recommendations for Children — Рекомендации по фармакотерапии для детей) 2015, EAACI / WAO (European Academy of Allergy and Clinical Immunology / World Allergy Organization — Европейская академия аллергологов и клинических иммунологов / Всемирная организация аллергологов) 2020, Национальными рекомендациями 2019, РАДАР 2015 (Рекомендации и алгоритм при детском аллергическом рините). Учитывая данные рекомендации, мы используем следующий алгоритм назначений нашим пациентам с АР. Первоначально оцениваем критерии за предшествующие 4 нед. Для этого используем вышеуказанные UPSIT, оценку ППВН, тест с Фринозолом, а также визуальную аналоговую шкалу (ВАШ), интегральный индекс симптомов, оцениваем качество жизни пациентов.
ВАШ представляет собой горизонтальную градуированную линию длиной 10 см, на которой пациент отмечает вертикальной чертой оценку влияния АР на свое самочувствие, выраженную в баллах от 0 до 100, где 0 — это отсутствие жалоб и симптомов, а 100 — максимально выраженные проявления болезни. Далее расстояние до вертикальной черты измеряется в миллиметрах и выражается в баллах. Результаты от 0 до 50 свидетельствуют о контролируемом течении АР, от 50 и выше — о неконтролируемом течении АР [4].
Интегральный индекс симптомов позволяет оценить клинические признаки АР по тяжести в баллах от 0 до 3: 0 баллов — отсутствие симптома; 1 балл — очевидный, но слабовыраженный и легко переносимый симптом; 2 балла — умеренно выраженный симптом, доставляющий неудобство, но хорошо переносимый пациентом; 3 балла — симптом заболевания переносится тяжело, может быть препятствием к выполнению ежедневных обязанностей или сопровождаться нарушением сна. Далее суммируют полученные баллы для всех 8 симптомов: назальных и неназальных (максимальный балл — 24) [4]. Назальные симптомы АР оценивают по TNSS (Total Nasal Symptom Score, Шкала общих назальных симптомов), учитывая степень выраженности каждого из 4 назальных симптомов: затруднение носового дыхания, ринорея, чихание, зуд в носу. Неназальные симптомы АР оценивают по TNNSS (Total Non Nasal Symptom Score, Шкала общих неназальных симптомов), учитывая степень выраженности каждого из 4 неназальных симптомов: зуд / жжение глаз, покраснение глаз, слезотечение, зуд ушей или неба [4].
Оценка качества жизни при АР осуществляется с помощью валидизированного опросника RQLQ (Rhinoconjunctivitis Quality of Life Questionnaire — Опросник качества жизни при риноконъюнктивите), учитывающего функциональные проблемы, с которыми сталкиваются больные с АР в своей повседневной жизни (физические, эмоциональные, социальные и профессиональные). Опросник включает 28 вопросов, объединенных в 7 разделов. Показатели по каждому вопросу оцениваются по шкале ухудшения от 0 до 6, где более высокие показатели (максимальное количество баллов — 168) отражают более существенное ухудшение качества жизни [4].
Активность аллергического процесса оценивают по уровню эозинофилов в назальном секрете (риноцитограмма) [4, 16].
С учетом вышесказанного любое отклонение от нормы расцениваем как потерю контроля симптомов АР [4]. При этом необходимо перепроверить диагноз и/или приверженность лечению либо влияние сопутствующих заболеваний и/или анатомических аномалий, прежде чем назначать либо усиливать терапию [4].
При этом потеря контроля симптомов АР означает использование симптоматических средств или средств скорой помощи, которыми, согласно современным рекомендациям, в случае АР являются сосудосуживающие средства (деконгестанты), назначаемые при нарушении носового дыхания [4].
Роль и место деконгестантов в лечении АР
Прежде чем ответить на этот вопрос, выясним, что происходит со слизистой верхних дыхательных путей при АР.
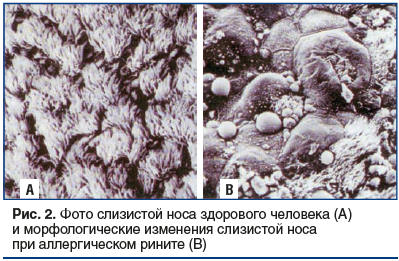
Слизистая носа здорового человека (рис. 2А) покрыта мерцательным эпителием, его реснички образуют сплошной «ковер», на который оседает пыль (в т. ч. патогены, аллергены и т. д.), она благодаря мерцанию ресничек изгоняется из носовой полости (при этом частицы от 8 мкм и более оседают на слизистой, 2–3 мкм — изгоняются до 50%, около 0,5 мкм — элиминируются полностью) [17]. Тем самым мерцательный эпителий, наряду с назальным секретом (секрет слизистых желез — glandulae nasi, имеет pH 7,4±0,3) составляющий так называемый мукоцилиарный аппарат, представляет собой первую линию защиты слизистой от патогенов [17]. Слизистая полости носа при АР (рис. 2В) бледная, отечная, рыхлая, активность ресничек снижена, выступающие участки слизистой содержат отечную жидкость [15, 17]. Отек и гиперемия слизистой способствуют внедрению аллергенов в подслизистый слой, где они связываются с тучными клетками, запуская каскад аллергических реакций. При этом избыток назального секрета, снижение его вязкости и эластичности уменьшают биение ресничек мерцательного эпителия, оно осуществляется неэффективно и не сопровождается перемещением разжиженного поверхностного слоя носового секрета [15, 17]. При этом отмечается увеличение экспозиции на поверхности слизистой оболочки полости носа микроорганизмов, аллергенов и поллютантов. Именно поэтому, используя деконгестанты в качестве «скоропомощного» средства, мы достигаем следующих эффектов: уменьшение отека, нормализация дренажа соустий пазух носа, восстановление мукоцилиарного клиренса, улучшение доставки лекарственного средства и ускорение эффекта, приостановление аллергической реакции [15].
Согласно рекомендациям деконгестанты при АР используются только в сочетании с неседативными АГП (оральными или назальными) [4, 18, 19]. В связи с этим удобно использовать комбинированные формы, содержащие одновременно 2 компонента (деконгестант + неседативный АГП), например Фринозол (цетеризин + фенилэфрин). Назначаются не более чем на 7–10 дней.
Для достижения контроля симптомов заболевания предлагается терапия, состоящая из 4 ступеней (step by step) [4, 18, 19]. Каждая из них включает различные варианты фармакологической терапии в зависимости от выраженности симптомов АР.
Принцип ступенчатого подхода к лечению АР заключается в увеличении объема терапии / переходе на ступень вверх (step up) при отсутствии контроля симптомов АР и уменьшении объема терапии / переходе на ступень вниз (step down) в случае достижения и поддержания контроля симптомов АР [4, 18, 19]. Клиническая оценка результатов терапии при персистирующем АР (ПАР) осуществляется через 2 нед. [4, 18, 19]. Как правило, начинаем с 1-й ступени, где назначаются неседативные АГП (оральные или топические), антагонисты лейкотриеновых рецепторов, кромоны. Если контроль достигнут, можно оставаться на этой ступени столько, сколько необходимо. При этом оптимальные рекомендации могут быть представлены в виде алгоритма: Фринозол 1 спрей-доза в каждый носовой ход 1 р/сут в течение 7 дней, далее переход на неседативные АГП (оральные или топические). Если не достигли контроля, то переходим на 2-ю ступень. Предпочтительными являются ингаляционные ГКС (например, мометазон фуроат, в частности Нозефрин). Как правило, назначаем их сразу, минуя 1-ю ступень, при всех стадиях ПАР и при среднетяжелом и тяжелом интермиттирующем АР, в т. ч. САР. То есть возможно применение следующей схемы терапии: Фринозол 1 спрей-доза в каждый носовой ход 1 р/сут 7 дней в сочетании с Нозефрином 1 спрей-доза в каждый носовой ход 1 р/сут, далее переход на Нозефрин в качестве монотерапии. Если достигли контроля, то остаемся на этой ступени. Если нет, то переходим на 3-ю ступень: комбинация ингаляционных ГКС (например, Нозефрин) с неседативными АГП (оральные или топические), антагонистами лейкотриеновых рецепторов. На этой стадии, как правило, достигаем контроля симптомов. Если нет, то переходим на 4-ю ступень, где при сохранении объема фармакотерапии 3-й ступени может быть рассмотрена биологическая терапия омализумабом в случае сочетания тяжелого АР с бронхиальной астмой (в случае изолированного АР пока не одобрена), хирургическое лечение сопутствующей патологии верхних дыхательных путей либо — как «терапия отчаяния» — оральные ГКС [4, 16, 18, 19].
То есть наиболее эффективной группой лекарственных препаратов, оказывающих противовоспалительное действие, являются топические (интраназальные) ГКС: они обладают максимально выраженным противовоспалительным эффектом, блокируют как раннюю, так и позднюю фазу аллергической реакции, а значит, практически все медиаторы воспалительного аллергического каскада [16].
Каковы же рекомендации по применению интраназального мометазона фуроата, в частности Нозефрина, при АР? Согласно инструкции показаниями к применению препарата являются: 1) САР или КАР у взрослых, подростков и детей с 2 лет; 2) острый синусит или обострение хронического синусита у взрослых (в т. ч. пожилого возраста) и подростков с 12 лет в составе комплексной терапии; 3) острый риносинусит с легкими и умеренно выраженными симптомами без признаков тяжелой бактериальной инфекции у пациентов в возрасте 12 лет и старше; 4) профилактическое лечение САР среднетяжелого и тяжелого течения у взрослых и подростков с 12 лет (рекомендуется
за 2–4 нед. до предполагаемого начала сезона пыления);
5) полипоз носа, сопровождаемый нарушением носового дыхания и обоняния, у взрослых (от 18 лет) [15, 16].
Подробнее хотелось бы остановиться на показании к профилактическому назначению интраназального мометазона фуроата при САР. Данный режим применения интраназального ГКС объясняется наличием так называемого «минимального персистирующего воспаления», т. е. признаков воспаления в слизистой верхних дыхательных путей (подтверждается биопсией) при отсутствии клинической манифестации симптомов АР [20]. Данное субклиническое воспаление возникает при минимальных уровнях концентрации причинно-значимой пыльцы в воздушной среде [20]. И если контролирующая воспаление фармакотерапия не назначается в этот момент, то при повышении концентрации пыльцы происходит лавинообразное нарастание клинической симптоматики. Если же терапия была назначена в этот период (за 1–2 нед. до предполагаемого обострения), то такое бурное развитие клинических симптомов не наблюдается либо они купируются [20].
С другой стороны, интересен еще один феномен — «эффект прайминга». Впервые он был описан J.T. Connell в 1968 г. и означает формирование специфической и неспецифической назальной гиперреактивности в результате множественных повторных контактов с аллергеном и развития аллергического воспаления [16, 21, 22]. То есть любые специфические (аллергены) и неспецифические триггеры (переохлаждение, эмоции, поллютанты) приводят к нарастанию симптомов АР за счет повышенной назальной гиперреактивности [22]. Таким образом, ингаляционные ГКС (например, Нозефрин) и другие препараты, используемые при САР, целесообразно отменять спустя 2–4 нед. после окончания сезона пыления[22] из-за наличия аллергического воспаления в слизистой оболочке носа в течение этого периода и «эффекта прайминга».
Выводы
Таким образом, с учетом вышесказанного можем сделать следующие выводы:
UPSIT, оценка ППВН и тест с Фринозолом являются современными инструментами оценки нарушений назальной функции и дисфункции обоняния у пациентов с АР.
Оценка выраженности назальной обструкции и ее положительная реверсивность на 35–50 л/мин являются объективными количественными критериями тяжести течения АР и прогноза эффективности симптоматической терапии.
Нарушение обоняния до аносмического диапазона у пациентов с АР свидетельствует о его тяжелом течении и необходимости назначения полного объема фармакотерапии согласно 3–4-й ступени Федеральных клинических рекомендаций 2019 г. [4, 16–19].
Динамическое наблюдение за пациентами с использованием возможных дополнительных инструментов диагностики нарушений функции носа, на наш взгляд, является очень информативным, недорогим и доступным методом в практической аллергологии.
У больных САР следует проводить предсезонную профилактику, начиная лечение неседативными АГП, антагонистами лейкотриеновых рецепторов или ингаляционными ГКС за 1–2 нед. до начала активного сезона поллинации (при появлении пыльцевых зерен в окружающем воздухе). При отсутствии пыльцевого мониторинга необходимо начинать лечение при первых симптомах САР. Продолжать лечение САР следует в течение всего периода цветения «аллергенных» растений и рекомендовать отмену препаратов через 2–4 нед. после окончания поллинации [22].
Благодарность
Авторы благодарят компанию АО «Вертекс» за предоставление интраназального спрея Фринозол.
.
Информация с rmj.ru

