Содержание статьи
Состояние вегетативной нервной системы при циррозе печени вирусной этиологии
Е. Ю. Плотникова*, доктор медицинских наук, профессор
Е. Н. Баранова*
М. В. Краснова**, кандидат медицинских наук
К. А. Краснов**, кандидат медицинских наук
*ГБОУ ВПО КемГМА МЗ РФ, **Кузбасский областной гепатологический центр МБУЗ ГКБ № 3 им. М. А. Подгорбунского, Кемерово
Циррозы печени (ЦП) занимают значительное место в структуре заболеваний органов пищеварения, оставаясь крайне актуальной социально-экономической и клинико-эпидемиологической проблемой здравоохранения всех стран мира. В настоящее время в мире заболеваемость ЦП составляет около 20–40 больных на 100 тыс. населения, и этот показатель неуклонно растет [1]. Чаще всего встречаются ЦП алкогольной и вирусной этиологии.
Вирусные ЦП (в исходе хронических гепатитов В, С, В + D) составляют от 10% до 23,5% всех циррозов [2]. Доминирующее место среди всех болезней печени занимают вирусные гепатиты В, С и D, что связано с их широкой распространенностью и высоким уровнем заболеваемости [3, 4]. В США вирусный гепатит С (ВГС) в качестве причины ЦП вышел на первое место — он является причиной формирования ЦП в 26% случаев, ВГС в сочетании с алкоголем добавляет к этой статистике еще в 15% случаев, гепатит В и гепатиты В + D вызывают ЦП 15% случаев. В последние годы структура вирусных ЦП несколько изменилась: до 30,3% увеличилась доля циррозов в исходе вирусного гепатита С [5, 6]. Это согласуется с данными Европейской ассоциации по изучению печени (European Association for the Study of the Liver, EASL) (1999) о том, что ведущую роль в формировании ЦП играет хроническая инфекция ВГС, которая является причиной 40% случаев развития ЦП [7]. Особенность течения ЦП определяется, по-видимому, не только этиологическим фактором, но и другими дополнительными регулирующими механизмами, которые на настоящий момент еще не вполне изучены.
Для оценки тяжести ЦП и прогноза в течение последних почти 50 лет, с 1964 года с пересмотром-дополнением в 1973 г., используется классификация Чайлда–Пью (Чайлда–Туркотта–Пью). Эпидемиологические исследования показывают, что оценка класса по Чайлду–Пью может предсказать продолжительность жизни у пациентов с ЦП. Оценка в 10 баллов или больше связана с 50% вероятностью смерти в течение 1 года [8]. Не ясно, чем определяется выживаемость оставшихся 50%, возможно, степенью компенсаторных возможностей регуляторных систем. Следует отметить, что система оценки по Чайлду–Туркотту–Пью не является идеальной для данной группы пациентов, так как при оценке тяжести состояния больных во внимание принимаются параметры, отражающие функцию печени, но не учитываются показатели, регистрирующие функцию почек, дыхательной и сердечно-сосудистой систем. В связи с этим появились новые системы, которые являются более подходящими у данной категории больных.
С 2002 г. широко используемой системой оценки тяжести пациентов с заболеваниями печени стала шкала MELD (Model for end-stage liver disease — модель для конечной стадии заболевания печени), которая была предложена в Клинике Мэйо (США), оценка по которой варьируется от 6 до 40 баллов. Шкала применяется для прогноза летальности у пациентов с декомпенсированными ЦП. Так, было показано, что при количестве баллов по шкале MELD менее 20 трехмесячная летальность составила 27%, а при более 20 баллов — 76%. В настоящее время количество баллов по шкале MELD является приоритетным при определении неотложности трансплантации печени в США [9].
Что же определяет, кроме этиологического фактора, выживаемость пациентов с ЦП? Возможно, продолжительность жизни связана со степенью компенсаторных возможностей регуляторных систем, основой которых является функционирование вегетативной нервной системы. Вегетативная нервная система — часть нервной системы, которая управляет деятельностью внутренних органов, регулирует процессы обмена веществ, состояние тканей и органов в ходе их приспособления к текущей деятельности организма в изменяющихся условиях окружающей среды. Вегетативная нервная система регулирует сердечно-сосудистую деятельность, температуру тела, работу желудочно-кишечного тракта (атонические запоры, слабая перистальтика при симпатикотонии; гипермоторные дисфункции, спастические запоры, поносы при ваготонии), мочеиспускание, половую функцию, все виды обмена веществ, эндокринную систему, сон и др. Усиление функционирования одного отдела (например, симпатического) в нормальных физических условиях приводит к компенсаторному напряжению аппарата другого отдела (парасимпатического), возвращая функциональную систему к нормальному гомеостазу [10].
При формировании хронического заболевания печени еще до развития цирроза происходит нарушение в нейрогуморальной вегетативной регуляции, выраженное напряжение регуляторных систем с целью поддержания гомеостаза. Работ по выявлению этих изменений чрезвычайно мало [11–13]. Вегетативная дисфункция (ВД) встречается при хронических заболеваниях печени, причем проявления этого синдрома универсальны независимо от причины, вызвавшей данное заболевание. Интерес к изучению этого синдрома возрос в течение последних 15–20 лет в связи с активным проведением операций по трансплантации печени. За это время ВД получила широкое признание как осложнение ЦП, и ее стали считать одной из важных причин развития и прогрессирования основных синдромов ЦП. Патофизиология вегетативных нарушений вторична по отношению к заболеванию печени и в значительной степени не изучена. Определенную роль в развитии ВД могут играть иммунологические и метаболические нарушения, в результате снижается парасимпатическая и повышается симпатическая активность, которая частично объясняет означенные механизмы [14]. Одним из самых распространенных проявлений при ЦП является ортостатическая гипотензия (ОГ) [15], которая проявляется у 33% пациентов головокружением при ортостазе. Другие симптомы включают нечеткость зрения, дискомфорт в голове, шее или плече — головная боль, так называемый «симптом вешалки», усталость и, в тяжелых случаях, обморок [16].
Утомляемость, слабость, усталость в диапазоне от легкой усталости в повседневной жизни до выраженной слабости являются частой жалобой больных с ЦП [17]. Усталость у пациентов с заболеваниями печени может развиться в любое время, но степень выраженности этого симптома, по мнению Newton J. L. и соавт. (2008), не коррелирует с тяжестью заболевания печени [18]. Тяжесть усталости у пациентов с ЦП коррелирует с более серьезными симптомами ВД и поэтому может быть основным фактором в оценке тяжести синдрома вегетативных нарушений [19]. С другой стороны, слабость может быть и проявлением анемического синдрома, следствием нарушения сна, побочным действием лекарств (бета-блокаторы, антидепрессанты, бензодиазепины). Кроме того, у таких пациентов может снизиться толерантность к физической нагрузке, как выявили K. Cauch-Dudek и соавт. (1996) [20]. Симптомы вегетативных нарушений моторики органов пищеварения включают в себя раннее насыщение, тошноту, рвоту, боли в эпигастрии. Задержка опорожнения желудка связана с постпрандиальной гипогликемией, по данным B. Ohlsson и соавт. (2006) и поэтому может ухудшить течение ЦП [21]. Замедление перистальтики кишечника в результате вегетативной дисфункции при ЦП имеет особое значение, поскольку оно способно привести к избыточному бактериальному росту в тонкой кишке, повышению риска развития печеночной энцефалопатии и спонтанного бактериального перитонита и может быть плохим прогностическим признаком у этих пациентов [22]. Согласно исследованиям C. Kibune Nagasako и соавт. (2009), нарушения желудочно-тонкокишечной моторики наряду с дисфункцией сфинктеров толстой кишки и мочевого пузыря могут вызывать диарею, запоры и недержание мочи, которые усиливаются на фоне назначения мочегонных и слабительных препаратов. По данным V. Gomez-Lobo и соавт. (2006), у пациентов с ЦП наблюдается дисфункция мочевого пузыря [23]. Распространенность ВД может достигать 67% и повышать смертность в группе пациентов с ЦП [16, 24, 25]. Эта взаимосвязь ВД и ЦП имеет большое значение для клиницистов, работающих с пациентами с хроническими заболеваниями печени.
Изменения со стороны вегетативной нервной системы у больных циррозом печени изучались различными методами. В 1990 г. начала активно разрабатываться методика исследования вегетативных нарушений путем исследования вариабельности ритма сердца. Благодаря усилиям группы экспертов Европейского общества кардиологов (European Society of Cardiology, ESC) и Североамериканского общества электростимуляции и электрофизиологии (North American Society of Pacing and Electrophysiology, NASPE) в 1996 г. данный метод был стандартизован и сегодня широко используется во всем мире [26]. Несмотря на кажущуюся простоту проведения обследования, на выходе врач получает совокупность графиков и числовых показателей, которые являются результатом сложной математической обработки записанных кривых, проведенной специальной компьютерной программой. Эти графики и показатели позволяют оценить уровень вегетативного обеспечения, степень истощения систем внутренней регуляции, а значит, получить ответ на главный вопрос: есть ли у организма «запас прочности», готов ли он к адекватной реакции на внешние воздействия. Данная методика имеет большие потенциальные возможности и перспективы применения [27].
В настоящее время активно ведутся исследования вариабельности ритма сердца у больных с ЦП различной степени тяжести и различной этиологии, причем выявляется высокая частота встречаемости вегетативных дисфункций. Выраженность и частота дисфункций связана не с этиологией цирроза печени, а со степенью его тяжести [28]. A. Somasundaram и соавт. (2009) предложили использовать оценку вариабельности ритма сердца в качестве предиктора оценки тяжести больного с ЦП [29].
По результатам исследования F. Szalay и соавт. (1998), при HBsAg-положительных заболеваниях печени дисфункция парасимпатического отдела вегетативной нервной системы (ПВНС) встречается в 85% случаев, дисфункция симпатического отдела вегетативной нервной системы (СВНС) — в 43%; при анти-ВГС-позитивных заболеваниях печени дисфункция ПВНС наблюдается в 58% случаев, дисфункция СВНС — в 42% [30]. M. T. Hendrickse и соавт. (2006) установили, что у пациентов с хроническим заболеванием печени, отягощенным ВД, 4-летняя смертность на 30% выше по сравнению с данными для больных хроническими заболеваниями печени без вегетативной дисфункции, у которых 4-летняя смертность составляет 6%, а также выявили, что у больных первичным билиарным циррозом, которые жалуются на усталость, смертность повышается [31, 32]. J. F. Fleckenstein и соавт. (1996) сделали вывод, что вегетативная нейропатия является независимым фактором риска смертности в случаях компенсированного и декомпенсированного цирроза [33].
Таким образом, имеющиеся данные свидетельствуют о целесообразности изучения наличия и степени выраженности вегетативных дисфункций у больных ЦП. В то же время данные об особенностях объективной оценки вегетативных дисфункций при помощи анализа вариабельности ритма сердца у больных с ЦП, особенно в отечественной медицине, крайне малочисленны, что обусловило актуальность настоящего исследования.
Целью исследования было оценить частоту и выраженность синдрома вегетативной дисфункции у больных циррозом печени вирусной этиологии разной степени тяжести.
Материалы и методы исследования
Было обследовано 103 пациента с ЦП вирусной этиологии. Контрольную группу составили 35 пациентов, пол и возраст которых соответствовали аналогичным характеристикам больных в испытуемых группах. Для изучения частоты клинических проявлений, наличия и выраженности вегетативной дисфункции пациенты были разделены на 3 группы в зависимости от степени тяжести цирроза печени по критериям Чайлда–Пью. В первую группу вошли пациенты с компенсированным ЦП (класс А), оценка по критериям Чайлда–Пью составила 5–6 баллов (36 больных — 34,9%). Во вторую группу вошли пациенты с субкомпенсированным циррозом (класс B), оценка по критериям Чайлда–Пью составила 7–9 баллов (34 человека — 33%). В третью группу вошли пациенты с декомпенсированным циррозом (класс С), оценка по критериям Чайлда–Пью составила 10–15 баллов (33 человека — 32,1%).
У всех исследуемых с помощью программы «Корвег» изучалась вариабельность ритма сердца в покое и активном ортостазе. Вычислялись показатели, характеризующие активность различных звеньев вегетативной нервной системы: Мо — мода (гуморальный канал центральной регуляции сердечного ритма); АМо — амплитуда моды (центральное нервное звено симпатической регуляции); ВР — вариационный размах (автономное, парасимпатическое звено). Оценивался спектральный состав ритма сердца: ДВ — дыхательные волны (средняя мощность спектральной функции с периодом 0,15–0,35 Гц/сек2, характеризует активность автономного контура регуляции, преимущественно парасимпатических влияний), МВПП — медленные волны первого порядка (средняя мощность спектральных функций при 0,05–0,15 Гц/сек2, характеризует активность центрального контура регуляции, преимущественно симпатических влияний), МВВП — медленные волны второго порядка (средняя мощность спектральных функций при 0,004–0,05 Гц/сек2, характеризующая нарушение гуморального уровня регуляции). Вычислялись интегральные показатели (индексы), характеризующие соотношения первичных показателей: ИН — индекс напряжения (отражает степень централизации управления ритмом сердца); ИВР — индекс вегетативного равновесия (соотношение активности симпатического и парасимпатического звеньев); КОП — индекс ортостатической пробы (направленность и степень изменения функционирования вегетативной нервной системы, преимущественно симпатического ее отдела).
Различия между параметрами сравнения считались статистически различными при р ≤ 0,05. Исследование проведено в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации (World Medical Association, WMA) (в редакции 2000 г. с разъяснениями, данными на генеральной ассамблее Всемирной медицинской ассоциации в Токио, 2004 г.), с Правилами качественной клинической практики Международной конференции по гармонизации (ICH GCP), этическими принципами, изложенными в Директиве Европейского союза 2001/20/ЕС и требованиями национального российского законодательства. Протокол исследования одобрен Комитетом по этике ГБОУ ВПО КемГМА МЗ РФ; процедуры рассмотрения и одобрения исследования соответствовали требованиям национального законодательства. Каждый больной подписал «Информированное согласие» на участие в исследованиях.
Результаты и обсуждение
При опросе пациенты жаловались на слабость, быструю утомляемость, снижение работоспособности, нарушения сна в виде сонливости днем и бессонницы ночью; периодически отмечались головокружения в ортостазе. Из других вегетативных жалоб реже встречались нарушения моторики кишечника в виде чередования запоров и поносов, нарушения мочеиспускания (поллакиурия, недержание мочи). Частота встречаемости жалоб нарастала с увеличением тяжести ЦП, что отражено в табл. 1.
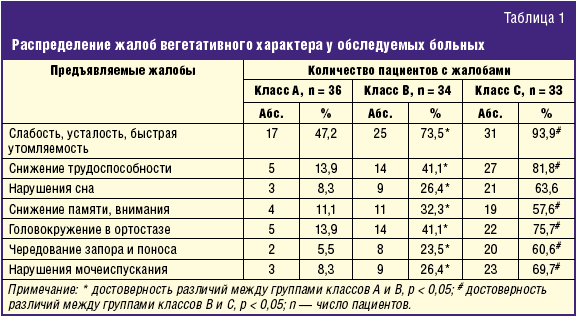
Показатели состояния системы регуляции сердечного ритма у исследуемых пациентов с ЦП подтвердили усиление симпатической активности и ослабление парасимпатической активности по всем параметрам, при этом симпатическое влияние усиливалось при нагрузке. Индексы регуляторных систем вегетативной нервной системы (индекс напряжения и индекс вегетативной регуляции) достоверно указывали на преобладание симпатикотонии в покое и в активном ортостазе. Степень напряжения регуляторных систем распределилась следующим образом: удовлетворительная адаптация (норма) в покое выявлена у 21 (58,3%) пациентов первой группы, у 16 (47%) больных второй группы, у 8 (24,2%*) человек из третьей группы и у 33 (94,2%) человек контрольной группы; состояние функционального напряжения, проявляющееся мобилизацией защитных механизмов, в том числе повышением активности симпатоадреналовой системы, регистрировалось в покое у 13 (36,1%) пациентов первой группы, у 15 (44,2%) больных второй группы, у 20 (60,7%*) человек третьей группы и только у 1 пациента (2,9%) из группы контроля. Также оценивались аналогичные показатели при нагрузке (в активном ортостазе): удовлетворительная адаптация выявлена у 21 (58,3%) пациента из первой группы, у 10 (29,4%*) больных из второй, у 4 (12,1%*) человек из третьей группы; состояние функционального напряжения отмечено у 14 (38,9%) больных из первой группы, у 21 (61,8%) пациента из второй и у 19 (57,6%*) человек из третьей группы; в третьей группе у 10 (30,3%) пациентов выявлено состояние перенапряжения, для которого характерны недостаточность адаптационных защитно-приспособительных механизмов и их неспособность обеспечить адекватную реакцию организма на воздействие различных факторов (*р ≤ 0,05 в отличие от первой группы). Сравнительные данные математического анализа сердечного ритма представлены в табл. 2.
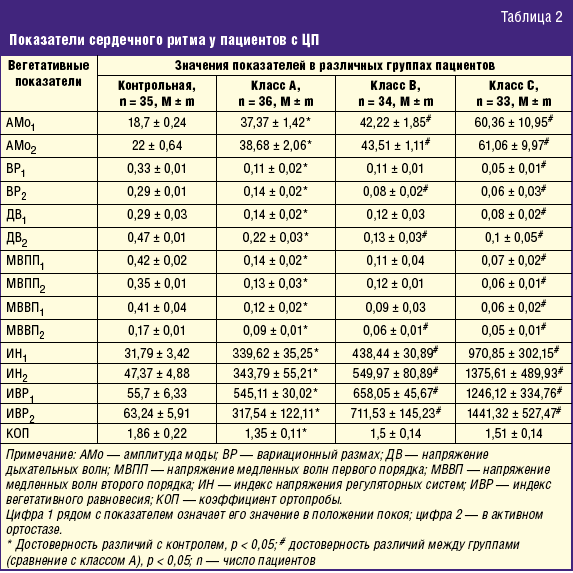
Исходный вегетативный тонус в группе контроля был ближе к умеренной (30,3%) и выраженной ваготонии (42,2%), а вегетативная реактивность недостоверно (р < 0,05) чаще была нормальной или гиперсимпатикотонической (39,4–30,3%). В группах пациентов с ЦП в классе А достоверно чаще наблюдалась эйтония (47,3%) с тенденцией к умеренной и выраженной симпатикотонии (19,5% и 25%); по мере утяжеления ЦП, у пациентов в классе В преобладает умеренная и выраженная симптикотония (26,4% и 32,4%), а в классе С — выраженная симпатикотония (84,9%).
Все обследованные пациенты получали комплексное лечение своего заболевания. В качестве базовой терапии в зависимости от показаний — лактулозу (Дюфалак, производства Эбботт Биолоджикалз Б. В., Нидерланды) 15–45 мл в сутки до достижения трехкратного мягкого стула; анаприлин 10 мг 4 раза в сутки или карведилол 12,5 мг 2 раза в сутки, L-орнитин-L-аспартат (Гепа Мерц, производства Мерц Фарма ГмбХ и Ко.КГаА., Германия) 5 мг 3 раза в сутки (при более выраженной печеночной энцефалопатии внутривенные инфузии до 40 мл в сутки); рифаксимин (Альфа Нормикс, производства Альфа-Вассерманн С.п.А, Италия); курсами по 800–1200 мг в сутки; спироналактон и фуросемид в дозах, обеспечивающих положительный диурез; по показаниям — инфузии альбумина, плазмы, эритроцитарной массы, реополиглюкина, ремаксола; кортикостероиды; пентоксифиллин; урсодезоксихолевую кислоту (Урсосан, производства ПРО.МЕД.ЦС Прага а.о., Чехия); силимарин (Легалон, производства Мадаус АГ, Германия). По показаниям некоторые пациенты получали противовирусное лечение.
Большинство пациентов, которых мы обследовали, в качестве гепатопротектора получали S-аденозил-L-метионин (препарат Гептрал производства компании Hospira, S.p.A., Италия). S-аденозил-L-метионина в гепатологии применяется главным образом в следующих областях [35]:
- острые и хронические заболевания печени, протекающие с синдромом внутрипеченочного холестаза;
- лекарственные гепатиты;
- алкогольная болезнь печени:
- жировой гепатоз;
- алкогольный гепатит;
- фиброз печени;
- цирроз печени;
- острая печеночная недостаточность.
Опыт перорального и парентерального применения S-аденозил-L-метионина, накопленный на протяжении более чем 20 лет, показал, что препарат эффективен в лечении внутрипеченочного холестаза при заболеваниях печени и беременности. До настоящего времени более 2700 пациентов с внутрипеченочным холестазом и/или хроническими заболеваниями печени принимали участие в клинических исследованиях адеметионина и 1983 из них принимали этот препарат. В большинстве этих исследований адеметионин сравнивали с плацебо ввиду практически полного отсутствия альтернативной терапии. Почти в 90% случаев холестатический компонент был связан с хроническими заболеваниями печени. Остальные пациенты были с алкогольным поражением печени, острым и хроническим гепатитом или внутрипеченочным холестазом беременных. Параметры эффективности, которые использовались в клинических исследованиях, включали основные субъективные симптомы холестаза (зуд, желтуха, утомляемость), биохимические маркеры холестаза и повреждения печени, такие как общий и конъюгированный билирубин, щелочная фосфатаза, желчные соли, трансаминазы, гамма-глутамилтрансфераза. При внутривенном, внутримышечном или пероральном применении адеметионина уменьшалась выраженность проявления внутрипеченочного холестаза при хронических заболеваниях печени, холестазе беременных и алкогольном ЦП. Эффективность внутривенного или внутримышечного введения адеметионина проявляется через 1–2 недели терапии, тогда как назначение адеметионина перорально подходит для поддерживающей терапии [35].
В продолжительном двойном слепом плацебо-контролируемом исследовании при участии 123 мужчин и женщин с алкогольным циррозом печени было выявлено, что применение адеметионина в дозе 1200 мг/сут на протяжении 2 лет может улучшать выживаемость и удлинять период до необходимости трансплантации печени эффективнее, чем плацебо [36]. В целом смертность или необходимость трансплантации печени в конце исследования уменьшилась с 30% в группе плацебо до 16% в группе адеметионина, хотя различие было статистически не значимо. Продолжительное применение адеметионина уменьшает смертность или необходимость трансплантации печени, особенно у больных с менее выраженным заболеванием печени.
В результате лечения S-аденозил-L-метионином нормализуется текучесть (проницаемость) клеточных мембран, повышается активность Na+/K+-АТФазы, увеличивается энергетический потенциал клетки и таким образом улучшается захват компонентов желчи из крови, их внутриклеточный транспорт и выделение в канальцы. В клетках увеличивается синтез и содержание тиолов (глутатиона, таурина, сульфатов), которые обладают защитным действием от цитотоксического эффекта свободных радикалов, желчных кислот и других токсических компонентов, поступающих или образующихся в гепатоците, в том числе и биологических субстанций, ответственных за появление кожного зуда [37, 38].
Основными показаниями для назначения S-аденозил-L-метионина является гепатоцеллюлярный и/или каналикулярный холестаз, в механизме которого ведущая роль принадлежит следующим факторам:
1) снижению текучести (проницаемости) базолатеральной и/или каналикулярной мембраны гепатоцитов в результате алкогольных и лекарственных поражений печени, а также при беременности;
2) ингибированию Na+/K+-АТФазы и других мембранных переносчиков при токсических воздействиях на печень (лекарства, бактериальные субстанции, эндотоксины, например, при сепсисе);
3) нарушению целостности цитоскелета, включая каналикулы с блокадой внутриклеточного и каналикулярного транспорта компонентов желчи при острых и хронических гепатитах и циррозах печени различного генеза, при сепсисе, при возвратном (доброкачественном) внутрипеченочном холестазе, при эндотоксемии, при использовании пероральных контрацептивов [39, 40].
Эффективность S-аденозил-L-метионина в лечении холестатических заболеваний печени, в основе которых лежат аутоиммунные повреждения эпителия билиарных протоков с их некрозами и облитерацией (первичный билиарный цирроз, первичный склерозирующий и аутоиммунный холангит, идиопатическая дуктопения, склерозирующий холангит после трансплантации печени и др.), оценивается неоднозначно. Если на ранней стадии первичного билиарного цирроза ряд авторов отмечали положительный эффект от назначения препарата (уменьшение зуда, снижение активности щелочной фосфатазы), то при развернутой картине болезни наблюдалось лишь кратковременное улучшение [41].
S-аденозил-L-метионин (Гептрал) нашим пациентам мы назначали вначале парентерально по 800 мг внутривенно или внутримышечно в течение 10–14 дней, а затем по 400 мг (1 таблетка) 2 раза в день. Продолжительность курса лечения составляла в среднем 1–2 месяца.
Выводы
Показатели состояния системы регуляции — частотный, спектральный анализ ритма сердца — у исследуемых пациентов с ЦП подтвердили усиление симпатической активности и ослабление парасимпатической активности по всем параметрам, степень выраженности которых у больных нарастала от класса А к классу С, при этом симпатическое влияние усиливалось при нагрузке. Исходя из вышеизложенного, возникает необходимость раннего выявления и коррекции вегетативных нарушений у исследуемых групп больных. В качестве основного гепатопротектора мы рекомендуем назначать S-аденозил-L-метионин (Гептрал).
Литература
- WHOSIS (WHO Statistical Information System) [web site]. Geneva. World Health Organization. 2008. http://www.who.int/whosis/en/, accessed 23 April 2008.
- Подымова С. Д. Болезни печени. Рук-во для врачей. М: Медицина, 2005.
- Губергриц Н. Б. Хронические гепатиты и циррозы печени. Современная классификация, диагностика и лечение. М.: Медпрактика, 2010. 328 c.
- Ющук Н. Д., Климова Е. А., Знойко О. О. и соавт. Протокол диагностики и лечения больных вирусными гепатитами В и С // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2010. № 6. Т. ХХ. С. 4–60.
- Строганова О. А., Бессонова Е. Н., Лесняк О. М. Этиологическая структура цирроза печени и ее динамика за период 1999–2009 гг. по данным Свердловского областного гепатологического центра // Уральский медицинский журнал. 2010. № 1. С. 18–22.
- Бобров А. Н., Белякин С. А., Плюснин С. В. Этиологическая структура циррозов печени по результатам пятнадцатилетнего наблюдения // Вестник военно-медицинской академии. 2011. Т. 1. С. 76–80.
- Marsellin P. Hepatitis C: The clinical spectrum of the disease // J. Hepatology. 1999. V. 31 (Suppl. 1). P. 9–16.
- Pugh R. N. H., Murray-Lyon Im., Dawson J. L. et al. Transection of the esophagus in bleeding esophageal varices // Br. J. Surg. 1973. V. 60. Р. 648–652.
- Sen S., Williams R., Jalan R. The pathofhysiological basis of acute-on-chronic liver failure // Liver. 2002. 22 (Suppl. 2): 5–13.
- Вегетативные расстройства. Клиника. Диагностика. Лечение. Под ред. А. М. Вейна. М.: Медицинское информационное агентство, 2003. 750 с.
- Мехтиева О. А. Особенности состояния сердечно-сосудистой системы у больных хроническим гепатитом в зависимости от стадии заболевания и степени портальной гипертензии. Автореф. дисс. … канд. мед. наук. СПб, 2002. 246 с.
- Ильмухина Л. В., Киселева Л. М. Функциональное состояние вегетативной нервной системы при хроническом вирусном гепатите В // Сибирский медицинский журнал. 2008. № 7. С. 32–35.
- Ионцев В. И. Особенности регуляции функциональной системы кровообращения при хирургической коррекции портальной гипертензии у больных циррозом печени. Автореферат дис. … канд. мед. наук. СПб, 2011.
- Frith J., Julia L. Newton. Autonomic Dysfunction in Chronic Liver Disease: Investigating the Autonomic Nervous System // Liver International. 2009. V. 29 (4). Р. 483–489.
- Chaudhry V., Corse A. M., O’Brian R. et al. Autonomic and peripheral (sensorimotor) neuropathy in chronic liver disease: a clinical and electrophysiologic study // Hepatology. 1999. V. 29. Р. 1698–1703.
- Thuluvath P. J., Triger D. R. Autonomic neuropathy and chronic liver disease // Q J Med. 1989. V. 72. Р. 737–747.
- Newton J. L., Pairman K. W., David E. J. Fatigue and autonomic dysfunction in non-alcoholic fatty liver disease // Autonomic Research. 2009. V. 19. V. 6. Р. 319–326.
- Newton J. L., Jones D. E., Henderson E. et al. Fatigue in non-alcoholic fatty liver disease (NAFLD) is significant and associates with inactivity and excessive daytime sleepiness but not with liver disease severity or insulin resistance // Gut. 2008. V. 57. Р. 807–813.
- Newton J. L., Davidson A., Kerr S. et al. Autonomic dysfunction in primary biliary cirrhosis correlates with fatigue severity // Eur J Gastroenterol Hepatol. 2007. V. 19. Р. 125–132.
- Cauch-Dudek K., Abbey S., Stewart D. E. et al. Fatigue in primary biliary cirrhosis // Gut. 1998. V. 43. Р. 705–710.
- Ohlsson B., Melander O., Thorsson O. et al. Oesophageal dysmotility, delayed gastric emptying and autonomic neuropathy correlate to disturbed glucose homeostasis // Diabetologia. 2006. V. 49. Р. 2010–2014.
- Kibune Nagasako C., de Oliveira Figueiredo M. J., de Souza J. R. et al. Almedia Investigation of Autonomic Function and Orocecal Transit Time in Patients With Nonalcoholic Cirrhosis and the Potential Influence of These Factors on Disease Outcome // Journal Title Journal of clinical gastroenterology. Source. 2009. V. 43. № 9. P. 884–889.
- Gomez-Lobo V., Burgansky A., Kim-Schluger L. et al. Gynecologic symptoms and sexual function before and after liver transplantation // J. Med. Reprod. 2006. V. 51. Р. 457–462.
- Fleckenstein J. F., Frank S., Thuluvath P. J. et al. Presence of autonomic neuropathy is a poor prognostic indicator in patients with advanced liver disease // Hepatology. 1996. V. 23. Р. 471–475.
- Bichet D. G., Van Putten V. J., Schrier R. W. Potential role of increased sympathetic activity in impaired sodium and water excretion in cirrhosis // The New England Journal of Medicine. 1982. V. 307 (25). Р. 1552–1557.
- Vybiral T., Bryg R. J., Maddens M. E., Boden W. E. Effect of passive tilt on sympathetic and parasympathetic components of heart rate variability in normal subjects // The American Journal of Cardiology. 1989. V. 63 (15). Р. 1117–1120.
- Dillon J. F., Plevris J. N., Nolan J. et al. Autonomic function in cirrhosis assessed by cardiovascular reflex tests and 24-hour heart rate variability // The American Journal of Gastroenterology. 1994. V. 89 (9). Р. 1544–1547.
- Bajaj B. K., Agarwal M. P., Krishna Ram B. et al. Autonomic neuropathy in patients with hepatic cirrhosis // Postgrad. Med. J. 2003. V. 79. Р. 408–411.
- Somasundaram A., Muralikrishnan K., Varghese J. Heart rate variability as a predictor of severity in cirrhosis liver. Stanley Medical College, Chennai, India. www.pulsus.com/cddw2009/abs/059.htm Search CDDW 2009 Abstracts.
- Szalay F., Marton A., Keresztes K. et al. Neuropathy as an extrahepatic manifestation of chronic liver diseases // Scand. J. Gastroenterol. 1998. V. 228 (Suppl.). Р. 130–132.
- Hendrickse M. T., Thuluvath P. J., Triger D. R. et al. Natural history of autonomic neuropathy in chronic liver disease [see comment] // Lancet. 1992. V. 339. Р. 1462–1464.
- Jones D. E., Bhala N., Burt J. et al. Four year follow up of fatigue in a geographically defined primary biliary cirrhosis patient cohort [see comment] // Gut. 2006. V. 55. 536–541.
- Fleckenstein J. F., Frank S., Thuluvath P. J. et al. Presence of autonomic neuropathy is a poor prognostic indicator in patients with advanced liver disease // Hepatology. 1996. V. 23. Р. 471–475.
- Подымова С. Д. Адеметионин: фармакологические эффекты и клиническое применение препарата // РМЖ. 2010. № 13.
- Avila M. A., Garcia-Trevijano E. R., Martinez-Chantar M. L., Latasa M. U., Perez-Mato I., Martinez-Cruz L. A., del Pino M. M., Corrales F. J., Mato J. M. S-Adenosylmethionine revisited: it`s essential role in the regulation of liver function // Alcohol. 2002. Jul. 27 (3). Р. 163–167.
- Mato J. M., Carama J., Fernandez de Pas J. S-adenosylmethionine in alcogolic liver cirrhosis: a randomized placebo–controlled, double-bind multicenter clinical trial // Hepatology. 1999. V. 30. P. 1081–1089.
- Lieber C. S. Role of S-adenosyl-L-metheonine in the treatment of liver diseases // J. Нepatology. 1999. V. 30. № 6. Р. 1155–1159.
- Osman E., Owen J. S., Burroughs A. K. Review article: S-Adenosyl-L-Methionine — a new therapeutic agent in liver disease? // Aliment. Pharmacol. Ther. 1993. Vol. 7. P. 21–28.
- Catalino F., Scarponi S., Cesa F. et al. Efficacy and safety of intravenosus S-denosyl-L-Methionine therapy in the management of intrahepatic cholestasis of pregnancy // Drug Invest. 1992. V. 4. Suppl. 4. P. 78–82.
- Frezza M., Terpin M. The use of S-adenosyl-L-methionine in the treatment of cholestasis disorders. A meta–analysis of clinical trials // Drug Invest. 1992. V. 4. Suppl. 4. P. 101–108.
- Shelly C. L. U. Methionine adenosyltransferase and liver diseases: it’s all about SAM // Gastroenterol. 1998. V. 114. № 2. P. 403–407.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru






