Содержание статьи
Методы медикаментозной коррекции состояния глазной поверхности при вирусных заболеваниях глаз
М. А. Ковалевская*, доктор медицинских наук, профессор
М. И. Сергеева*, **
И. В. Черникова**
Е. А. Ныркова***
*ГБОУ ВПО ВГМА им. Н. Н. Бурденко Минздравсоцразвития России,
**Глазной центр «Взгляд доктора Черниковой»,
***Областная клиническая офтальмологическая больница, Воронеж
Активизации вирусов способствуют любые «стрессовые» ситуации: лихорадочные заболевания, микротравмы роговицы, переохлаждение, перегревание, фоторефрактивная кератэктомия, лазерная коррекция зрения LASIK (акроним Laser-Assisted in Situ Keratomileusis — «лазерный кератомилез»), хирургия катаракты, лазерная иридэктомия, антиглаукоматозные средства. Хороший эффект в лечении вирусной инфекции (ВИ) дают комбинированные методы, которые сочетают действие иммунного агента и слезозаместителя. Этот эффект обоснован возможностью влияния слезозаместителя не только на качество слезной пленки, но и на эпителизацию дефектов роговицы. При этом, безусловно, не все фармакологические агенты равноценны в кератопротективном действии, их назначение часто диктуется информационной агрессией и/или ценой препарата. В нашем исследовании мы решили выделить необходимые блоки в комбинированном лечении вирусных заболеваний глаз.
Цель работы. Провести сравнительный анализ клинических проявлений в группе больных ВИ в зависимости от давности заболевания: до 1 месяца, более 1 месяца, рецидивирующее течение — 5 и более лет и эффективности патогенетической терапии.
Материал и методы. Три группы пациентов в зависимости от клинических проявлений инфекции: 1-я группа — 69 пациентов с кератоконъюнктивитом вирусной этиологии (герпетический — 10, аденовирусный — 59 пациентов), 2-я группа — 70 пациентов с поверхностным герпетическим кератитом, 3-я группа — 30 пациентов с глубоким язвенным кератитом вирусной этиологии. Мазки по Граму, оценка количества эозинофилов по методу Романовского, цитология офтальмогерпеса, методы прямой иммунофлюоресценции и полимеразной цепной реакции. Диагностика сухого глаза и состояния роговицы (LIPCOF-тест (Lid Parallel Conjunctival Fold), проба Норна, окраска роговицы) [3–5, 7–10].
Проводилась регистрация рН отделяемого конъюнктивальной полости при вирусных заболеваниях с учетом их давности, вида и длительности терапии, характера осложнений путем непрерывной электрохимической регистрации рН портативным рН-метром/милливольтметром/термометром НI 8314 с помощью стеклянного электрода НI 1083 В фирмы Hanna instruments, Швейцария.
Результаты
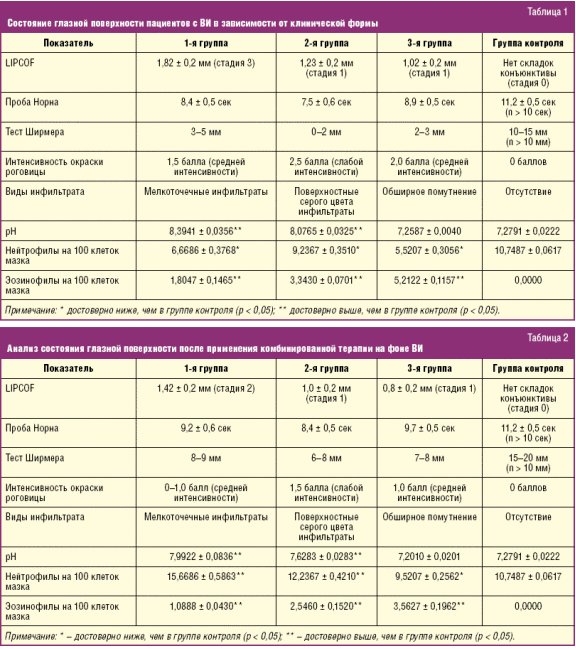
Состояние слезопродукции и качества слезы документировано пробами LIPCOF, Норна и Ширмера. Наиболее выражены изменения во 2-й группе, где имеются интенсивные повреждения роговицы (табл. 1). В 3-й группе, несмотря на тяжесть заболевания, поверхностные механизмы воспаления выражены слабо и на первый план выходит воспаление стромы. Таким образом, именно 2-я и 3-я группы лидируют по механизму вовлечения в процесс роговицы.
Нами разработан селективный алгоритм терапии ВИ глаз в зависимости от клинической формы заболевания. Для общей комбинированной терапии 1-й группы пациентов мы использовали валацикловир (Валтрекс), который имеет биодоступность более 50% и действует на ацикловирустойчивые штаммы вируса. Для местного лечения кератоконъюнктивита (1-я группа пациентов) мы использовали два блока. Первый блок связан с форсированным местным применением препаратов противовирусного действия с расширенным спектром активности. Данная группа препаратов представлена Офтальмофероном — единственной стабильной формой рекомбинантного полусинтетического интерферона для локального применения в офтальмологии. Второй блок представлен слезозаместительной терапией в сочетании с кератопротекторами: препаратом, содержащим гидроксипропилгуар для быстрейшего восстановления стабильности слезной пленки и карбомером перед сном для гидрофильной подушки в ночное время (Корнерегель).
Во 2-й группе, где клинические проявления повреждения роговицы заключались в монетовидных инфильтратах или древовидном герпетическом кератите, мы использовали препарат инозин пранобекса (Изопринозин), который способствовал ингибиции пенетрации вируса. Во 2-й группе, учитывая тяжесть повреждения роговицы в подгруппе древовидного вирусного кератита и возможности его перехода в глубокую форму, мы с успехом применяли комбинацию Изопринозина и Панавира. Отличием Панавира является наличие гексозного гликозида и возможность его действия на весь жизненный цикл развития ВИ: слияние, транскрипцию, интеграцию, репликацию, отпочкование вируса герпеса. Он обладает цитопротективным действием, защищая клетки от воздействия вирусов, ингибирует синтез вирусных белков и способствует торможению репликации вирусов в инфицированных культурах клеток, приводит к существенному снижению инфекционной активности вирусов, повышает жизнеспособность инфицированных клеток, индуцирует синтез интерферона в организме, эффективен в отношении различных ДНК- и РНК-содержащих вирусов [1, 2]. Курс применения Панавира заключается в 5–10 внутривенных инъекциях по 5 мл. Препарат может использоваться в комбинированной терапии офтальмогерпеса при любых клинических формах. Для местного лечения поверхностного кератита (2-я группа) мы использовали Офтальмоферон и слезозаместители по рекомендуемой нами схеме, описанной при обосновании терапии 1-й группы.
3-я группа наиболее сложная в клиническом отношении и связана с казалось бы несочетаемыми комбинациями. Для общего лечения мы использовали Панавир по рекомендуемой нами схеме и фамцикловир (Фамвир), который после приема внутрь превращается в пенцикловир, подавляющий синтез вирусной ДНК и репликацию вирусов. Местное лечение было идентичным в 1-й, 2-й и 3-й группах.
При наличии стромального инфильтрата роговицы и повреждении стромы однократно использовались стероиды ретробульбарно под контролем состояния роговицы, что требовало сопровождения препаратами расширенной противовирусной активности. Мы применяли с этой целью курс лечения препаратом Панавир.
Нами проведена сравнительная оценка состояния глазной поверхности в трех клинических группах пациентов: с вирусным кератоконъюнктивитом, поверхностным и глубоким кератитом с использованием предлагаемого нами комбинированного метода лечения.
Мы выполнили анализ состояния глазной поверхности после применения комбинированной терапии на фоне ВИ (табл. 2).
Блок слезозаместительной терапии позволил нормализовать слезопродукцию у пациентов 1-й группы, при этом проба Норна продемонстрировала наилучший результат при глубоком кератите, где поверхностные механизмы воспаления играли второстепенную роль (табл. 2). Положительным можно считать уменьшение прокраски витальными красителями инфильтрата роговицы во 2-й группе или его полную эпителизацию.
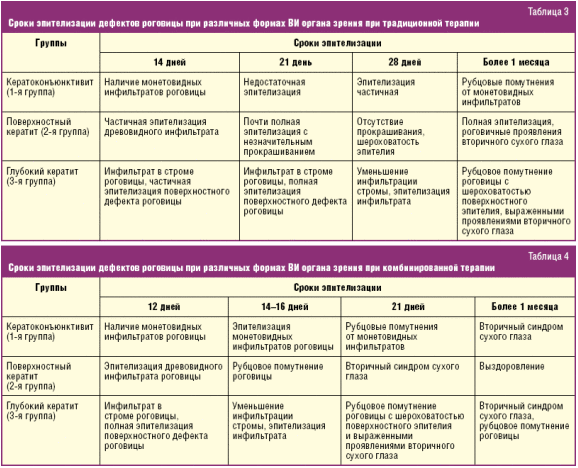
При всех формах ВИ органа зрения наблюдалась эпителизация инфильтратов в среднем на 10–14 дней раньше при использовании предложенной нами комбинированной терапии по сравнению с традиционной (табл. 3, 4).
Выводы
Монотерапию ВИ нельзя считать эффективной, т. к. она не может воздействовать на всю «мозаичную» структуру разнопланового жизненного цикла возбудителя инфекции органа зрения. Не случайно повреждение роговицы является следствием эндогенной генерализованной персистенции вируса. В то же время глаз является забарьерным органом и общую терапию даже самыми современными средствами нельзя считать исчерпывающей, что прекрасно показало исследование HEDS [6]. Мы предлагаем, ориентируясь на клиническую форму, т. е. на объем и глубину повреждения глазной поверхности, применять определенное комбинированное общее лечение: при кератоконъюнктивите — Валтрекс, при поверхностном кератите — Изопринозин, в тяжелых случаях Панавир, при глубоком кератите — Панавир. Что же касается местной терапии, то здесь с небольшим перевесом по частоте применения можно назвать комбинации лекарственных препаратов неизменными.
Литература
- Скрипкина П. А. Роль герпесвирусной инфекции в патогенезе атопического дерматита. Автореф. дис. канд. мед. наук. М., 2008. 23 с.
- Чернова Н. И., Волкова Е. Н. Герпетическая инфекция: клиника, диагностика, лечение. Методические рекомендации № 38. М., 2009. 14 с.
- Abelson M., Ousler G., Nally L. Alternate reference values for tear film break-up time in normal and dry eye populations // Adv Exp Med Biol. 2002. Vol. 506 (Part B). P. 1121–1125.
- Bron A. J., Evans V. E., Smith J. A. Grading of corneal and conjunctival staining in the context of other dry eye tests // Cornea. 2003. Vol. 22, № 7. P. 640–650.
- Hoh H., Schirra F., Kienecker C., Ruprecht K. W. Lid-parallel conjunctival folds (LIPCOF): a definite diagnostic sign of dry eye // Ophthalmologe. 1995. Vol. 92. P. 802–808.
- Herpetic Eye Disease Study Group. Oral acyclovir for herpes simplex virus eye disease: effect on prevention of epithelial keratitis and stromal keratitis // Arch Ophthalmol. 2000. Vol. 118. P. 1030–1036.
- Lemp M. A., Dohlman C. H., Holly F. J. Corneal desiccation despite normal tear volume // Ann Ophthalmol. 1970. Vol. 284. P. 258–261.
- Marquardt R., Stodtmeiser R., Christ T. Modification of tear film break-up time test for increased reliability. In: Holly F. J. ed. The Preocular Tear Film in Health, Disease and Contact Lens Wear. Lubbock, Texas: Dry Eye Institute. 1986. P. 57–63.
- Meller D., Tseng S. C. G. Conjunctivochalasis: Literature review and possible pathophysiology // Surv Ophthalmol. 1998. Vol. 43. P. 225–232.
- Miller W. L., Narayanan S., Jackson J., Bergmanson J. The association of bulbar conjunctival folds with other clinical findings in normal and moderate dry eye subjects // Optometry. 2003. Vol. 74, № 9. P. 576–582.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru