Метаболическая кардиопротекция мельдонием при ишемической болезни сердца: итоги и перспективы
М. Е. Стаценко, доктор медицинских наук, профессор
С. В. Туркина, кандидат медицинских наук, доцент
ГБОУ ВПО ВолгГМУ Минздравсоцразвития России, Волгоград
С середины прошлого века сердечно-сосудистые заболевания (ССЗ) остаются ведущей причиной смертности во всем мире [1]. По данным Всемирной Организации Здравоохранения, ежегодно от ССЗ в мире умирают около 17 млн человек. В России частота преждевременной смертности от ишемической болезни сердца (ИБС) одна из самых высоких в Европе, что связано с ее высокой распространенностью: среди всего населения 13,5 ± 0,1%, среди мужчин — 14,3 ± 0,3%, среди женщин — 13,0 ± 0,2% [2].
В настоящее время лечение ИБС базируется на использовании препаратов, обеспечивающих улучшение прогноза, предупреждение развития инфаркта миокарда, внезапной коронарной смерти и сердечной недостаточности, и для реализации данной цели применяются антитромбоцитарные средства, статины, бета-адреноблокаторы (БАБ), ингибиторы ангиотензинпревращающего фермента (ИАПФ), нитраты, антагонисты кальция. Однако применение препаратов гемодинамического и нейрогормонального действия, обеспечивающих оптимизацию соотношения между потребностями сердечной мышцы в кислороде и его доставкой, не обеспечивает достаточного удовлетворения в реальной клинической практике. Это может быть связано с тем, что возможности терапии по этим направлениям ограничены условиями функционирования миокарда при ишемии, наличием других адаптационно-дезадаптационных процессов, оказывающих существенное влияние на кардиомиоциты (КМЦ) и миокард в целом, а также коморбидностью клинических ситуаций (метаболический синдром, сахарный диабет 2-го типа, артериальная гипертензия и т. д.). Кроме того, для этих препаратов характерны многочисленные побочные эффекты, являющиеся, по сути, продолжением их основного терапевтически желательного воздействия на сердечно-сосудистую систему и, в ряде случаев, существенно ограничивающие их применение [3].
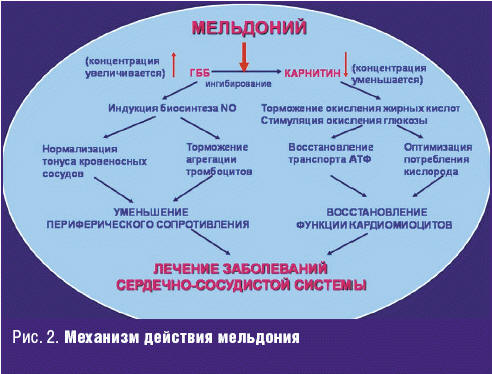
Понимание того, что ИБС (на биохимическом уровне) представляет собой несоответствие уровня потребления миокардом кислорода (субстрат окислительного фосфорилирования для образования АТФ) объему его доставки коронарным кровотоком, а также нарушением бета-окисления свободных жирных кислот (СЖК) в митохондриях кардиомиоцитов с накоплением в митохондриях недоокисленных продуктов — ацилкарнитина и ацилкоэнзима А — ацетил-КоА (рис. 1), а также сущности изменений, происходящих в метаболизме КМЦ при гипоксии, формированием новых представлений о патогенезе ИБС, описание новых адаптационных ишемических синдромов («оглушенность, гибернация и прекондиционирование миокарда», «метаболическое ремоделирование» (термин предложен М. van Bilsen и соавт. в 2004 году [4] для обозначения патологических изменений, опосредованных избытком активации жирных кислот в кардиомиоците)), открыло возможность для нового направления медикаментозного воздействия на ишемизированный миокард — миокардиальную цитопротекцию (МЦ).
Идеология метаболической кардиопротекции сложилась достаточно давно. Известно большое количество миокардиальных цитопротекторов, относящихся к препаратам различных химических классов, действие которых не связано с гемодинамическими эффектами, а опосредуется оптимизацией процессов образования и расхода энергии, коррекцией функции дыхательной цепи, нормализацией баланса между интенсивностью процессов свободно-радикального окисления и антиоксидантной защитой, непосредственным влиянием на кардиомиоциты. Это способствует их выживаемости в условиях ишемии, препятствует формированию «метаболического ремоделирования миокарда». К сожалению, многие из используемых средств не прошли проверку временем (аденозинтрифосфорная кислота, рибоксин, глюкоза и т. д.), что было связано с отсутствием достаточных знаний о механизмах энергетического баланса клетки в норме и в условиях ишемии.
Высокий возросший интерес к этой группе препаратов был продемонстрирован на Европейском конгрессе кардиологов в 2011 году в Париже, где было подчеркнуто, что атеросклеротическое поражение сердца не является единственным фактором, вызывающим ишемию, и более 50% инфарктов миокарда регистрируется у пациентов, не имеющих критический стеноз. В связи с этим был предложен альтернативный, «революционный» («Революция Коперника») подход к лечению пациентов с ИБС: сделать акцент на кардиомиоците как основной мишени ишемии, а не на коронарной артерии. В связи с этим выбрать стратегию защиты КМЦ от ишемического повреждения независимо от причинного механизма, так как достаточное насыщение кислородом для миокарда является важнейшим условием для продуцирования энергии, необходимой для его нормального функционирования [5]. В физиологических условиях 10% АТФ образуется при окислительном фосфорилировании в митохондриях за счет аэробного гликолиза (расщепление глюкозы до пирувата). Восполнение остального количества энергии для функционирования КМЦ при нормальном кислородном обеспечении происходит за счет окисления СЖК, распад которых при окислительном фосфорилировании обеспечивает синтез АТФ до 80%. Однако СЖК по сравнению с глюкозой — менее эффективный источник АТФ — «топливо» для сердца-насоса, так как при их окислении на выработку одного и того же количества АТФ требуется О2 на 10% больше. Выраженный дисбаланс между потребностью кислорода при окислении глюкозы и СЖК в сторону последних приводит к тому, что при ишемии в митохондриях КМЦ накапливается большое количество недоокисленных активных форм CЖК, что еще больше усугубляет разобщение окислительного фосфорилирования, опосредует накопление свободных радикалов, формирование внутриклеточного ацидоза, увеличение проницаемости клеточных мембран, высвобождение внутриклеточных ферментов, накопление ионов кальция и, как следствие, нарушение сократимости сердечной мышцы [5]. Если ишемия сохраняется более продолжительное время, то наступает повреждение митохондриальных мембран, активизация лизосомальных ферментов и как следствие гибель КМЦ. Поэтому в качестве метаболической кардиопротективной терапии у больных с ИБС, прежде всего, показаны средства, блокирующие парциальное окисление свободных жирных кислот (СЖК), — p-FOX-ингибиторы (partial fatty and oxidation inhibitors).
Мельдоний — 3-(2,2,2-триметилгидразиний) пропионат (Кардионат®, Милдронат) уменьшает интенсивность бета-окисления свободных жирных кислот посредством предотвращения поступления их в митохондрии: ограничивает транспорт через мембраны митохондрий только длинноцепочечных жирных кислот, в то время как короткоцепочечные могут свободно проникать в митохондрии и окисляться там, при этом не происходит накопления недоокисленных жирных кислот внутри митохондрий [6]. Это выгодно отличает мельдоний от триметазидина, который, являясь прямым ингибитором бета-окисления СЖК, тормозит в митохондриях бета-окисление длинноцепочечных и короткоцепочечных жирных кислот, блокируя последнюю реакцию 4-стадийного процесса окисления СЖК (3-кетоацил-КоА-тиолазу) [7], что не мешает накоплению активированных жирных кислот в митохондриях и неизбежному накоплению их недоокисленных форм внутри них. Являясь одним из сильнейших обратимых ингибиторов гамма-бутиробетаингидроксилазы, которая катализирует конверсию гамма-бутиробетаина в карнитин, мельдоний тем самым снижает карнитин-зависимый транспорт жирных кислот в митохондрии мышечной ткани. Это означает, что он практически не способен оказывать токсическое действие на дыхание митохондрий, так как блокирует окисление не всех жирных кислот [8].
Установлены и другие положительные эффекты мельдония, и, прежде всего, антиоксидантный. Мельдоний уменьшает интенсивность перекисного окисления липидов и повышает активность эндогенных антиоксидантов, нивелируя последствия окислительного стресса [9].
В эксперименте и клинике показано, что мельдоний способен оказывать положительное влияние на дисфункцию эндотелия [10–12] и, соответственно, приводить к нормализации сосудистого тонуса. Рассматривается и иной механизм повышения биодоступности оксида азота на фоне применения мельдония — уменьшение интенсивности его свободно-радикальной инактивации [13]. Помимо того, он проявляет и другие сосудистые эффекты: уменьшает периферическое сопротивление сосудов, устраняет вазоспазм, вызванный адреналином и ангиотензином [8, 14]. Препарат обладает целым рядом плейотропных эффектов: повышает чувствительность к инсулину, изменяет метаболизм глюкозы и липидов [15].
Высокая антиишемическая эффективность мельдония продемонстрирована в целом ряде исследований последних лет при стенокардии (исследования MILSS, MILSS I, MILSS II) [16–18], инфаркте миокарда [19], отмечено его положительное действие на толерантность к физической нагрузке, уменьшение клинических проявлений стенокардии, снижение потребления нитратов [20, 21], в том числе у пожилых пациентов [22]. Продемонстрирована целесообразность применения мельдония в комбинированной терапии как систолической, так и диастолической хронической сердечной недостаточности [23].
В нашей клинике имеется достаточный опыт по использованию препарата Кардионат® в дозе 1000 мг в клинически сложных ситуациях, а именно у больных с хронической сердечной недостаточностью (ХСН) ишемического генеза в сочетании с метаболическим синдромом (МС) [24]. Препарат Кардионат® назначался в суточной дозе 1000 мг в составе комбинированной терапии ХСН пациентам в возрасте 45–65 лет, ХСН II–III функционального класса по классификации ОССН (2002), перенесшим инфаркт миокарда в течение 16 недель. Полученные нами данные продемонстрировали, что препарат Кардионат® в составе комбинированной терапии больных с ХСН и МС способствует улучшению структурно-функциональных параметров сердца, уменьшению доли пациентов с концентрическим ремоделированием левого желудочка (ЛЖ) и эксцентрической гипертрофией ЛЖ, более частым выявлением нормальной геометрии ЛЖ, а также увеличением доли больных с I стадией диастолической дисфункции (ДД) за счет снижения количества больных со II и III стадиями. Установлено, что дополнительный прием препарата Кардионат® способствует улучшению нарушенной автономной регуляции сердца за счет снижения гиперсимпатикотонии и уменьшения индекса напряжения регуляторных систем. Полученные нами результаты согласуются с экспериментальными данными, полученными Артюшковой Е. В. (2009) [25] и свидетельствующими о том, что введение препарата Кардионат® предотвращает повышение адренореактивности и исчерпание миокардиального резерва в ходе проведения нагрузочных проб. Применение препарата Кардионат® в составе комбинированной терапии больных с ХСН и МС сопровождается антиангинальным эффектом, субъективным и объективным улучшением клинического состояния и качества жизни больных. В проведенном нами исследовании выявлено, что включение в состав комбинированной терапии ХСН и МС препарата Кардионат® сопровождалось положительным влиянием на функциональное состояние почек: в группе больных, получавших Кардионат®, отмечено более заметное снижение уровня микроальбуминурии, уменьшение количества больных с истощенным функциональным почечным резервом и клинически значимым снижением скорости клубочковой фильтрации. По-видимому, Кардионат®, увеличивая синтез гамма-бутиробетаина (ГББ), обладает вазодилатирующими свойствами, способствует улучшению кровоснабжения почек, восстановлению нарушенной внутриклубочковой гемодинамики. Кроме того, по нашему мнению, отмеченное положительное действие препарата может быть опосредовано его положительным влиянием на углеводный и липидный обмен, инсулинорезистентность, что обосновывает патогенетичность и целесообразность использования препарата Кардионат® в лечении пациентов с ишемической болезнью сердца в сложных коморбидных ситуациях, в частности, у пациентов с нарушениями углеводного и липидного обмена (метаболический синдром, сахарный диабет 2-го типа), что позволяет усиливать антиишемический эффект в органах-мишенях, обеспечивая тем самым лучшее качество жизни [15, 24]. Проведенные до настоящего времени исследования показали целесообразность его включения в комплексное лечение диабетической ретинопатии [26], положительное влияние на течение диабетической нефропатии, нейропатии [27], мнестические функции и качество жизни у пациентов с артериальной гипертензией пожилого возраста [28], в остром периоде инсульта и после перенесенного инсульта [29], при заболеваниях периферических артерий [30].
Таким образом, концепция использования миокардиальных цитопротекторов — препаратов, эффективно воздействующих на энергетический обмен кардиомиоцита и позволяющих улучшить эффективность утилизации кислорода миокардом в условиях ишемии, позволяет предполагать возможность не только эффективного, но и патогенетического их воздействия не только у пациентов с ишемической болезнью сердца [31] (рис. 2), но и в сложных коморбидных ситуациях, с которыми сталкивается врач-клиницист в реальной клинической практике.
Литература
- World Health Organization. The World Health Report 2003: Shaping the Future 2003.
- Шальнова С. А., Деев А. Д. Ишемическая болезнь сердца в России: распространенность и лечение (по данным клинико-эпидемиологических исследований) // Терапевтический архив. 2011; 1: 7–12.
- Сыркин А. Л., Добровольский А. В. Антиишемические препараты метаболического действия // Consilium Medicum. 2002; 4 (11): 572–575.
- Van Bilsen M., Smeets P. J., Gilde A. J., van der Vusse G. J. Metabolic remodelling of the failing heart: the cardiac bum-out syndrome? // Cardiovasc. Res. 2004; 61 (2): 218–226.
- Mario Marzilli. Preductal MR. Od desetiletych klinickych zkusenosti s lecbou u stabilni anginy pectoris k novym perspektivam // Medicina po promoci. 2011; 12 (1): 95–98.
- Dambrova M., Liepinsh E., Kalvinsh I. Mildronate: cardioprotective action through carnitine-lowering effect // Trends Cardiovasc Med. 2002, Aug; 12 (6): 275–279.
- Lopaschuk G. D., Barr R., Thomas P. D., Dyck J. R. Beneficial effects of trimetazidine in ex vivo working ischemic hearts are due to a stimulation of glucose oxidation secondary to inhibition of longchain 3-ketoacyl coenzyme a thiolase // Circ Res. 2005; 93: 33–37.
- Hanaki Y., Sugiyama S., Ozawa T. Effect of 3-(2,2,2, — trimelhylhydrazinium) propionate, gamma-butyrobetaine hydroxylase inhibitor, on isoproterenol — induced mitochondrial dysfunction // Res. Commun. Chem. Phatol. Pharmacol. 1999; 64: 157–160.
- Гордеев И. Г., Лучинкина Е. Е., Люсов В. А. Антиоксидантный эффект кардиопротектора милдроната у пациентов, подвергшихся коронарной реваскуляризации // Российский кардиологический журнал. 2009; 1 (75): 31–37.
- Корокин М. В., Артюшкова Е. В., Покровский M. В. и др. Исследование эндотелио- и кардиопротективных свойств препарата «Кардионат» при моделировании L-Name — индуцированного дефицита оксида азота // Курский научно-практический вестник «Человек и его здоровье». 2007; 3: 5–9.
- Артюшкова Е. В., Покровский М. В., Корокин М. В., Гуреев В. В., Бобраков К. Е. Исследование эндотелиопротективных эффектов препарата «Кардионат» на ADMA-подобной модели дефицита азота при специфической блокаде NO-синтазы // International Journal on Immunorehabilitation (Международный журнал по иммунореабилитации). 2009; 11 (1): 66–67.
- Ладыгин А. Ю., Михин В. П., Ушкалов А. В. и др. Эффективность применения Кардионата и Предуктала МВ для коррекции эндотелиальной дисфункции у больных ишемической болезнью сердца, стабильной стенокардией напряжения. Тезисы докладов Международного конгресса «Кардиология на перекрестке наук» совместно с V Международным симпозиумом по эхокардиографии и сосудистому ультразвуку, XVII ежегодной научно-практической конференцией «Актуальные вопросы кардиологии», Тюмень, 19–21 мая 2010 г.
- Суслина З. А., Максимова М. Ю., Федорова Т. Н. Хронические цереброваскулярные заболевания: клиническая и антиоксидантная эффективность милдроната // Врач. 2007; 4: 3–7.
- Мкртчян В. Р. Клиническая фармакология средств, улучшающих энергетический метаболизм миокарда: учебное пособие. М.: МЗ России, 2003. 24 с.
- Стаценко М. Е., Евтерева Е. Д., Туркина С. В. и др. Возможность применения миокардиального цитопротектора в комбинированной терапии больных с хронической сердечной недостаточностью и метаболическим синдромом // Consiliun Mеdicum (кардиология). 2010; 12 (10): 76–82.
- Dzerve V., Matisone D., Pozdnyakov Y., Oganov R. Mildronate improves the exercise tolerance in patients with stable angina: results of a long term clinical trial // Sem Cardiovasc Med. 2010; 16 (3): 1–8.
- Дзерве В. Эффективность Милдроната в лечении ишемической болезни сердца: результаты исследования MILSS II // Квітень. 2010; 7: 236.
- Vilnis Dzerve, MILSS I Study Group. A Dose-Dependent Improvement in Exercise Tolerance in Patients With Stable Angina Treated With Mildronate: A Clinical Trial «MILSS I» // Medicina (Kaunas). 2011; 47 (10): 544–51.
- Киселев А. Р., Шварц В. А., Посненкова О. М. Влияние терапии препаратом Кардионат на качество жизни у больных острым инфарктом миокарда с подъемом сегмента ST в раннем постинфарктном периоде. ФГУ Саратовский НИИ кардиологии Росмедтехнологий // Consilium Medicum. 2010; 12 (5): 94–98.
- Кузнецова А. В., Тепляков А. Т. Оценка влияния Кардионата на эффективность антиангинальной терапии и функциональное состояние миокарда у больных ИБС в сочетании с артериальной гипертензией, ассоциированной с сахарным диабетом типа 2 // Фарматека. 2007; 3: 81–84.
- Веденьева В. В., Михин В. П., Шарова В. Г. и др. Сравнительная эффективность кардиоцитопротекторов Кудесана и Кардионата у больных стабильной стенокардией напряжения: Тезисы докладов Международного конгресса «Кардиология на перекрестке наук» совместно с V Международным симпозиумом по эхокардиографии и сосудистому ультразвуку, XVII ежегодной научно-практической конференцией «Актуальные вопросы кардиологии», Тюмень, 19–21 мая 2010.
- Пустозеров В. Г., Красильникова И. П., Костромина М. А., Михайлова М. Н. Опыт применения Кардионата в геронтологической практике // Справочник поликлинического врача. 2009; 9: 20–21.
- Стаценко М. Е., Туркина С. В., Беленкова С. В. Возможности применения милдроната у больных хронической сердечной недостаточностью с сахарным диабетом 2-го типа и автономной кардиальной нейропатией // Российский кардиологический журнал. 2009; 3 (77): 69–75.
- Стаценко М. Е., Туркина С. В., Спорова О. Е. и др. Применение препарата Кардионат в комбинированной терапии хронической сердечной недостаточности ишемической этиологии у больных с метаболическим синдромом // Российский кардиологический журнал. 2010; 4: 35–39.
- Артюшкова Е. В. Увеличение уровня гамма-бутеробетаина — фармакологическая мишень для коррекции эндотелиальной дисфункции // Кубанский научный медицинский вестник. 2009; 4: 72–74.
- Полетаева Л. В., Туркина С. В., Стаценко М. Е, Голикова И. А. Влияние милдроната в составе комбинированной терапии на показатели патологического индекса сетчатки у больных сахарным диабетом 2-го типа. Тезисы докл. XVI Российского нац. конгресса «Человек и лекарство». М., 2009. С. 343.
- Стаценко М. Е, Полетаева Л. В., Туркина С. В., Дудченко Г. П. Возможность применения милдроната в лечении больных с диабетической периферической сенсомоторной нейропатией // Вестник Волгоградского государственного медицинского университета. 2009; 1 (29): 39–42.
- Стаценко М. Е., Недогода С. В., Туркина С. В. и др. Возможности милдроната в коррекции когнитивных нарушений у пациентов с артериальной гипертензией пожилого возраста // Российский кардиологический журнал. 2011; 4: 91–95.
- Суслина З. А., Максимова М. Ю., Кистенев Б. А., Федорова Т. Н. Нейропротекция при ишемическом инсульте: эффективность Милдроната // Фарматека. 2005; 13: 99–104.
- Дзерве В. Новые возможности в лечении пациентов с заболеваниями периферических артерий: результаты исследования MI&CI // Лikи Украiни. 2010; 8 (144): 99–101.
- Михин В. П., Поздняков Ю. М., Хлебодаров Ф. Е., Кольцова О. Н. Милдронат в кардиологической практике — итоги, новые направления, перспективы // Кардиоваскулярная терапия и профилактика. 2012; 11 (1): 96–103.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru