Функциональная и органическая диспепсия: «перекрест» стратегий диагностики и лечения в общей практике
Е. И. Вовк, кандидат медицинских наук, доцент
ГБОУ ВПО МГМСУ Минздравсоцразвития России, Москва
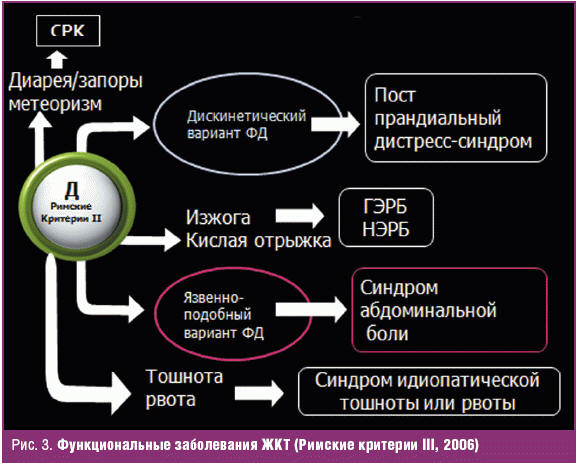
Диспепсия принадлежит к числу наиболее часто встречающихся гастроэнтерологических жалоб. Частота синдрома диспепсии (uninvestigated dyspepsia) у взрослого населения в странах мира варьирует от 7% до 41% (рис. 1) и составляет в среднем около 25% [1–3]. Столь широкая распространенность диспепсии не удивительна, поскольку к появлению симптомов могут приводить как нарушения деятельности верхних отделов желудочно-кишечного тракта (ЖКТ) органического или функционального генеза, так и нарушения полостного пищеварения в кишечнике (синдромом мальдигестии) (рис. 2).
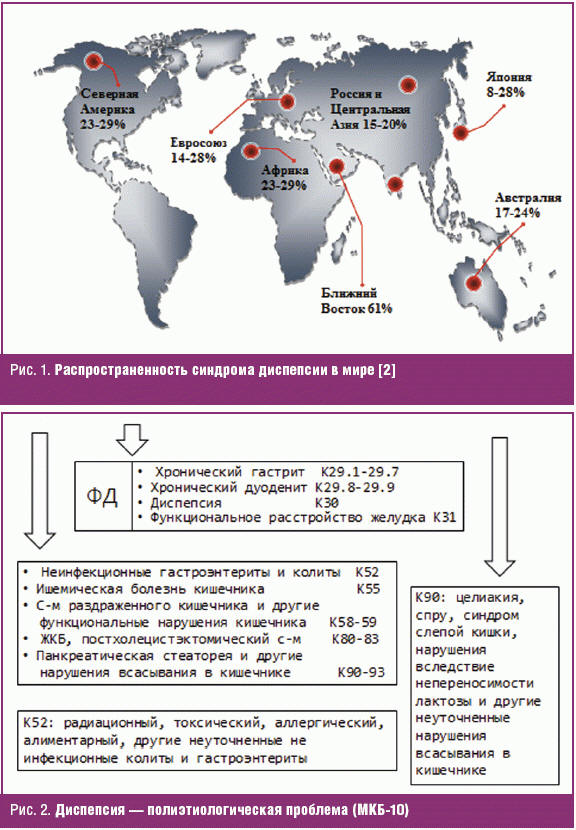
Этот изначальный «перекрест» симптомов существенно усложняет всю дальнейшую стратегию выявления, лечения и формирования прогноза у больных с диспепсией различной этиологии. Тем не менее, в новейших эпидемиологических исследованиях установлено, что почти у 2/3 пациентов с диспепсией (около 20% населения) жалобы возникают вследствие первичной дисфункции желудка и двенадцатиперстной кишки (ДПК) в отсутствии заболеваний ЖКТ, а также системной патологии и могут быть диагностированы как функциональная диспепсия (ФД) [4–7].
Современные научные представления рассматривают ФД как гетерогенное расстройство [8].
Среди этиологических факторов ФД свою роль играют:
- наследственность;
- наличие нарушений моторной функции желудка и кишечника;
- инфекция Helicobacter pylori;
- факторы психосоциального характера и образа жизни (алкоголь, курение, питание);
- ятрогенные лекарственные влияния (прием нестероидных противовоспалительных препаратов (НПВП), антибиотиков, теофиллина, препаратов наперстянки и др.).
Предполагают, что у ряда больных имеет место наследственно детерминированная (генотип GN бета-3 cc) высокая висцеральная чувствительность желудка и/или ДПК к физиологической нейрогуморальной стимуляции. Периодическая активация нейрогуморальной стимуляции под влиянием изменения рациона питания, стресса, курения, нарушений сна и других факторов у больных с ФД приводит к гиперацидности в желудке и ДПК и развитию ассоциированных с ацидификацией ДПК нарушений гастродуоденальной моторики (функциональный гастро- и дуоденостаз), которые и становятся причиной диспепсии. Характерно, что уровень базальной и стимулированной секреции соляной кислоты у большинства больных с ФД остается в пределах нормы, хотя и может приближатьcя к гиперацидности, характерной для пептической язвенной болезни. Высокая висцеральная чувствительность у пациентов с ФД часто сочетается с психоэмоциональными особенностями, которые близки к признакам неадекватной реакции личности на хронический стресс: тревожностью и невротизмом, депрессивностью, склонностью к ипохондрии, нарушением психологической и социальной адаптации. Эти особенности нередко провоцируют появление симптомов ФД и нивелирутся после соответствующей медикаментозной коррекции или изменения обстановки, в которой находится больной.
Различные нарушения гастродуоденальной моторики выявляют у 75% больных ФД:
- замедление эвакуаторной функции желудка;
- снижение частоты и амплитуды перистальтики желудка;
- нарушение антродуоденальной координации;
- ослабление постпрандиальной моторики антрального отдела;
- нарушение рецептивной и адаптивной релаксации желудка, что приводит к нарушению распределения пищи внутри желудка и вызывает чувство быстрого насыщения;
- нарушения циклической активности желудка в межпищеварительном периоде: тахи-, брадигастрия, антральная фибрилляция [8, 9].
ФД нередко сочетается с другими функциональными заболеваниями ЖКТ. «Перекрест» с синдромом раздраженной кишки (СРК) выявляют, по разным данным, у 30–50% пациентов с ФД [11–15]. «Перекрест» с гастроэзофагеальной рефлюксной болезнью (ГЭРБ) встречается в 7–20% случаев ФД [16–18]. У значительной части больных ФД сочетается с дискинезией желчевыводящих путей [15]. Выявление других форм функциональной патологии ЖКТ не исключает диагноза ФД и должно приводить к включению этих самостоятельных заболеваний в диагноз и соответствующей коррекции терапевтической тактики. Учитывая конституциональный характер патогенеза, прогноз при ФД можно считать не связанным с инвалидизацией, но неблагоприятным: симптомы диспепсии упорны и существенно снижают качество жизни пациентов и служат причиной значительных материальных затрат. Пациенты с ФД существенно чаще и дольше пребывают на больничном листе и чаще обращаются за медицинской помощью [1].
Органическую диспепсию диагностируют у пациентов с заболеваниями, имеющими ясные этиологические и патофизиологические причины развития устойчивой гиперацидности и нарушений моторики верхнего отдела ЖКТ: пептическая язвенная болезнь, хронический панкреатит (ХП), желчнокаменная болезнь (ЖКБ), сахарный диабет (СД), нарушения функции щитовидной железы, хроническая ишемия желудка и органов панкреатодуоденальной зоны и другие [1, 5–7]. Таким образом, несмотря на низкую специфичность симптомов, заболевания, приводящие к органической диспепсии, уже на ранних этапах диагностики сопровождаются специфичными клинико-инструментальными проявлениями. Течение и прогноз органической диспепсии прямо зависит от выявления ее этиологии и адекватности фармакологического и нелекарственного лечения. В целом ряде случаев, в том числе с применением широких возможностей современной малоинвазивной хирургии, прогноз органической диспепсии может оказаться более оптимистичным, чем при ФД.
Диагностика ФД нередко встречает трудности, обусловленные низкой специфичностью симптомов, различиями в понимании и современной интерпретации понятий ФД, органической диспепсии и мальдигестии. На практике в понятие ФД чаще всего включают метеоризм, тошноту, нарушения стула, характерные как для различных нарушений полостного пищеварения, так и для СРК и ГЭРБ. Указанные разночтения стали одним из обоснований необходимости очередного обновления рекомендаций по диагностике функциональных заболеваний ЖКТ, которое было проведено в рамках согласительного совещания Международной рабочей группы по совершенствованию диагностических критериев функциональных заболеваний ЖКТ (Римские критерии III, 2006). Согласно им (рис. 3), ФД включает в себя боли и чувство жжения в подложечной области, чувство переполнения в эпигастрии после еды и чувство раннего насыщения [1, 5, 10].
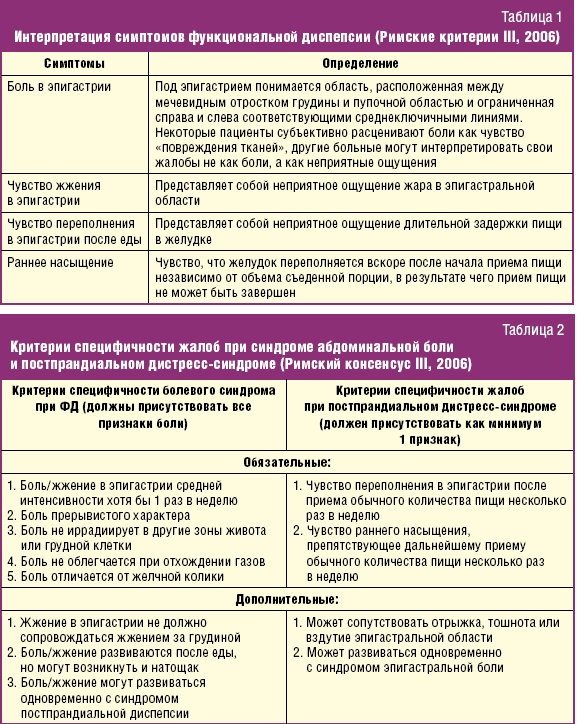
Римский консенсус III выделяет два основных варианта ФД и впервые жестко определяет критерии специфичности жалоб при синдроме абдоминальной боли и постпрандиальном дистресс-синдроме, которые, впрочем, могут существовать одновременно, а также и сочетаться с функциональной тошнотой/рвотой или отрыжкой (табл. 1, 2).
В рекомендациях также впервые подчеркнут преимущественно постпрандиальный характер симптомов ФД. Очевидно, что эта важнейшая характеристика принципиально отличает симптомы ФД от «голодных» жалоб при обострении H. pylori-ассоциированного гастрита и пептической язвенной болезни. Согласно рекомендациям для интерпретации симптомов в рамках ФД необходимо, чтобы указанные жалобы персистировали в течение 3 последних месяцев, а их общая продолжительность составляла не менее 6 месяцев и, что имеет принципиальное значение, — при условии отсутствия органических заболеваний органов пищеварения, которые могли стать причиной диспепсии.
Лечение пациентов с ФД должно быть комплексным и включать диету, рекомендации по режиму и образу жизни, медикаментозные и немедикаментозные воздействия. Приоритетом лекарственной терапии является назначение антисекреторных средств — сегодня это, без сомнения, ингибиторы протонной помпы (ИПП) — всем больным с абдоминальным болевым синдромом и значительной части пациентов с недифференцируемым течением ФД и постпрандиальным дистресс-синдромом [19–21]. Показано, что в большинстве случаев ФД оказывается эффективной длительная терапия низкими дозами ИПП (20 мг омепразола в сутки) [23]. Однако у значительной части больных монотерапия ИПП не приводит к редукции симптомов [20]. Такие пациенты нуждаются в назначении прокинетиков. По данным метаанализа, эффективность монотерапии прокинетиками при ФД также едва превышает 60% [21]. Тем не менее, способность прокинетиков разных классов корректировать специфичные для ФД нарушения антродуоденальной моторики научно и клинически доказана. Длительное применение прокинетиков при ФД, к сожалению, ограничивается их системными побочными эффектами. В течение многих лет одним из наиболее безопасных препаратов для длительного применения при ФД остается блокатор периферических дофаминовых рецепторов домперидон. В целом ряде недавно проведенных исследований было показано, что эффективность и безопасность лекарственного лечения ФД увеличивается при сочетанном назначении ИПП и прокинетиков в низких дозах [22, 23]. Одним из таких препаратов этого класса является Омез Д, который представляет собой фиксированную комбинацию 10 мг омепразола и 10 мг домперидона в 1 капсуле. По данным исследователей, применение 2 капсул Омеза Д в сутки в течение 4 недель вне зависимости от варианта течения ФД привело к значимой редукции симптомов ФД у 70–90% больных с постпрандиальным дистресс-синдромом или сочетанным вариантом течения ФД [7, 23, 24]. Во всех исследованиях терапия была безопасной и сопровождалась высоким уровнем приверженности больных к лечению, вероятно, обусловленным удобством применения препарата. Проведение комбинированной антихеликобактерной терапии способствует исчезновению симптомов ФД только у 25% пациентов. Тем не менее, неинвазивное определение уровня контаминации H. pylori и его последующая эрадикация (как минимум — однократно) являются необходимой частью алгоритма лечения ФД [1, 8].
По сути, Римские критерии III стали «ответом» на сложившиеся алгоритмы лечения диспепсии как в медицинской практике, так и в обществе в целом. Сегодня необходимо признать, что пациент с симптомами диспепсии нередко получает квалифицированную медицинскую помощь после длительного периода самолечения. По некоторым данным, в России почти 40% лиц с упорной диспепсией никогда не обращаются за медицинской помощью [37]. С другой стороны, в общей практике путь к верифицированному диагнозу и адекватному лечению диспепсии нередко становится очень долгим вследствие широкого распространения тактики эмпирического лечения диспепсии: на начальном этапе как H. pylori-ассоциированного гастрита; в дальнейшем посредством монотерапии ИПП, гарантированно улучшающей профиль симптомов. Очевидно, что эмпирическая терапия ИПП объективно уменьшает расходы на обследование и лечение в общей практике, поскольку успешно отсеивает большинство случаев транзиторной диспепсии и нетяжелых обострений других кислотозависимых заболеваний. Благодаря эффективности и доступности ИПП (преимущественно — омепразола, который в большинстве стран стал препаратом безрецептурного отпуска) «портрет» пациента с диспепсией в общей практике изменился в сторону концентрации больных с персистированием симптомов, требующих дальнейшего обследования для определения причин диспепсии. Однако, именно вследствие высокой эффективности ИПП, сегодня эмпирическая терапия диспепсии нередко «работает» против больного: для значительной части пациентов с упорной диспепсией, особенно в странах с высоким уровнем контаминации H. pylori, альтернатива диагнозу хронического H. pylori-ассоциированного гастрита и лечению повторными курсами комбинированной антихеликобактерной терапии фактически перестала существовать. Римский консенсус III (2006) в целом ужесточил критерии диагностики ФД и сфокусировал внимание на постпрандиальном характере симптомов и отсутствии прямой зависимости диспепсии от наличия у больных Н. рylori-ассоциированного гастрита, а именно эта обширная когорта больных и оказалась в сфере внимания специалистов. Несмотря на некоторые аспекты, спорные для гастроэнтерологов, глубоко ориентирующихся в проблеме ФД, достоинством Римских критериев III является то, что они нацеливают на поиск этиологии симптомов диспепсии, что, несомненно, приведет к оптимизации лечения больных не столько с ФД, сколько с органической диспепсией в амбулаторной и общей практике.
Перечень заболеваний органов пищеварения, которые требуют исключения при верификации диагноза ФД, вошедший в Римские критерии III, практически не отличается от изложенного в Римских критериях II, утвержденных в 1999 году [10, 15]. Особенно часто ФД приходится дифференцировать с распространенными заболеваниями, которые могут привести к устойчивой ацидификации ДПК и нарушениям моторики выходного отдела желудка и ДПК (табл. 3).
Пептическая язвенная болезнь с высокой кислотной продукцией и персистированием Н. рylori-ассоциированнного гастрита — наиболее частая причина некомпенсированной гиперацидности ДПК. В исследованиях убедительно показано, что кислотная перфузия луковицы ДПК при высокой кислотной продукции в желудке не только способна вызвать повреждение стенки кишки, но ответственна и за повышение интрадуоденального и интрапилорического давления с одновременным снижением тонуса привратника и пищеводно-желудочного градиента давления, что способствует дуоденогастральному и гастроэзофагеальному рефлюксам [25–27]. Ощелачивание выходного отдела желудка до уровня, требуемого для инициации расслабления привратника и снижения антродуоденального давления, приводит к одновременному купированию боли и синхронизации моторики желудка и ДПК. Поэтому залогом эффективного лечения диспепсии при пептической язвенной болезни служит ее адекватная диагностика и эффективное комбинированное антихеликобактерное лечение. Значительно хуже диагностике и лечению поддаются непептические эрозивно-язвенные гастродуоденальные поражения, при которых ацидификация ДПК развивается вследствие нарушения ощелачивания, а не по причине высокой кислотной продукции. Наиболее часто к таким нарушениям приводит хроническая гастродуоденальная ишемия и ХП.
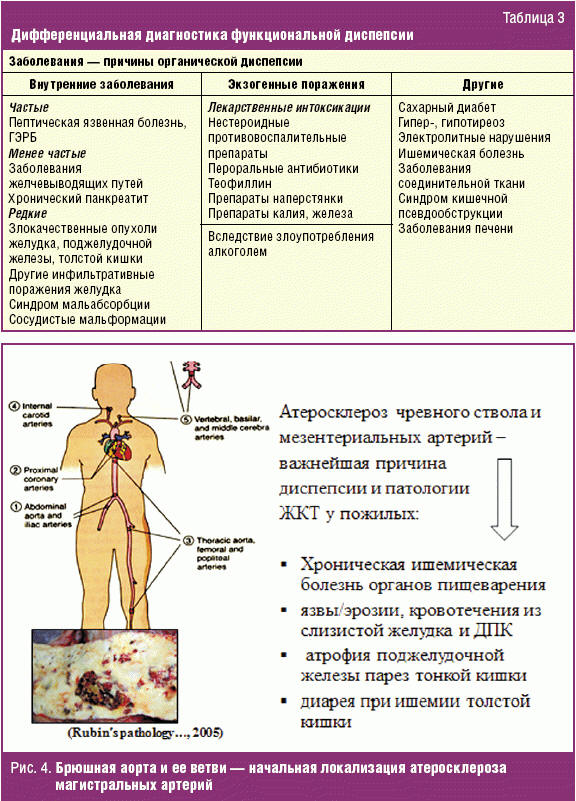
Острая ишемия развивается в рамках патогенеза стрессовых гастродуоденальных поражений и желудочно-кишечных кровотечений (ЖКК) как правило у тяжелобольных с черепно-мозговой травмой, дыхательной и почечной недостаточностью, отравлениями, на фоне острого инфаркта миокарда и др. Стратегия лечения и профилактики таких поражений сегодня хорошо известна и широко применяется в клинике. Хроническая ишемическая болезнь органов пищеварения, напротив, диагностируется редко (почти исключительно — при развитии крайне тяжелых форм мезентериальной ишемии или панкреонекроза) и еще реже рассматривается как причина органической диспепсии (рис. 4). Между тем клинически значимое интравазальное атеросклеротическое поражение ветвей чревного ствола, питающих желудок, ДПК, поджелудочную железу, печень и селезенку, встречается у 73,5% больных с артериальной гипертензией, атеросклерозом венечных артерий сердца, артерий головного мозга [28]. Морфологически хроническая ишемия в бассейне чревного ствола приводит к прогрессирующей атрофии и фиброзу желудка, ДПК и поджелудочной железы с соответствующим снижением способности к функциональной нагрузке и резистентности к соляной кислоте. Как и при ФД, хроническая ишемия в бассейне чревного ствола вызывает появление постпрандиальных жалоб на чувство тяжести и распирания в эпигастрии у 90% больных, упорную отрыжку — у 50% и изжогу — у 35% больных [29].
В тяжелых случаях хронической ишемии развивается симптомокомплекс «брюшной жабы» с резким снижением толерантности к приему пищи. Однако в начале заболевания указанные симптомы нередко рассматривают в рамках ФД. Как ни парадоксально, по данным статистики здравоохранения в разных странах, у пожилых больных, у которых «a priory» имеется магистральный атеросклероз и высокая вероятность органической диспепсии, ФД диагностируется в 3 раза чаще, чем в молодом возрасте (табл. 4).
При обследовании пожилых больных с упорной диспепсией нередко возникает другая крайность — и жалобы, и структурные изменения органов пищеварения интерпретируются как ассоциированные с Н. рylori-гастритом или ХП с внешнесекреторной недостаточностью, что соответственно влечет за собой назначение курсов антихеликобактерной терапии или препаратов панкреатических ферментов. И в том, и в другом случае пациенты не получают необходимого антиацидотического лечения и продолжают жить с симптомами диспепсии, в условиях высокого риска ЖКК и прогрессирования трофологической недостаточности. К сожалению, панкреатические ферменты в общей практике почти всегда становятся препаратами первого выбора и заканчивают диагностический поиск при органической диспепсии, ассоциированной с ХП.
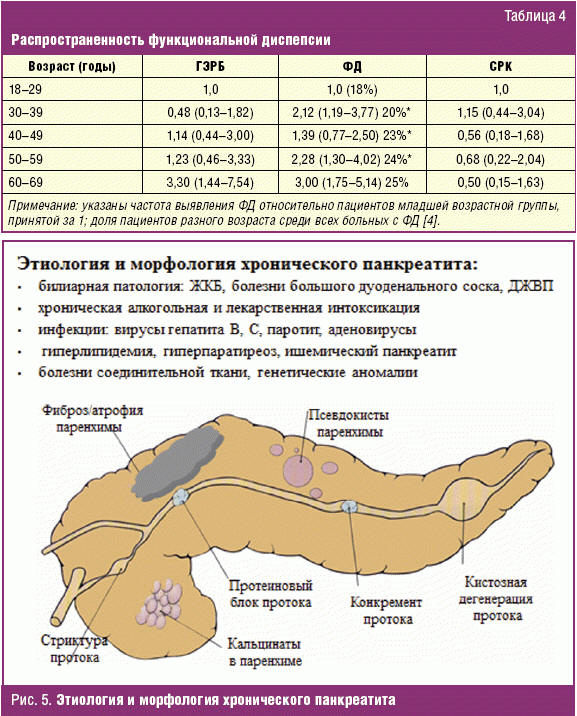
Согласно современным представлениям, ХП — группа хронических заболеваний поджелудочной железы различной этиологии, при которых развиваются дегенеративно-деструктивные изменения паренхимы поджелудочной железы: атрофия панкреоцитов, фиброз паренхимы; изменения в протоковой системе поджелудочной железы, образование кист и конкрементов и различной степени нарушения экзокринной и эндокринной функций поджелудочной железы [30, 31]. Установлено, что фиброз и атрофия поджелудочной железы прогрессируют при каждом обострении ХП, а также развиваются субклинически и приводят к уменьшению функционирующей паренхимы с нарушением внешней секреции в постпрандиальном периоде. Раньше всего в панкреатическом соке уменьшается содержание бикарбонатов, вследствие чего нарушается ощелачивание ДПК. Ацидификация ДПК при рН < 4 рефлекторно стимулирует выработку секретина, который в свою очередь стимулирует продукцию бикарбонатов эпителием желчных, панкреатических протоков и дуоденальных желез и уменьшает секрецию соляной кислоты в желудке. Секретин увеличивает секрецию холецистокинина, который тоже увеличивает секрецию щелочного кишечного сока и обеспечивает поступление в ДПК щелочной желчи.
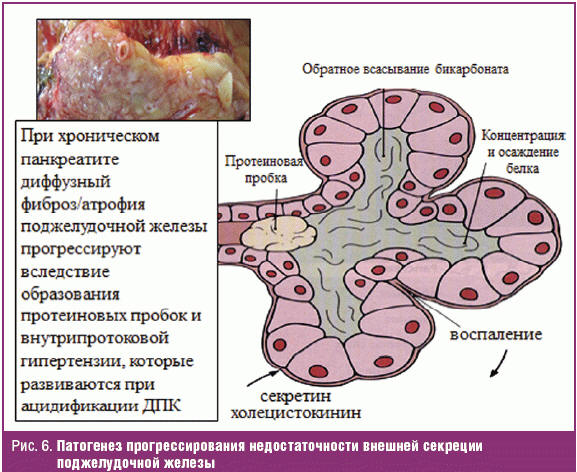
Оба механизма в норме направлены на ощелачивание ДПК, поскольку протеолиз химуса в ДПК возможен только при рН > 4 — панкреатические липаза и протеазы полностью разрушаются при рН < 2,5. Однако при ХП эти механизмы не только не срабатывают, а запускают порочный круг дальнейшего прогрессирования воспаления и дефицита экзокринной секреции железы. Дело в том, что стимуляция секреции панкреоцитов и протокового эпителия на фоне уже существующего сгущения секрета, блокирования мелких протоков белковыми пробками и внутрипанкреатической гипертензии еще более увеличивает давление в ацинарных протоках. Высокое внутрипротоковое давление вновь вызывает обратное всасывание бикарбонатов, и происходит дальнейшее образование белковых «пробок» в ацинусах с прогрессированием недостаточности внешней секреции поджелудочной железы (рис. 6). Прогрессируют и симптомы диспепсии: их тяжесть усугубляет присоединение вызванного гиперпродукцией секретина гастроэзофагеального рефлюкса и мальдигестия вследствие кислотного протеолиза панкреатических ферментов при рН < 2,5 [32]. Установлено, что нарушения моторики выходного отдела желудка и ДПК начинают формироваться уже на ранних стадиях экзокринной недостаточности, когда дефицит секреции бикарбонатов и ферментов компенсируется удлинением времени пребывания химуса в ДПК и развивается субкомпенсированный дуоденостаз. По мере нарастания экзокринной недостаточности длительность периодов дуоденостаза растет, развиваются антродуоденальная дискоординация и дуоденогастроэзофагеальный рефлюкс [33]. Нарушения моторики особенно быстро формируются при ХП у больных с СД. Причем при СД 1-го типа экзокринная панкреатическая недостаточность встречается чаще — более чем в 70% случаев и нередко сочетается с симптомами гастропареза как проявления автономной нейропатии. При СД 2-го типа экзокринная недостаточность развивается почти в половине случаев и часто сопровождается мальдигестией вследствие билиарной недостаточности на фоне метаболического синдрома со стеатозом поджелудочной железы и печени [33–35]. Таким образом, ХП, наряду с первичным поражением паренхимы и прогрессирующей потерей секреторной функции поджелудочной железы даже у больных с нормальным уровнем кислотообразования в желудке «a priori» протекает со стойкой ацидификацией ДПК и ассоциированными с ней стойкими нарушениями моторики верхних отделов ЖКТ: гастродуоденальным и дуоденогастральным рефлюксами. С учетом накопленных к настоящему времени доказательств «кислотозависимости», алгоритмы фармакологического лечения ХП пересматриваются в сторону более раннего назначения блокаторов желудочной секреции, и не только с целью обеспечения секреторного покоя в периоде обострения. Антисекреторные средства при ХП являются препаратами первого ряда и должны назначаться для коррекции механизмов прогрессирования и симптомов диспепсии, обусловленных ацидификацией ДПК [32, 36]. Пациентам с ХП и СД, ожирением, формирующейся хронической ишемической болезнью органов пищеварения, а также больным, принимающим препараты наперстянки, бета-2-агонисты и препараты теофиллина, у которых симптомы диспепсии сочетаются с ГЭРБ, ИПП целесообразно назначать вместе с прокинетиками. С точки зрения неблагоприятного лекарственного взаимодействия, наиболее безопасным прокинетиком для этих полиморбидных пациентов является домперидон. Комбинированное назначение ИПП и домперидона потенцирует их эффекты в отношении нормализации антродуоденальной моторики, компенсации гиперацидности в ДПК и повышает тонус нижнего пищеводного сфинктера. У пожилых больных с полифармакотерапией, для обеспечения безопасности и высокого уровня приверженности лечению, в рамках эмпирической терапии диспепсии целесообразно применение Омеза Д — фиксированной низкодозовой комбинации омепразола и домперидона.
Однако в общей практике у больных, которые впервые обратились за медицинской помощью, диспептические жалобы могут рассматриваться как функциональное расстройство желудка, диспепсия или, наконец, хронический гастрит. Важно, чтобы, согласно Римским критериям III, к пациентам с диспепсией применялась единая стратегия диагностики и лечения, которая должна включать несколько обязательных этапов [8]:
- направленный анализ жалоб и получение доказательств связи симптомов с верхними отделами ЖКТ;
- эзофагогастродуоденоскопия (ЭГДС) однократно всем больным с симптомами тревоги и пациентам старше 40 лет;
- исключение «симптомов тревоги», которые требуют добросовестного дообследования пациентов, с целью выявления более тяжелой скрытой патологии;
- определение H. pylori и, при положительном ответе, — его эрадикация (возможна стратегия «test and treat», если нет показаний для ЭГДС);
- рекомендации по минимизации приема ацетилсалициловой кислоты или других НПВП, коррекции образа жизни;
- эмпирическая терапия ИПП и прокинетиками;
- в случае упорной диспепсии — проведение глубокого обследования для дифференциального диагноза с органической диспепсией и мальдигестией.
Литература
- Ивашкин В. Т., Шептулин А. А., Лапина Т. Л., Картавенко И. М. и др. Рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению функциональной диспепсии // РЖГГК. 2012; 22 (3): 80–92.
- Mahadeva S., Goh K. L. Epidemiology of functional dyspepsia: A global perspective // World J Gastroenterol. 2006; 12 (17): 2661–2666.
- Shaib Y., El-Serag H. B. The prevalence and risk factors of functional dyspepsia in a multiethnic populationin the United States // Am J Gastroenterol. 2004; 99: 2210–2216.
- Piessevaux H., De Winter B., Louis E. et al. Dyspeptic symptoms in the general population: a factor and cluster analysis of symptom groupings // Neurogastroenterol Motil. 2009; 21: 378–388.
- Tack J., Talley N. J., Camilleri M. et al. Functional gastroduodenal disorders // Gastroenterology. 2006; 130: 1466–1479.
- Talley N. J., Ruff K., Jiang X. et al. The Rome III classification of dyspepsia: will it help research? // Dig Dis. 2008; 26: 203–309.
- Иванов А. Н., Прянишникова А. С., Краснолобова Л. П. Современные представления о диагностике и лечении функциональной диспепсии // Фарматека. № 12, с. 44–48.
- Маев И. В., Самсонов А. А., Буеверов А. О., Кочетов С. А. Место прокинетиков в последних алгоритмах диагностики и лечения функциональной диспепсии // РМЖ. 2010, № 9, с. 549–554.
- Картавенко И. М., Лапина Т. Л., Коньков М. Ю. и др. Морфофункциональная оценка двенадцатиперстной кишки у больных с функциональной диспепсией // Рос. журн. гастроэнтерол., гепатол., колопроктол. 2008; 18 (5): 23–32.
- Drossman D. A. Rome III: the new criteria // Chin J Dig Dis. 2006; 7 (4): 181–185.
- Holtmann G., Goebell H., Talley N. J. Functional dyspepsia and irritable bowel syndrome: is there a common pathophysiological basis? // Am J Gastroenterol. 1997; 92: 954–959.
- Stanghellini V., Tosetti C., Barbara G., De Giorgio R., Cogliandro L., Cogliandro R., Corinaldesi R. Dyspeptic symptoms and gastric emptying in the irritable bowel syndrome // Am J Gastroenterol. 2002; 97: 2738–2743.
- Wang A., Liao X., Xiong L. et al. The clinical overlap between functional dyspepsia and irritable bowel syndrome based on Rome III criteria // BMC Gastroenterol. 2008; 8: 43.
- Kazutoshi H., Takayuki M., Hiroto M. Analysis of the Gastrointestinal Symptoms of Uninvestigated Dyspepsia and Irritable Bowel Syndrome Gut and Liver // Chin J Dig Dis. 2009; 3 (3): 192–196.
- Ливзан М. А., Осипенко М. Ф. Синдром перекреста функциональных заболеваний пищеварительного тракта // РМЖ. 2012, № 15, с. 768–771.
- Holtmann G., Talley N. Clinician’s manual on managing dyspepsia. Life Science Communications. London, 2000; 88 p.
- Ruigomez A., Wallander M. A., Johansson S. et al. Natural history of gastroesophageal reflux disease diagnosed in UK general practice // Aliment Pharmacol Ther. 2004; 20: 751–760.
- Keohane J., Quigley E. M. Functional dyspepsia and nonerosive reflux disease: clinical interactions and their implications // Med. Gen. Med. 2007; 9 (3): 31.
- Talley N. J., Meineche-Schmidt V., Pare P. et al. Efficacy of omeprazole in functional dyspepsia: Double-blind, randomized, placebo-controlled trials (the Bond and Opera studies) // Aliment Pharmacol Ther. 1998; 12: 1055–1065.
- Moayyedi P., Delaney B. C., Valik N. et al. The efficacyof proton pump inhibitors in non-ulcer dyspepsia: a systematic review and economic analysis // Gastroenterology. 2004; 127: 1329–1337.
- Moayyedi P., Soo S., Deeks J. et al. Pharmacological interventions for non-ulcer dyspepsia // Cochrane Database Syst Rev. 2004; CD001960.
- Ghosh A., Halder S., Mandal S. et al. Rabeto plus: a valuable drug for managing functional dyspepsia // J Indian Med Assoc. 2008; 106: 752–754.
- Булгаков С. А. Возможности применения Oмеза Д в лечении функциональной диспепсии // Фарматека. 2010, № 20, с. 39–42.
- Пасечников В. Д., Пасечников Д. В. Оценка эффективности терапии функциональной диспепсии фиксированной комбинацией ингибитора протонной помпы (омепразол) и прокинетика (домперидон) // Фарматека. 2011, № 20, с. 77–81.
- Маев И. В., Горбань В. В., Салова Л. М. Влияние соляной кислоты на полостное давление в дуоденогастральной зоне у больных ЯБДК, ассоциированной с Н. Р // Экспериментальная и клиническая гастроэнтерология. 2008, № 4, с. 4–8.
- Маев И. В., Самсонов А. А. Болезни двенадцатиперстной кишки. М.: МЕДпрессинформ, 2005, с. 511.
- Волков В. С., Колесникова И. Ю., Беляева Г. С. и др. Дуоденогастральный рефлюкс при кислотозависимых заболеваниях // Рос. журн. гастроэнтерол., гепатол., колопроктол. 2002, т. 12, № 5 (прил. 17), с. 22–25.
- Звенигородская Л. А., Самсонова Н. Г., Топорков А. С. Хроническая ишемическая болезнь органов пищеварения: алгоритм диагностики и лечения // РМЖ. 2010, № 9, с. 544–549.
- Поташов Л. В. Князев М. Д., Игнашов А. М. Ишемическая болезнь органов пищеварения. Л.: Медицина, 1985, с. 70–75.
- Минушкин О. Н. Хронический панкреатит: некоторые аспекты патогенеза, диагностики и лечения // Consilium Medicum. 2002, т. 4, № 1, с. 1–5.
- Маев И. В., Кучерявый Ю. А. Болезни поджелудочной железы. В 2 т. Т. 2. М.: Медицина, 2008, 558 с.
- Кучерявый Ю. А. Хронический панкреатит как кислотозависимое заболевание // Экспериментальная и кл. гастроэнтерология. 2010, № 9, с. 107–115.
- Житникова Л. М. Нарушения пищеварения и значение ферментотерапии в общей медицинской практике // РМЖ. 2011, № 28, с. 1722–1730.
- Ткач С. М., Сизенко А. К. Эффективность и безопасность ферментных препаратов с позиций доказательной медицины // Газета «Новости медицины и фармации». № 13–14, с. 333–334.
- Вахрушев Я. М., Ляпина М. В., Булычев В. Ф., Зеленин В. А. Изучение двигательной функции тонкой кишки при метаболическом синдроме. XI съезд НОГР. Тезисы докл. М.: ЦНИИ гастроэнтерологии, 2011, С. 123.
- Пасечников В. Д., Литвиненко И. Л. Оптимизация терапии экзокринной недостаточности поджелудочной железы посредством комбинации панкреатина в энтеросолюбильной оболочке и ингибитора протонной помпы // Клинические перспективы гастроэнтерологии, гепатологии. 2010, № 2, с. 1–5.
- Топчий Н. В., Девятаева Ю. М. Оптимизация приема Омитокса при диспепсии // РМЖ. 2012, № 11, с. 542–548.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







