Содержание статьи
Введение
Современные трансплантационные технологии являются наиболее прогрессивными методами лечения больных с необратимой стадией хронических заболеваний жизненно важных органов и позволяют добиться оптимальной реабилитации пациентов, в значительной степени повысить уровень выживаемости, качество жизни и вероятность рождения ими здорового потомства. Значительную часть реципиентов трансплантатов солидных органов составляют женщины репродуктивного возраста, восстановление фертильности у которых является важным этапом медицинской и социальной реабилитации. В настоящее время имеются данные о более чем 14 000 родов у женщин с трансплантированными органами [1]. В связи с этим актуальны вопросы прегравидарной подготовки, ведения беременности и родов у таких пациенток.
Благоприятный исход беременности после трансплантации солидных органов наблюдается у 65–92% пациенток. Однако, учитывая коморбидный фон и необходимость перманентной иммуносупрессии, риски неблагоприятных акушерских событий, в т. ч. развития преэклампсии, задержки роста плода и преждевременных родов, значительно выше, чем в общей популяции [2].
Иммуносупрессивная терапия. Поддерживающая перманентная иммуносупрессивная терапия необходима для обеспечения максимальной функциональной способности трансплантата, что определяется адекватностью подавления аллоиммунного ответа, с одной стороны, и минимизацией риска побочных эффектов иммунодепрессантов — с другой. Оптимальный режим иммуносупрессивной терапии обеспечивается применением лекарственного мониторинга, позволяющего поддерживать терапевтический диапазон концентрации препарата. Наиболее распространенными иммуносупрессивными препаратами, применяемыми при беременности, являются производные циклоспорина и такролимуса (ингибитор кальциневрина по сравнению с циклоспорином характеризуется более лабильной фармакокинетикой).
Грудное вскармливание у реципиенток трансплантированных органов. Возможность безопасного грудного вскармливания у реципиенток недостаточно изучена и не рекомендуется пациенткам, принимающим иммуносупрессивные препараты, в т. ч. сиролимус, эверолимус и белатацепт. Однако за последние 25 лет в мире описано большое количество случаев грудного вскармливания у таких пациенток. В 2014 г. опубликованы данные о безопасности грудного вскармливания и быстром снижении концентрации иммуносупрессантов в крови новорожденных у реципиенток трансплантатов, получавших стандартные дозы преднизолона, азатиоприна, циклоспорина и такролимуса [3]. С одной стороны, любой иммуносупрессант потенциально небезопасен для новорожденного, с другой — установленные относительно небольшие количества препарата, передающиеся ребенку с грудным молоком, и малая частота побочных эффектов, о которых сообщают единичные публикации, указывают на то, что благоприятный эффект грудного вскармливания может превышать теоретические риски негативного влияния иммуносупрессантов [4].
Трансплантация почки и беременность
В литературе описано несколько тысяч беременностей у женщин с почечным трансплантатом, из которых около 90% завершились благополучно, в т. ч. при трансплантации почек реципиенткам с волчаночным нефритом. Однако полиморфизм патологических состояний трансплантата почки диктует необходимость тщательного контроля течения беременности, динамического мониторинга клинико-лабораторных показателей, проведения дифференциальной диагностики гестационных осложнений и, при необходимости, своевременной активной этиотропной или патогенетической терапии. Заболевания почек являются отягчающим фоном, однако прогноз в большей степени определяется патологией, непосредственно ассоциированной с беременностью, такой как преэклампсия, эклампсия, HELLP-синдром. Наиболее частыми коморбидными состояниями пациенток с почечным трансплантатом являются артериальная гипертензия, снижение скорости клубочковой фильтрации и почечная недостаточность, что нередко затрудняет своевременную диагностику тяжелых гестационных осложнений, в т. ч. преэклампсии [2, 5–7].
Клиническое наблюдение. Пациентка С., 31 год.
Данные анамнеза. С 2000 г. по поводу манифестации геморрагического васкулита с поражением кожи и почек проводилась патогенетическая терапия кортикостероидами (преднизолон 60 мг per os). В 2009 г. в связи с терминальной стадией хронической почечной недостаточности (ХПН) начато лечение программным гемодиализом (ПГД). В 2010 г. произведена трансплантация почки (ТП) матери. В 2013 г. после перенесенной ОРВИ и обострения хронического гломерулонефрита (морфологически — IgA-нефропатия) с быстрым прогрессированием ХПН начато лечение ПГД. Трансплантатэктомия не проводилась. В 2014 г. произведена повторная ТП. В 2015 г. в связи с развитием мочевого синдрома гломерулонефрита трансплантата (морфологически — IgA-нефропатия) проведена патогенетическая пульс-терапия преднизолоном (метипред 1500 мг) с положительным эффектом. В 2017 г. в связи с планированием беременности отменены ингибиторы ангиотензинпревращающего фермента и микофенолата мофетил. Начата иммуносупрессивная терапия азатиоприном.
В 2017 г. диагностирована беременность.
Течение беременности и родов. На учете в женской консультации — с 10–11-й нед. беременности. Ведение беременности осуществлялось совместно акушером-гинекологом и нефрологом с проведением мониторинга азотемических показателей, концентрации такролимуса в крови (рис. 1, 2), определения уровня маркеров преэклампсии (плацентарного фактора роста — PLGF, растворимой ФМС-подобной тирозинкиназы — SFLT).
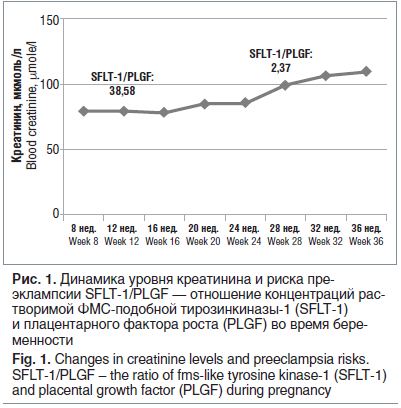
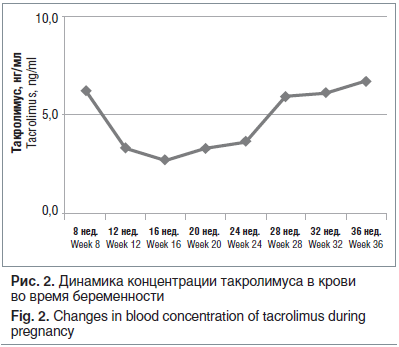
Пациентка родоразрешена на 38–39-й нед. беременности в плановом порядке путем кесарева сечения совместной бригадой врачей акушеров и урологов. Родился доношенный мальчик весом 2730 г, рост 49 см, оценка по шкале Апгар 7–9 баллов. Находится на искусственном вскармливании. При обследовании родильницы в течение последующих месяцев дисфункция трансплантата не выявлена.
Трансплантация печени и беременность
Беременные с трансплантированной печенью, как правило, высокотолерантны к гестационным осложнениям, в первую очередь к развитию преэклампсии, и имеют более благоприятный перинатальный исход по сравнению с реципиентками почки. Иммуносупрессивный фон у данных пациенток более благоприятный, т. к. терапия обычно включает только один лекарственный препарат, что уменьшает риск инфекционных осложнений. К группе высокого потенциального риска дисфункции трансплантированной печени и неблагоприятного перинатального исхода следует отнести беременных, у которых трансплантация проведена в связи с вирусным гепатитом В.
Беременность на фоне наличия печеночного трансплантата может сопровождаться тромбоцитопенией, умеренным повышением уровней печеночных трансаминаз, билирубина, снижением альбумина. Наиболее частое осложнение у реципиенток с трансплантированной печенью по сравнению с реципиентами других органов — холестаз беременных [8–10].
В ГБУЗ «ГКБ № 52 ДЗМ» за 2018–2019 гг. родоразрешены 2 пациентки с трансплантатами печени. Течение беременности и родов прошло без осложнений.
Клиническое наблюдение. Пациентка Л., 37 лет.
Данные анамнеза. В 1990 г. впервые манифестировала желтуха неинфекционной этиологии, разрешившаяся на фоне инфузионной и гормональной терапии в течение 1 мес. С 1991 г. впервые манифестировал инсулинозависимый сахарный диабет. В 1995 г. выставлен диагноз: цирроз печени в исходе аутоиммунного тиреоидита. Портальная гипертензия III степени. Гепатоспленомегалия. Гиперспленизм. Тромбоцитопения. Сахарный диабет 1 типа. Медикаментозный синдром Иценко — Кушинга (длительный прием глюкокортикостероидов). Остеопения. В 2013 г. выполнена ортотопическая трансплантация печени с сохранением ретропеченочного отдела нижней полой вены.
Первая беременность в 2003 г. закончилась абортом по медицинским показаниям в сроке 7–8 нед. Вторая беременность в 2006 г. закончилась преждевременными родами в сроке 34 нед. путем кесарева сечения по поводу тяжелой преэклампсии. Родилась живая недоношенная девочка весом 2000 г, рост 45 см. Постнатальный исход благоприятный. В 2003–2007 гг. дважды проводилось лигирование вен пищевода по поводу кровотечения. Третья беременность — желанная, наступила сразу после отмены барьерной контрацепции.
Течение беременности и родов. Ведение беременности осуществлялось акушером-гинекологом совместно с гепатологом ФГБУ «НЦАГиП им. В.И. Кулакова» и эндокринологом ГБУЗ «ГКБ № 52 ДЗМ» на фоне тщательного динамического наблюдения, постоянного контроля клинико-лабораторных параметров. Беременная принимала такролимус 7 мг/сут под контролем концентрации препарата в крови (контроль осуществлялся в МГНЦ ГБУЗ «ГКБ № 52 ДЗМ») и получала инсулинотерапию по базовому профилю.
Беременность протекала без осложнений. В сроке 37 нед. произведено плановое кесарево сечение. Родился живой доношенный мальчик весом 3160 г, рост 50 см. На 7-е сут мама и ребенок выписаны домой в удовлетворительном состоянии.
Трансплантация легких и беременность
Трансплантация легких является признанным методом лечения терминальных стадий болезней легких с исчерпанным медикаментозным ресурсом лечения, в т. ч. с идиопатической легочной гипертензией (ИЛГ).
ИЛГ (болезнь Аэрза, синдром Эскудеро, черный цианоз) — это заболевание неизвестной этиологии, характеризующееся выраженным повышением общего легочного сосудистого сопротивления и давления в легочной артерии, прогрессирующим течением и быстрым развитием правожелудочковой недостаточности с неблагоприятным прогнозом выживаемости. По данным ВОЗ, ИЛГ относится к одним из самых редких заболеваний сердечно-сосудистой системы в мире с популяционной частотой не более 1–2 случаев на 1 млн населения в год и занимает 7-е место в списке показаний к трансплантации легких. ИЛГ может возникнуть в любом возрасте независимо от пола. Наиболее часто дебют заболевания у женщин отмечается в 20–30 лет, а причиной смерти в 47% случаев является правожелудочковая сердечная недостаточность и у 26% больных — внезапная остановка сердца.
В 1996–2016 гг. частота операций по трансплантации легких в мире выросла с 1297 до 4661 в год. Беременность после трансплантации является актуальной проблемой, т. к. треть реципиентов легких составляют женщины, 75% из которых находятся в репродуктивном возрасте. Возможность проведения трансплантации легких позволила увеличить выживаемость пациенток, качество жизни и вероятность успешной беременности. В мире за 1991–2017 гг. успешно проведено 44 беременности, в т. ч. многоплодные, от которых родились 46 детей [11, 12].
Беременность после трансплантации легких сопровождается высоким риском материнской и перинатальной заболеваемости и смертности и требует мультидисциплинарного подхода к ведению и родоразрешению. Частота случаев отторжения трансплантата легких у беременных составляет 16–36%, что достоверно выше по сравнению с частотой отторжения трансплантатов других органов, в т. ч. сердца (9–20%), печени (4,5–10%) и почек (1–9%). В структуре осложнений беременности у реципиенток с трансплантатом легких частота самопроизвольного выкидыша составляет 28%, гестационной артериальной гипертензии — 53,3%, преждевременных родов — более 50% (средний срок 33,9 нед.). При этом риск материнской смертности превышает 16% [1].
Клиническое наблюдение. Пациентка К., 27 лет.
Данные анамнеза. В 2013 г. через год после первых родов диагностирована ИЛГ. Консервативная терапия (силденафил) — без эффекта. В 2015 г. выполнена трансплантация легких. Послеоперационный период осложнился тяжелой первичной дисфункцией трансплантатов, острой почечной недостаточностью и формированием гемоторакса справа, что потребовало проведения реторакотомии, санации плевральной полости и гемодиализа. Назначена пожизненная иммуносупрессивная терапия.
Первая беременность — в 2010 г., неразвивающаяся, в 6–7 нед. произведен медикаментозный аборт без осложнений. Вторая беременность в 2013 г. закончилась своевременно рождением мальчика весом 3400 г, рост 52 см, без осложнений. Третья беременность в 2017 г. прервана по медицинским показаниям до 12 нед. (в связи с приемом иммуносупрессанта сертикана, обладающего тератогенным эффектом).
В 2018 г. наступила запланированная беременность.
Течение беременности и родов. На учете в женской консультации при ГКБ № 52 — с 7–8-й нед. беременности. Ведение беременности осуществлялось совместно акушером-гинекологом, трансплантологом, нефрологом, терапевтом. Беременность осложнилась угрожающим выкидышем в I триместре, анемией легкой степени. Проводилось лечение угрожающего выкидыша производными прегнена, антианемическая и комбинированная иммуносупрессивная терапия: кортикостероиды (метилпреднизолон 4 мг/сут), ингибитор кальциневрина (такролимус 4 мг/сут). Иммуносупрессия корригировалась на основании оценки концентрации такролимуса в крови (рис. 3). Целевой уровень концентрации такролимуса — 8–10 нг/мл.
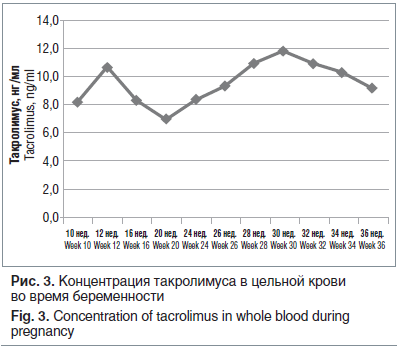
В 32–33 нед. гестации перенесла ОРВИ и левосторонний отит с последующим развитием одышки при незначительной физической нагрузке.
Результаты динамической оценки функции внешнего дыхания: снижение объема форсированного выдоха в I триместре беременности с прогрессирующим снижением на 3,4% от стартового уровня в 38 нед. беременности.
Результаты трансторакальной эхо-кардиографии: нарушений функции миокарда, признаков легочной гипертензии не выявлено.
В 37–38 нед. беременности, учитывая доношенный срок беременности, удовлетворительное состояние трансплантата, консилиум в составе врачей акушеров-гинекологов, трансплантологов, анестезиологов-реаниматологов, неонатологов принял решение о проведении операции кесарева сечения. Метод обезболивания — спинально-эпидуральная анестезия. Извлечена доношенная девочка весом 2590 г, рост 48 см, оценка по шкале Апгар 8–9 баллов. Ранний неонатальный период протекал удовлетворительно, с искусственным вскармливанием. Уровень такролимуса в крови у ребенка в раннем неонатальном периоде более чем 3-кратно снизился в течение первых 5 сут жизни (рис. 4).
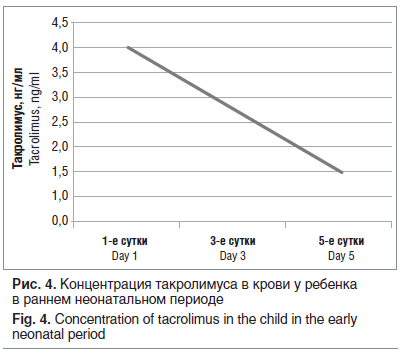
В связи с высоким риском отторжения трансплантата родильнице в послеродовом периоде проведена индивидуальная коррекция иммуносупрессанта (такролимуса). Выписана домой с ребенком в удовлетворительном состоянии на 7-е сут после родоразрешения.
Заключение
Международный и собственный опыт ведения беременности у женщин с трансплантированными органами позволяет утверждать, что благополучное завершение беременности возможно при тщательном контроле функции трансплантата, состояния беременной реципиентки солидного органа и плода на протяжении всего периода гестации. Одним из важнейших критериев успешной беременности и благоприятного перинатального исхода у женщин с трансплантированным солидным органом следует считать интервал после трансплантации не менее 1 года, в течение которого, как правило, достигается оптимальный уровень иммуносупрессии, обеспечивающий стабильную функцию трансплантата, отсутствие или малую выраженность дисфункции других органов и минимальный риск инфекционных осложнений. Пациентам после трансплантации нередко проводится 2–3-компонентная иммуносупрессивная терапия. В связи с этим при планировании беременности необходима минимизация иммуносупрессоров и отмена тератогенных препаратов. При ведении беременности необходимы динамический контроль и своевременная коррекция дозы иммуносупрессоров. Концентрацию в крови ингибиторов кальциневрина (циклоспорина, такролимуса) снижают с увеличением срока гестации и с целью профилактики развития дисфункции или отторжения трансплантата. Во время беременности рекомендуется перманентная коррекция дозы в соответствии с концентрацией иммуносупрессивного препарата в крови.
На основании вышесказанного можно сделать следующие выводы.
После трансплантации необходима контрацепция с последующим планированием беременности.
Ключевым компонентом в подготовке к беременности является стабильная функция трансплантата в течение 1 года — 2 лет.
Беременность у реципиенток трансплантатов находится в зоне высокого риска, что требует междисциплинарного подхода к ведению и родоразрешению в специализированном многопрофильном медицинском учреждении, имеющем специалистов с опытом ведения больных после трансплантации и владеющих методами оказания высокотехнологичной лечебной и диагностической помощи.
Беременность пациенткам с аллотрансплантатом почки не противопоказана при соблюдении следующих условий: 1) отсутствие или минимальная протеинурия; 2) управляемая артериальная гипертензия; 3) отсутствие нарушений уродинамики трансплантата; 4) нормальная скорость клубочковой фильтрации (креатинин крови <2,0 мг/дл, оптимально <1,4 мг/дл); 5) низкие дозы иммуносупрессантов: преднизолон ≤15 мг/сут, азатиоприн ≤2 мг/кг/сут, циклоспорин <5 мг/кг/сут.
Адекватно подобранная иммуносупрессивная терапия в течение беременности не оказывает тератогенного действия на плод, не вызывает задержку роста плода, а также обеспечивает удовлетворительную функцию трансплантата, не увеличивая риск отторжения.
Беременность у реципиенток трансплантатов солидных органов при отсутствии признаков дисфункции трансплантата целесообразно пролонгировать до доношенного срока.
До настоящего времени дискутабельным остается вопрос о целесообразных сроках и методе родоразрешения, необходимости индукции родов при трансплантированных органах, а также безопасности грудного вскармливания.
Сведения об авторах:
1Лысенко Марьяна Анатольевна — д.м.н., главный врач, ORCID iD 0000-0002-2636-2558;
1Артюхина Людмила Юрьевна — к.м.н., заведующая нефрологическим отделением № 1, ORCID iD 0000-0003-3353-1636;
1Кокая Инга Юрьевна — к.м.н., заведующая родильным домом, ORCID iD 0000-0002-0637-1537;
2Козлов Павел Васильевич — д.м.н., профессор кафедры акушерства и гинекологии лечебного факультета, ORCID iD 0002-9916-6128;
1Осокин Иван Павлович — заведующий отделением патологии беременности, ORCID iD 0000-0003-2957-7236.
1ГБУЗ «ГКБ № 52 ДЗМ». 123182, Россия, г. Москва, ул. Пехотная, д. 3.
2ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
Контактная информация: Козлов Павел Васильевич, e-mail: drkpv@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 25.10.2019.
About the authors:
1Mariana A. Lysenko — MD, PhD, the Head Doctor, ORCID iD 0000-0002-2636-2558;
1Ludmila Yu. Artyukhina — MD, PhD, Head of the Department of Nephrology, ORCID iD 0000-0003-3353-1636;
1Inga Yu. Kokaya — MD, PhD, Head of the Maternity Hospital, ORCID iD 0000-0002-0637-1537;
2Pavel V. Kozlov — MD, PhD, Professor of the Department of Obstetrics and Gynecology, ORCID iD 0000-0002-9916-6128;
1Ivan P. Osokin — MD, Head of the Department of Pathological Pregnancy, ORCID iD 0000-0003-2957-7236.
1City Clinical Hospital No. 52. 3, Pehotnaja str., Moscow, 123182, Russian Federation.
2Pirogov Russian National Research Medical University. 1, Ostrovitianov str., Moscow, 117997, Russian Federation.
Contact information: Pavel V. Kozlov, e-mail: drkpv@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 25.10.2019.
Информация с rmj.ru






