Материал и методы: в исследование на проспективной основе включено 103 больных с ОКСбпST и поражением ПНА, которым проводилось инвазивное лечение: 63 человека (61,2%) — с АКШ и 40 человек (38,8%) — с ЧКВ, разделенные на 2 группы. Реваскуляризация проводилась на базе КОГБУЗ КОКБ г. Кирова. Перед инвазивным/оперативным лечением оценивались: клиническое течение заболевания, коморбидность, суммарный кардиоваскулярный риск до ОКСбпST, показатели по шкалам: Euroscore II, SYNTAX, показатели эхокардиоскопии. Конечными точками исследования стали смерть, инфаркт миокарда, ассоциированный с АКШ/ЧКВ, острое нарушение мозгового кровообращения / транзиторная ишемическая атака, послеоперационные осложнения. Конечные точки оценивались в период от госпитализации в региональный сосудистый центр до окончания периода долечивания в центре реабилитации.
Результаты исследования: различий между группами по полу и возрасту не было. Статистически значимые различия отмечались по шкале SYNTAX (p0,05). У пациентов с изолированными стенозами проксимального отдела ПНА от 50 до 80% при технической возможности выполнения предпочтение отдавалось ЧКВ. При стенозах от 90% и более решение принималось исходя из клинического состояния пациента (неоднократное рецидивирование болевого синдрома, нестабильность показателей гемодинамики).
Выводы: у пациентов с устьевым поражением ПНА, гемодинамически значимыми мультисосудистыми стенозами, поражением ствола левой коронарной артерии более 50%, протяженными стенозами ПНА предпочтительнее проводить АКШ (p
Ключевые слова: ишемическая болезнь сердца, атеросклероз, коронарные артерии, стентирование, аорто-коронарное шунтирование, передняя нисходящая артерия, сердечно-сосудистые заболевания.
Для цитирования: Колупаев А.Н., Мальчикова С.В. Оценка ранних результатов реваскуляризации у больных с острым коронарным синдромом без подъема сегмента ST с поражением проксимальной трети передней нисходящей артерии, включая изолированные и мультисосудистые стенозы // РМЖ. 2018. №6(I). С. 19-24
Kolupaev A.N., Malchikova S.V.
Kirov State Medical University
Aim: to evaluate and compare the immediate results of percutaneous coronary intervention (PCI) and aortic coronary artery bypass graft (CABG) in patients with non-ST elevation acute coronary syndrome (NSTE-ACS) with proximal left anterior descending (LAD) coronary artery disease.
Patients and Methods: 103 patients with NSTE-ACS with proximal LAD coronary artery disease were included in the study on a prospective basis. The patients received the invasive treatment: coronary artery bypass grafting (CABG) — 63 patients (61.2%) and percutaneous coronary intervention (PCI) — 40 patients (38.8%). They were divided into two groups, respectively. Revascularization was carried out on the basis of the Kirov Regional Clinical Hospital. Prior to invasive / operative treatment, the clinical course of the disease, comorbidity, total cardiovascular risk before NSTE-ACS, scores on scales Euroscore II, SYNTAX, and echocaridioscopic parameters were evaluated. The endpoints of the study were death, myocardial infarction associated with СABG/PCI, acute cerebrovascular accident / transient ischemic attack, postoperative complications. Endpoints were evaluated during the period from hospitalization to the regional vascular center until the end of the period of treatment in the rehabilitation center.
Results: there was no difference between the groups by sex and age. Statistically significant differences were in the SYNTAX scale (p <0.05), the time of surgical treatment (p <0.01). There were no statistically significant differences between the groups by end points (p> 0.05). When it was technically possible, in patients with isolated stenoses of the proximal LAD coronary artery disease of 50–80%, PCI was preferred. With stenoses from 90% or more, the decision was made based on the clinical condition of the patient — repeated recurrence of pain syndrome, unstable hemodynamic parameters.
Conclusions: CABG (р<0.01) is prefferable in patients with proximal LAD disease with ostial lesion of LAD, hemodynamically significant multivessels defeat, stenosis of trunk of left coronary artery of more than 50%, extended stenosis of LAD.
The choice of the revascularization method in this category of patients should be determined by a cardio team based on the application of stratification scales in the aggregate, and integrated approach.
Key words: coronary heart disease, atherosclerosis, coronary arteries, stenting, aortic coronary artery bypass graft, anterior descending artery, cardiovascular diseases.
For citation: Kolupaev A.N., Malchikova S.V. Evaluation of early results of revascularization in patients with non-ST elevation acute coronary syndrome with proximal left anterior descending coronary artery disease, including isolated and multivessel stenoses // RMJ. 2018. № 6(I). P. 19–24.
В статье представлены результаты исследования по оценке ранних результатов реваскуляризации у больных с острым коронарным синдромом без подъема сегмента ST с поражением проксимальной трети передней нисходящей артерии, включая изолированные и мультисосудистые стенозы. Показано, что выбор метода реваскуляризации у данной категории пациентов должен определяться кардиокомандой на основании применения стратификационных шкал в совокупности, а также комплексного подхода.
Содержание статьи
Введение
В подавляющем большинстве случаев в основе течения такого заболевания, как ишемическая болезнь сердца (ИБС) лежит морфологический субстрат — стенозирующий атеросклероз коронарных артерий (КА). У значительной части больных консервативная терапия не приводит к необходимому результату, что заставляет прибегать к интервенционному/оперативному лечению, которое механически восстанавливает кровоток [1]. Восстановление нормальной проходимости коронарных сосудов на сегодняшний день является основным патогенетическим методом лечения ИБС, позволяющим улучшить качество жизни и благоприятно повлиять на отдаленный прогноз у данной категории больных. Эндоваскулярные методы реваскуляризации наряду с оперативным лечением благодаря патогенетическому характеру вмешательства получили широкое распространение в современной кардиологической практике. Формирование лучшего варианта реваскуляризации для конкретного пациента нередко требует сотрудничества кардиологов, кардиохирургов и других консультирующих специалистов при необходимости [2].
По мере улучшения технического оснащения отделений и накопления опыта данные методы заняли лидирующие позиции в терапии ИБС [3]. Особенно это касается нестабильных сердечно-сосудистых катастроф. Долгое время считалось, что острый коронарный синдром (ОКС) — это самостоятельный синдром, занимающий промежуточное положение в иерархии клинических проявлений ИБС между стабильной стенокардией и инфарктом миокарда (ИМ). Однако в основе этого синдрома лежат те же патофизиологические механизмы, что и при ИМ: надрыв нестабильной атеросклеротической бляшки с последующим тромбозом и различной степенью выраженности клинического течения заболевания [4]. Наиболее частая форма манифестации ОКС — ОКС без подъема сегмента ST (ОКСбпST), заболеваемость и смертность при котором также сохраняются на высоком уровне и сопоставимы с таковыми при ОКС с подъемом сегмента ST (ОКСпST). Эта категория пациентов представляет собой одну из наиболее сложных для выбора оптимальной тактики лечения.
Пациенты с ОКСбпST с такими осложнениями, как гемодинамическая нестабильность или кардиогенный шок, рецидивирующая или продолжающаяся боль в грудной клетке, резистентная к терапии, жизнеугрожающие аритмии или остановка сердца, механические осложнения ОКС, острая сердечная недостаточность с рефрактерной стенокардией или отклонением сегмента ST, повторные динамические изменения сегмента ST или зубца Т, особенно с преходящей элевацией сегмента ST, представляют собой группу очень высокого риска. Им необходимо проведение экстренной коронароангиографии (КАГ) — в период менее 2 ч от появления симптомов [5]. Несомненно, сроки ранней КАГ и, при необходимости, реваскуляризации должны зависеть от стратификации риска на основе шкалы GRACE или определяться исходя из наличия критериев высокого риска для инвазивного лечения. Преимущества инвазивной стратегии в течение 24 ч у пациентов высокого риска очевидны. Исследование TIMACS показало на 38% меньшую частоту смерти, ИМ и инсульта в течение 6 мес. у такой категории пациентов [6, 7]. Поражение передней нисходящей артерии является наиболее частой причиной симптом-зависимого стеноза (как при ОКСпST, так и при ОКСбпST) — около 40% пациентов [7–12].
На сегодняшний день нет четких рекомендаций и остается много вопросов относительно выбора стратегии прямой реваскуляризации миокарда у больных с ОКСбпST, имеющих одно- или мультисосудистое (МС) поражение КА: чрескожное коронарное вмешательство (ЧКВ) со стентированием симптом-связанной артерии, стентирование нескольких артерий при МС поражении, выполнение коронарного шунтирования (КШ), гибридная реваскуляризация, сроки инвазивного лечения. У трети пациентов с ОКСбпST выявляются изолированные стенозы, коррекция которых происходит одномоментно, примерно у половины пациентов — МС поражения. Соотношение пациентов, которым подходило инвазивное лечение — операция КШ и ЧКВ, при МС поражениях составляло 20% и 80% соответственно [13]. Решение кардиокоманды должно быть принято как можно быстрее, с учетом клинического состояния пациентов и анатомии коронарных сосудов [14].
Цель исследования: оценить и сравнить непосредственные результаты реваскуляризации миокарда (ЧКВ/КШ) у пациентов, перенесших ОКСбпST, у которых по данным КАГ выявлен стеноз проксимальной трети передней нисходящей артерии (п/3 ПНА) как изолированное поражение или часть МС поражения.
Материал и методы
С января по декабрь 2016 г. было отобрано 103 пациента с ОКСбпST, которым впоследствии было проведено инвазивное/оперативное лечение, средний возраст пациентов составил 61,0±8,5 года (68,93% мужчин и 31,07% женщин). Критерии включения: поражение п/3 ПНА как изолированное или часть МС поражения по данным КАГ. Критерии исключения: пациенты, которым ранее была проведена оперативная реваскуляризация (КШ, гибридная реваскуляризация) п/3 ПНА.
Больные наблюдались в 2 группах в соответствии с выбранным методом реваскуляризации. Одной группе выполнялась операция КШ, другой — ЧКВ. Эндоваскулярное лечение и оперативное вмешательство проводились на базе регионального сосудистого центра (РСЦ) КОГБУЗ КОКБ г. Кирова. Конечными точками исследования стали смерть, ИМ, ассоциированный с АКШ/ЧКВ, острое нарушение мозгового кровообращения / транзиторная ишемическая атака (ОНМК/ТИА), послеоперационные осложнения. Конечные точки оценивались в период от госпитализации в РСЦ по поводу ОКСбпST до окончания госпитального периода долечивания в центре реабилитации.
Инвазивная КАГ выполнена на современных ангиографических комплексах Philips Allura 2000 и GE Innova 3100 IQ опытными рентгенхирургами КОКБ. Ежегодно в отделении выполняется до 2500 диагностических процедур
и до 500 высокотехнологичных лечебных интервенций. Эхокардиоскопия выполнена с помощью ультразвукового сканера Vivid E9 GE Healthcare с допплером.
Каждая из групп пациентов оценивалась по риску неблагоприятного исхода и определения показаний к активной инвазивной тактике при ОКС, на основании шкалы ангиографической характеристики коронарного русла SYNTAX. Шкала была разработана для оценки анатомически сложных поражений КА у больных со стенозом ствола левой КА и МС поражением КА. Подсчет баллов проводился в несколько этапов. Первый этап — это определение типа коронарного кровоснабжения. Второй этап — оценка сегментарного поражения КА, которое напрямую влияет на суммарный балл, а каждому сегменту КА назначается весовой коэффициент в зависимости от его расположения — от 0,5 (за дистальные сегменты) до 6 (за стеноз ствола ЛКА при левом типе). Третий этап — оценка диаметра стеноза, а в случае окклюзии — баллы за ее особенности. Следующие этапы: оценка три- и бифуркационных стенозов; аорто-остиальное поражение КА; наличие сильных извитостей КА; определение длины стеноза, кальцификации и наличия тромбоза. Завершающий этап — определение наличия диффузно пораженных и суженных сегментов дистальнее стеноза, т. е. не менее 75% длины артерии дистальнее стеноза имеет диаметр
Группа пациентов, которым было проведено КШ, также оценивалась на основании шкалы EuroScore 2. Это шкала для оценки риска неблагоприятного (летального) исхода в периоперационном периоде КШ на сердце. Она основана на следующих показателях: пол, возраст, клиренс креатинина, экстракардиальная артериопатия (хромота, каротидная окклюзия или стеноз > 50%, ампутация, предыдущее или запланированное вмешательство на брюшной аорте, артериях конечностей или сонных артериях), тяжелое ухудшение подвижности (дисфункция опорно-двигательного аппарата или неврологическая дисфункция), хроническая болезнь легких (долгосрочное использование бронходилататоров или стероидов для лечения заболеваний легких), активный эндокардит (пациент все еще на лечении антибиотиками при эндокардите во время операции), желудочковая тахикардия или фибрилляция желудочков, предоперационный сердечный массаж, предоперационная вентиляция легких перед анестезией, предоперационные инотропы, предоперационная острая почечная недостаточность (анурия или олигурия
Статистическая обработка полученных данных проводилась в программе STATISTICA 10.0. Для оценки характера распределения в совокупности по выборочным данным использовали тест Колмогорова — Смирнова. Результаты представлены как среднее и стандартное отклонение (М±SD). Количественные данные из совокупностей с нормальным распределением сравнивались с помощью t-критерия Стьюдента для независимых выборок. Сравнение количественных данных из совокупностей с распределением, отличающимся от нормального, проводилось с применением критерия Манна — Уитни. Сравнение качественных величин проводилось с использованием критерия χ2 с поправкой Йетса. Статистически значимыми считали различия при p
Результаты
В группу КШ было включено 63 (61,17%) пациента, в группу ЧКВ — 40 (38,83%) больных. Средний возраст в группах составил 61,7±7,8 и 60,7±9,7 года соответственно (р>0,05). В группе КШ мужчин было 63,5%, женщин — 36,5%, в группе ЧКВ — 77,5% мужчин и 22,5% женщин (р>0,05). В таблице 1 представлена клиническая характеристика больных до поступления в РСЦ.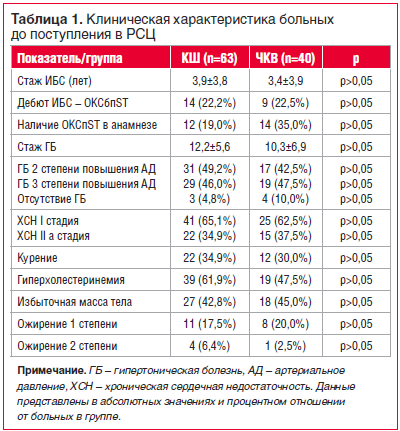
Как видно из таблицы 1, различий в 2 группах по признакам не было. Обращает на себя внимание тот факт, что 20,9% и 22,5% больных (в группах КШ и ЧКВ соответственно) имели анамнез ИБС более 10 лет. В течение этого времени до ОКС стенокардия напряжения у всех больных сохранялась на уровне 2 функционального класса — болевой синдром возникал при быстрой ходьбе или подъеме по лестнице, ходьбе в гору, ходьбе или подъеме по лестнице после еды, при холодном ветре, эмоциональном стрессе. У курящих пациентов (34,9% и 30,0% в группах КШ и ЧКВ соответственно) стаж курения составил более 15 лет.
До поступления в РСЦ полную базисную терапию ИБС (ингибитор ангиотензинпревращающего фермента, бета-блокатор, статин, ацетилсалициловая кислота) получали 23 (36,5%) и 20 (50,0%) пациентов в группах КШ и ЧКВ соответственно (p>0,05).
В структуре диагноза ОКСбпST выделялись: прогрессирующая стенокардия, впервые возникшая стенокардия, ИМбпST. В группе КШ преобладали больные с ИМбпST (52,4%), в группе ЧКВ — пациенты с прогрессирующей стенокардией (57,5%) (табл. 2). Значимые различия в обеих группах наблюдались лишь по количеству пациентов с прогрессирующей стенокардией. Суммарный кардиоваскулярный риск (СКР) в 87,3% и 87,5% случаев в группах КШ и ЧКВ соответственно определялся как очень высокий.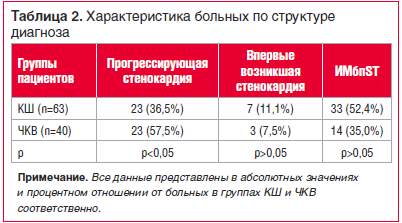
В структуре коморбидной патологии были выделены: гипертоническая болезнь, сахарный диабет 2 типа (СД 2 типа), нарушения ритма сердца (НРС) в виде фибрилляции предсердий (ФП), желудочковых экстрасистолий (ЖЭС) высоких градаций (4 А по Лауну и выше), гемодинамически значимый атеросклероз периферических артерий (в т. ч. стенозы общей / внутренней сонной артерии более 50%, хроническая артериальная недостаточность артерий нижних конечностей 2 Б и более), перенесенное нарушение мозгового кровообращения (НМК) или ТИА, персистирующее течение бронхиальной астмы (БА). Данные представлены в таблице 3.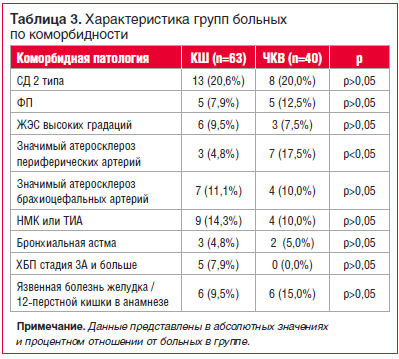
Статистически значимые различия между группами были только по наличию у пациентов значимого атеросклероза периферических артерий (4,8% и 17,5% для групп КШ и ЧКВ соответственно). По наличию остальных нозологий различий между группами не было.
Обе группы характеризовались высоким риском неблагоприятных сердечно-сосудистых катастроф, т. к. все пациенты, включенные в исследование, имели первичный критерий для раннего инвазивного лечения (динамические изменения сегмента ST / зубца Т на электрокардиограмме).
При проведении интервенционной КАГ в группе КШ оценка по шкале SYNTAX составила 18,6±7,0 баллов, для группы ЧКВ — 9,9±3,9 балла (p
Группы статистически значимо различались по таким показателям, как значимое поражение ствола ЛКА (pad hoc выполнялось исходя из клинического состояния пациента: неоднократное рецидивирование болевого синдрома, нестабильность показателей гемодинамики. В то же время обращает на себя внимание развитие мощных коллатералей в группе КШ у пациентов с МС поражением, которые обеспечивали хорошее ретроградное заполнение кровотока ниже места значимого стеноза КА. В 22,2% случаев были сформированы значимые перетоки между бассейнами левой и правой КА (табл. 4).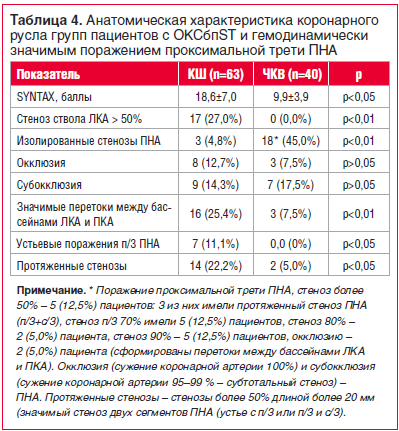
Большинство данных представлено в таблице 4 в абсолютных значениях и процентном отношении от больных в группах КШ и ЧКВ соответственно, где n — количество больных в группе.
Всем пациентам из группы КШ риск неблагоприятных исходов оперативного лечения был подсчитан также по шкале EuroScore 2. Показатели в среднем составили 1,25±0,58%, что оценивается как средний риск развития летального исхода в периоперационном периоде.
По показателям ФВ ЛЖ при проведении дооперационной эхокардиоскопии (Эхо-КС) группы оказались сопоставимы (р=0,55), для группы КШ ФВ ЛЖ по Симпсону составила 59,3±7,8%, для группы ЧКВ — 58,1±7,1%. По всем остальным показателям, представленным в таблице 5, различий между группами также не было. Тяжелая клапанная патология (стеноз или недостаточность 2 степени и выше, требовавшие хирургической коррекции) отсутствовала у пациентов обеих групп.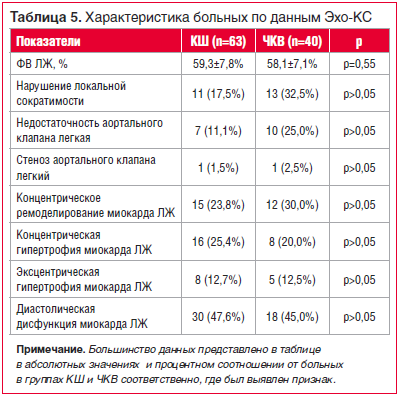
Сроки оперативного лечения в группе КШ составляли в среднем 18,03±7,8 дня, в группе ЧКВ — 7,2±7,9 дня (р
В группе КШ все больные подвергались операции маммарокоронарного шунтирования, аутовенозного КШ в условиях гипотермической перфузии и фармакохолодовой кардиоплегии. Данные о проведенных вмешательствах отражены в таблице 6.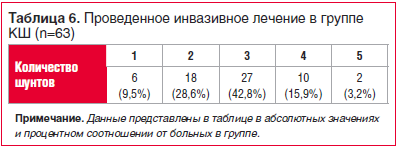
У большинства пациентов было выполнено шунтирование 3 сосудов (42,8%).
Все процедуры стентирования выполнены одномоментно ad hoc при проведении инвазивной КАГ. Как видно из таблицы 7, преобладало ЧКВ с проведением стентирования одного сосуда голометаллическим стентом.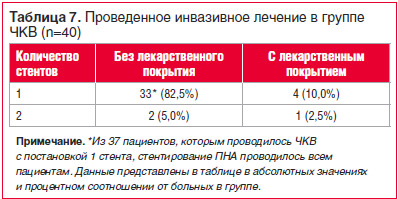
При сравнении одномоментного стентирования 2 артерий и двухсосудистого шунтирования предпочтение отдавалось оперативному лечению в 5,0% и 28,6% случаев для групп ЧКВ и КШ соответственно (р
После вмешательств при оценке непосредственных результатов отмечено, что частота ИМ, ассоциированного с реваскуляризацией, составила 3,2% (2 пациента) в группе КШ, в группе ЧКВ — 5% (р>0,05). Диагноз ассоциированного ИМ устанавливался на основании данных ЭКГ (отрицательная динамика сегмента ST), данных Эхо-КС после вмешательства (появление зон акинезии), показателей кардиоспецифических ферментов (оценивался количественный показатель тропонина, превышающий 0,3 нг/мл). Встречаемость геморрагических осложнений составила 3,2% в группе КШ (2 пациента), 0,0% — в группе ЧКВ (р>0,05). В группе КШ непосредственную роль сыграли несостоятельность шва и, как следствие, развитие гемоперикарда и гемоторакса в раннем послеоперационном периоде. Осложнения в виде НРС: ФП — 4,8%, желудочковая тахикардия — 1,6% в группе КШ, ФП — 2,5% в группе ЧКВ на сроке от 0 до 5 дней после оперативного вмешательства (p>0,05). После операции у 3,2% больных проводилась рестернотомия по поводу развития геморрагических осложнений в виде выраженного, нарастающего в динамике гемоторакса и гемоперикарда, в 1,6% случаев наблюдался осумкованный плеврит. Инфекционные осложнения в виде лихорадки (1,6% случаев) и развитие долевой пневмонии (3,2% случаев) были зарегистрированы у пациентов группы КШ, в группе ЧКВ осложнений такого характера зарегистрировано не было (p>0,05). Посткардиотомный синдром в группе КШ был представлен гидротораксом у 34,8% пациентов и гидроперикардом у 27,0% пациентов. Показатель летальности составил 1,6% в группе КШ, в группе ЧКВ умерших не было (р>0,05).
Выводы
В настоящее время решение о способе прямой реваскуляризации миокарда у исследуемой категории пациентов должно приниматься на основании применения шкал стратификации рисков и при комплексном подходе кардиокоманды. Анатомическая классификация по SYNTAX наиболее важна для выбора стратегии реваскуляризации. В нашей работе выявлено увеличение сроков ранних инвазивных вмешательств, что связано с территориальным фактором, а также с поздним обращением пациентов за медицинской помощью.
Группы пациентов КШ и ЧКВ не отличались по клиническим показателям, показателям Эхо-КС и по предшествующей ОКС базисной терапии ИБС. В плане коморбидной патологии статистически значимые различия были лишь в наличии значимого атеросклероза периферических артерий (р
Результаты исследования у больных со значимыми МС стенозами и поражениями ствола ЛКА более 50%, протяженными стенозами ПНА, устьевыми поражениями ПНА свидетельствуют о целесообразности проведения оперативного лечения — операции АКШ, что и было показано в исследовании.
В случае изолированных стенозов п/3 ПНА от 50% до 80% при технической возможности выполнения предпочтение отдавалось ЧКВ. При стенозах п/3 ПНА 90% и более ЧКВ ad hoc выполнялось исходя из клинического состояния пациента (неоднократного рецидивирования болевого синдрома, нестабильности показателей гемодинамики).
В шкалах для выявления ангиографического статуса не учитываются имеющиеся у больных значимые перетоки между бассейнами ЛКА и ПКА.
КШ обладает большим риском осложнений.
Литература
1. Карпов Ю. А., Самко А. Н., Буза В. В. Коронарная ангиопластика и стентирование. М.: МИА, 2010. C. 10–14 [Karpov Yu.A., Samko A. N., Buza V. V. Koronarnaya angioplastika i stentirovanie. M.: MIA, 2010. S. 10–14 (in Russian)].
2. Head S. J., Kaul S., Mack M. J. et al. The rationale for Heart Team decision-making for patients with stable, complex coronary artery disease // Eur Heart J. 2013. Vol. 34 (32). P. 2510–2518.
3. Савченко А. П., Черкавская О. В., Руденко Б. А., Болотов П. А. Интервенционная кардиология. Коронарная ангиография и стентирование: руководство. М.: ГЭОТАР-Медиа, 2010. C. 79 [Savchenko А.Р., Cherkavskaya O. V., Rudenko В. А., Bolotov Р. А. Intervencionnaya kardiologiya. Koronarnaya angiografiya i stentirovanie: rukovodstvо. M.: GEHOTAR-Media, 2010. S. 79 (in Russian)].
4. Волков В. С. Экстренная диагностика и лечение в неотложной кардиологии: руководство для врачей. М.: МИА, 2010. C. 163 [Volkov V. S. Ehkstrennaya diagnostika i lechenie v neotlozhnoj kardiologii: rukovodstvo dlya vrachej. M.: MIA, 2010. S. 163 (in Russian)].
5. Рекомендации ESC по ведению пациентов с острым коронарным синдромом без стойкого подъема сегмента SТ 2015 // Российский кардиологический журнал. 2016. № 3. С. 9–63 [Rekomendacii ESC po vedeniyu pacientov s ostrym koronarnym sindromom bez stojkogo pod»ema segmenta ST 2015 // Rossijskij kardiologicheskij zhurnal. 2016. № 3. S. 9–63 (in Russian)].
6. Рекомендации ESC/EACTS по реваскуляризации миокарда 2014 года // Российский кардиологический журнал. 2015. № 2. С. 5–81 [Rekomendatsii ESC/EACTS po revaskulyarizatsii miokarda 2014 godа // Rossijskij kardiologicheskij zhurnal. 2015. № 2. S. 5–81 (in Russian)].
7. Mehta S. R., Granger C. B., Boden W. E. et al. Early versus delayed invasive intervention in acute coronary syndromes // N Engl J Med. 2009. Vol. 360 (21). Р. 2165–2175.
8. Montalescot G., Bolognese L., Dudek D. et al. Pretreatment with prasugrel in non-ST-segment elevation acute coronary syndromes // N Engl J Med. 2013. Vol. 369 (11). P. 999–1010.
9. Kastrati A., Neumann F. J., Mehilli J. et al. Bivalirudin versus unfractionated heparin during percutaneous coronary intervention // N Engl J Med. 2008. Vol. 359 (7). P. 688–696.
10. Thiele H., Rach J., Klein N. et al. Optimal timing of invasive angiography in stable non-ST-elevation myocardial infarction: the Leipzig immediate versus early and late Percutaneous coronary intervention trial in NSTEMI (LIPSIA-NSTEMI trial) // Eur Heart J. 2012. Vol. 33 (16). P. 2035–2043.
11. Ndrepepa G., Mehilli J., Schulz S. et al. Patterns of presentation and outcomes of patients with acute coronary syndromes // Cardiology. 2009. Vol. 113 (3). P. 198–206.
12. Kerensky R. A., Wade M., Deedwania P. et al. Revisiting the culprit lesion in non-Q-wave myocardial infarction. Results from the VANQWISH trial angiographic core laboratory // J Am Coll Cardiol. 2002. Vol. 39 (9). P. 1456–1463.
13. Ben-Gal Y., Moses J. W., Mehran R. et al. Surgical vs. percutaneous revascularization for multivessel disease in patients with acute coronary syndromes: analysis from the ACUITY (Acute Catheterization and Urgent Intervention Triage Strategy) trial // JACC Cardiovasc Interv. 2010. Vol. 3 (10). Р. 1059–1067.
14. Palmerini Т. et al. Prognostic value of the SYNTAX score in patients with acute coronary syndromes undergoing percutaneous coronary intervention: analysis from the ACUITY (Acute Catheterization and Urgent Intervention Triage StrategY) trial // J Am Coll Cardiol. 2011. Vol. 57 (24). Р. 2389–2397.
15. Nashef S. A. et al. EuroSCORE II // Eur J Cardiothorac Surg. 2012. Vol. 41 (4). Р. 734–744.
16. Papadopoulou S. L. et al. CT-SYNTAX score: a feasibility and reproducibility Study // JACC Cardiovasc Imaging. 2013. Vol. 6 (3). Р. 413—415.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru