Вспомогательная иммунотерапия при ВПЧ-ассоциированных поражениях слизистых оболочек и кожи урогенитальной и перианальной локализации
М. Ю. Елисеева, кандидат медицинских наук
О. А. Мынбаев, доктор медицинских наук
МГМСУ, Москва
Лечение доброкачественных предраковых патологий шейки матки и наружных половых органов, ассоциированных с инфекцией, вызываемой вирусом папилломы человека (ВПЧ), является одной из сложных задач для практического врача, поскольку имеется высокий риск развития рака шейки матки (РШМ) и других злокачественных опухолей урогенитальных органов и прямой кишки. Более того, оно усложняется при наличии субклинической формы ВПЧ-инфекции или при ее сочетании с дисплазией легкой степени или симптомами хронического воспалительного процесса.
Традиционные методы лечения ВПЧ-ассоциированных заболеваний общеизвестны и включают крио-, электро- и лазерную хирургию, а также обработку очагов поражения цитотоксическими лекарственными препаратами, вызывающими цитолиз и некроз ткани или механическое удаление кондилом и бородавок. Все лечебные процедуры направлены на удаление доброкачественных и предраковых новообразований, инициированных ВПЧ.
Основным недостатком традиционных лечебных мероприятий является необходимость многократного повторения процедур (лазерная и криохирургия), высокая частота рецидивов заболевания, вариабельность лечебного эффекта, осложнения и побочные эффекты, что снижает параметры качества жизни больных. Это объясняется отсутствием патогенетического механизма воздействия на ВПЧ-инфекцию. Следует также отметить, что в большинстве случаев происходит спонтанное выздоровление у иммунокомпетентных индивидов. Имеются также данные об агрессивном течении ВПЧ-инфекции или ее тяжелой клинической манифестации у лиц с нарушениями в иммунной системе.
У здоровых индивидов ВПЧ в большинстве случаев протекает в субклинической форме. Применение травматичных методов для лечения субклинической формы ВПЧ-инфекции и легкой степени неоплазии считается нецелесообразным, поскольку трудно определить очаг инфекции. Более того, отсутствуют данные об эффективности лечения такой формы ВПЧ, как в плане течения инфекции у носителей ВПЧ, так и в плане снижения частоты трансмиссии ВПЧ к их половым партнерам. Существует мнение о неэффективности лечения при субклиническом и латентном течении ВПЧ-инфекции, которое не влияет ни на частоту, ни на тяжесть последующей манифестации ВПЧ-инфекции. С целью элиминации инфицированных ВПЧ-клеток проводится поиск лекарственных средств, активирующих иммунную систему хозяина. Для этой цели были использованы разнообразные иммуномодулирующие средства, как для местной аппликации, так и для системного применения.
Инозин пранобекс (ИП) состоит из двух компонентов: активный компонент — 1,9-дигидро-9-бета-D-рибофуранозило-6Н-пурин-6-OH; вспомогательный — соли 4-ацетамидобензойной кислоты с N, N-диметиламино-2-пропанолом. Считается, что второй компонент увеличивает доступность инозина для лимфоцитов. Повышенный интерес врачей к применению такого физиологичного иммуностимулятора, по-видимому, связан с тем, что ИП как метаболит пуринов полностью выводится через почки и не обладает плейотропными свойствами. Это отличает его от синтетических или рекомбинантных цитокинов.
В последние годы в нашей стране практические врачи начали применять ИП при различных заболеваниях, включая генитальный герпес, цитомегаловирусную, папилломавирусную инфекции и при других патологиях, таких как хламидиоз и уреаплазмоз.
Целью данного систематического обзора с элементами метаанализа явилось обобщение и сравнительная оценка результатов применения ИП при ВПЧ-ассоциированных заболеваниях слизистых оболочек и кожи урогенитальной и перианальной локализации с точки зрения доказательной медицины.
Материалы и методы исследования
В данный обзор были включены практически все доступные источники, в которых оценивалась эффективность лечения ВПЧ-ассоциированных поражений слизистой оболочки и кожи урогенитальной и перианальной локализации, с применением лекарственных аналогов ИП, в режимах моно- и комбинированной терапии (табл. 1) с и без плацебо-контроля или традиционными методами лечения (крио-, электро-, лазерная хирургия и локальная химическая деструкция). 6390 больных с ВПЧ-ассоциированными заболеваниями слизистой оболочки и кожи урогенитального тракта и перианальной области из 15 источников литературы были включены в наш проект. 2369 больным назначали ИП в моно и 3369 больным — в комбинированном режиме. Лечение плацебо назначалось 71 больному, а традиционные методы — 581 пациенту. Предметами анализа являлись: 1) эффективность (частота улучшения клинико-лабораторных параметров, выздоровление) или, наоборот, безуспешность лечения с использованием ИП в монорежиме или на фоне традиционных методов лечения; 2) отсутствие эффекта и частота рецидивов; 3) характер и частота побочных эффектов; 4) дизайн работы и качество описания результатов.

Результаты исследования
I. Систематический анализ индивидуальных источников
Анализ способов применения ИП при ВПЧ-ассоциированных поражениях слизистой оболочки и кожи урогенитальной и перианальной локализации свидетельствует о том, что ИП назначали по 3 г в день или из расчета 50 мг/кг массы тела, ежедневно в течение 5–84 дней (12 недель). При этом ИП давали как самостоятельное лечение в монорежиме или как вспомогательную терапию на фоне основного лечения с помощью традиционных методов (комби): деструкции ВПЧ-ассоциированных патологий (субклинические формы ВПЧ, остроконечные кондиломы, дисплазии шейки матки — CIN-I, II, III, вплоть до РШМ in situ), а также при рецидивах патологии шейки матки после первичных лечебных мероприятий (табл. 1).
Анализ эффективности лечения в индивидуальных источниках свидетельствует о том, что назначение ИП в качестве вспомогательной иммунотерапии сопровождалось существенным повышением эффективности в большинстве проанализированных работ (табл. 2). Несмотря на разнообразие манифестации ВПЧ-ассоциированной патологии (от ее субклинических форм до тяжелых форм дисплазии (CIN-III) и РШМ in situ, а также рецидивов патологии шейки матки) отмечен позитивный лечебный эффект с исчезновением ВПЧ при повторных анализах лабораторных исследований.

В программе «Астра» эффективность лечения субклинических форм ВПЧ-инфекции оценивали по исчезновению койлоцитов, и в этой подгруппе часть больных выпали в процессе оценки результатов исследования. В предыдущих сериях исследования Прилепская В. Н. и Роговская С. И., зафиксировав эффективность ИП в комбинированном режиме в 87,5% случаев, традиционных методов — в 65,5% и ИП в монорежиме — в 72,4%, отмечают «очищение от ВПЧ» соответственно в 65,5, 46,9 и 65,5% случаев в участках дисплазии шейки матки (LSIL). Эффективность иммунотерапии в плане полного исчезновения пораженных участков с аналогичной формой дисплазии (CIN-I и CIN-II) шейки матки по данным Потапова В. А. с соавт. составила 88,6%. При 6-месячном мониторинге рецидив наступил только в одном случае (2,6%), однако авторы не уточнили подгруппу, где наступил рецидив. Кедрова А. Г. с соавт. при дисплазиях различной степени (CIN-I-II-III) и РШМ in situ и их рецидивах в 77,8% наблюдений обнаружили исчезновения вирионов ВПЧ после первого курса лечения с ИП в образцах материалов, взятых из пораженных участков шейки матки, а повторные курсы ИП повышали эффективность такого подхода.
Подводя итоги кольпоскопического скрининга 640 женщин, Забелев А. В. с соавт. делились опытом применения иммуномодулирующих препаратов, включая ИП. Три курса монотерапии с ИП по 3 грамма в день в течение 5 дней, с интервалом в 1 месяц назначали 12 пациенткам с очагами дисплазии шейки матки различной степени без деструкции очагов поражения. Повторное лечение через 6 месяцев по мере необходимости. Эффективность лечения контролировалась с помощью повторной кольпоскопии и цитологического скрининга, проводимых через каждые 6 месяцев. По утверждению авторов по истечении года ни у одной из пациенток не было отмечено прогрессирования патологического процесса. Более того, у 25% женщин, получавших ИП, отмечен регресс и исчезновение атипичного эпителия. По аналогичной схеме ИП был назначен 62 пациенткам после деструкции патологического очага дисплазии шейки матки. При этом у 42 пациенток отмечалось сочетание ВПЧ и герпетической инфекции. По данным авторов рецидив патологии шейки матки, ассоциированной с ВПЧ, выявлен только у 1,6% пациенток.
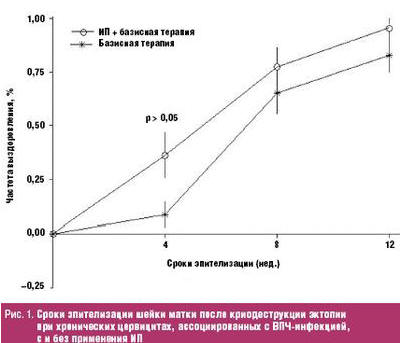
Анализ результатов Долгушиной В. Ф. с соавт. свидетельствует о том, что частота восстановления нормального эпителиального покрова влагалищной части шейки матки на четвертой неделе после криовоздействия с дополнительным применением ИП оказалась существенно и достоверно выше, чем при базисной терапии. В дальнейшем кривая динамики заживления в группе с применением ИП прогрессивно возрастала, достигая полной эпителизации в 72% случаев на 8-й неделе и в 95% наблюдений на 12-й неделе, что в какой-то степени превосходило аналогичные показатели в базисной группе — 65,2 и 82,6% случаев соответственно (рис. 1).
По данным Линаск Л. И. и Григорьевой Е. Е., полная элиминация ВПЧ после иммунотерапии в монорежиме ИП составила 95,3% и после комбинированной терапии — 96,8%, что подтверждено данными клинико-лабораторного исследования. Следует отметить, что при контрольном обследовании цервикальных мазков на онкоцитологию отмечено соответствие результатов во всех случаях классу I по Папаниколау у пациенток после вспомогательной иммунотерапии с ИП. В то же время у 13,1% пациенток после традиционных методов мазки соответствовали классу II по Папаниколау.
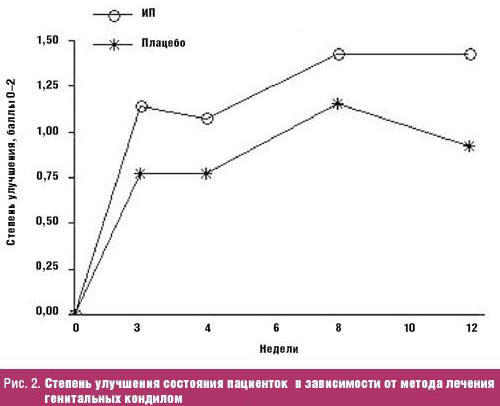
Для объективной визуализации степени улучшения результатов исследования Davidson-Parker et al. проведена статистическая обработка данных, где «превосходное улучшение» отмечали как 2 балла, улучшение — как 1, а отсутствие эффекта и первоначальное состояние — как 0. Графическое изображение степени улучшения в зависимости от метода лечения генитальных кондилом, полученного таким образом, представлено на рис. 2.
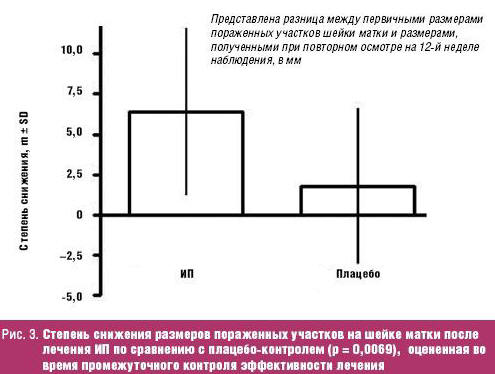
Результаты исследования Georgala et al. свидетельствуют о высокой эффективности применения ИП для лечения агрессивных форм генитальных кондилом как в плане наличия полного и частичного лечебного эффекта (p < 0,01), так и снижения размеров пораженного участка шейки матки (p =0,0069) на промежуточной точке отсчета результатов на 12-й неделе от начала лечения.
При этом степень снижения размеров пораженных участков шейки матки сократились на 52,9% после применения ИП, а после плацебо-контроля — только на 13,9% (рис. 3).
Углубленный анализ результатов исследования Mohanty и Scott показал, что эффективность ИП оказалась удовлетворительной при длительной манифестации генитальных кондилом, в среднем 39,2 ± 4,4 недели. В то же время применение традиционных методов оказалось более успешным при менее длительной манифестации генитальных кондилом, в среднем 12,6 ± 2,4 недели.
По результатам исследования Mohanty и Scott пришли к заключению, что хотя эффективность применения самого ИП не отличалась от таковой традиционной терапии, дополнение традиционной терапии с ИП существенно повысило эффективность лечения с 41% до 94%. Причем ИП был успешным при длительно персистирующих генитальных кондиломах.
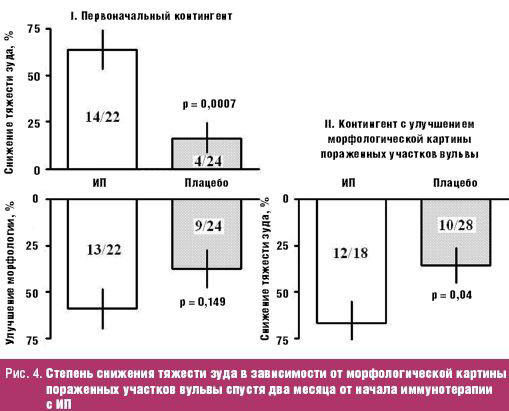
По данным Tay спустя два месяца в 63,5% случаях отмечено улучшение морфологической картины после лечения с ИП, в то время как в плацебо-контроле только в 16,7% наблюдений. Кроме того, отмечено некоторое снижение тяжести зуда вульвы в 59,1% случаев после лечения с ИП по сравнению с 37,5% наблюдений после плацебо-контроля. При этом значительное снижение тяжести зуда вульвы обнаружено в 66,7% случаев у пациенток с улучшением морфологической картины, что значительно превосходит аналогичный показатель 35,7% наблюдений у пациенток без улучшения морфологической картины заболевания (рис. 4). Аналогичные результаты были получены во время повторного контроля спустя четыре месяца после инициирования лечения.
Дополнительные источники, использованные в группе, получавшей лечение традиционными методами, характеризуются применением СО2 лазера (Aynaud et al.), СО2 лазера и криотерапии (Yliskoski et al.), гольмиевого (holmium) лазера (Yang et al.) и жидкого азота с помощью аппликаторов с хлопковыми наконечниками (Rasi et al.). При этом из обширных данных Yang et al. были использованы только результаты 132 пациенток с патологией шейки матки после однократной обработки гольмиевым лазером. Обе сравнительные группы Yliskoski et al. с применением как СО2 лазера, так и криотерапии были включены в группу традиционных методов. Следует также отметить, что в качестве рутинного метода Mohanty и Scott применяли 25% раствор Подофиллина или криотерапию, что сравнивалось с показателем применения ИП как в моно-, так и в комбинированном режиме. В русскоязычных источниках в качестве традиционных методов применяли различные методы деструкции, однако детали аппликации не описывались. Согласно нашему анализу обобщенная эффективность традиционных методов составила 59,1% (рис. 5). Этот показатель согласуется с аналогичными показателями литературы — 54,2%, по применению хирургических и химических методов деструкции ткани.
II. Систематический анализ обобщенных данных источников литературы
В соответствии с дизайном исследования были выделены следующие сравнительные группы в проанализированных нами источниках: плацебо, традиционные методы (ТМ), назначение ИП в монорежиме (ИП моно) или на фоне традиционных методов лечения (ИП комби) (рис. 5).

Данные на рис. 5 свидетельствуют о том, что степень эффективности плацебо-контроля составляет 27,9%, а традиционных методов лечения — 59,1%. Эффективность ИП в большинстве работ оценивалась в зависимости от режима его применения. При этом в 63,5% случаев отмечено клинико-лабораторное улучшение после применения ИП в монорежиме, что заметно контрастирует с высокими результатами комбинированного применения ИП — 90,7%.
Степень отрицательного эффекта отражает зеркальную противоположность показателей клинического улучшения с аналогичными вариациями между сравниваемыми группами. Данный показатель выражает 0, т. е. отсутствие эффекта и/или наступление рецидивов кондилом в «очищенных» участках, а не появление новых кондилом на соседних участках. Объединение таких параметров являлось результатом того, что в большинстве источников эти параметры отдельно не рассматривались, регистрировались как рецидив и только в нескольких источниках представлялись как отдельные параметры.
Показатели эффективности/отсутствия эффекта плацебо-контроля существенно отличались от показателей как традиционных методов и применения ИП в монорежиме, так и комбинированного режима применения ИП. В свою очередь, показатели эффективности/неуспеха традиционных методов лечения и применения ИП в монорежиме широко варьировали и оказались равнозначными. Наконец, применение ИП в комбинированном режиме сопровождалось высоким показателем эффективности, что существенно превосходит аналогичные результаты как традиционных методов, так и использования ИП в монорежиме.
III. Систематический анализ данных в зависимости от дизайна исследования
Исходя из того, что дизайн русскоязычных авторов отличается от протоколов исследования зарубежных исследователей, нами выполнен сравнительный анализ результатов применения ИП в зависимости от происхождения источников литературы (рис. 6).
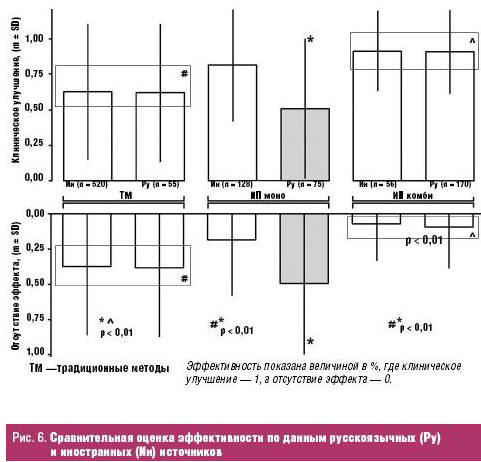
Анализ данных свидетельствует о значительном клиническом улучшении после комбинированного применения ИП по сравнению с аналогичными показателями традиционных методов лечения. При этом зарегистрирована значительно высокая эффективность применения ИП в монорежиме в иностранных источниках (ИП моно Ин) по сравнению с аналогичными данными отечественных авторов (ИП моно Ру). В остальном результаты как ТМ, так и ИП комби русскоязычных и иностранных источников оказались почти идентичными. Несмотря на разнообразие дизайна источников, оно не имело существенного влияния на результаты данного метаанализа, что подтверждается идентичными показателями русскоязычных и иностранных авторов в группах с ТМ и ИП комби.
IV. Сравнительный анализ результатов программы «Астра» и данных литературы
Результаты программы «Астра» отличаются также высокой эффективностью, соответствующей аналогичным данным комбинированного применения ИП. Так, общая эффективность применения ИП, по данным программы «Астра», составила 89,5% (рис. 7).

Клиническое улучшение после применения ИП у больных с различными формами манифестации ВПЧ-инфекции, согласно данным программы «Астра», оказалось сопоставимым с аналогичным показателем комбинированного применения ИП (ИП комби) у других авторов. В то же время эффективность применения ИП в программе «Астра» оказалась существенно высокой, по сравнению с аналогичными результатами традиционных методов и применения ИП в монорежиме.
V. Сравнительный анализ побочных эффектов
При анализе побочных эффектов применения ИП выявлено, что в двух источниках побочные эффекты не были отмечены, другие три вообще не упомянули об этом параметре. Наконец, в шести источниках авторы детально описали симптомы побочных эффектов. Данные свидетельствуют о появлении некоторых жалоб, касающихся раздражения органов желудочно-кишечного тракта (ЖКТ), кожных симптомов в виде сыпи и сухости, недомогания, а также повышения концентрации трансаминаз печени и мочевой кислоты. В большинстве случаев эти симптомы были незначительными и проходили самостоятельно и лечение не отменялось.
Дискуссия
Выбор метода лечения при ВПЧ-ассоциированных патологиях слизистых оболочек и кожи урогенитальной и перианальной локализации зависит от ряда факторов, включая морфологию, размеры, количество и локализацию кондилом, возраст больных и наличие беременности. В этом процессе немаловажную роль также играет собственный опыт врача и метод лечения, который он предпочитает. Основной целью терапии является элиминация кондилом, которые вызывают симптомы, сопряженные с физическим и психологическим дискомфортом. Тяжесть клинической манифестации ВПЧ-ассоциированных патологий слизистых оболочек и кожи урогенитальной и перианальной локализации широко варьирует, что требует необходимость тщательного выбора целесообразности использования того или иного метода в каждом конкретном случае.
Доказательства об исключительном преимуществе какого-либо определенного метода над остальными, в плане полной эрадикации кондилом, отсутствуют. Лечебное средство должно выбираться индивидуально, исходя из того принципа, что лечебное воздействие не должно сопровождаться осложнениями, вызывающими более тяжелые страдания по сравнению с основной болезнью. При этом следует также учитывать выбор пациенток, исходя из стоимости и комфортности того или иного метода лечения для конкретного больного. Однако в большинстве случаев врачи выбирают тактику лечения согласно рекомендациям различных экспертов, сообществ и организаций. Следует отметить, что все еще недостаточно работ, основанных на принципах доказательной медицины, свидетельствующих об эффективности какого-либо метода в отношении элиминации ВПЧ и регрессии ВПЧ-ассоциированных поражений, поэтому пациентки должны быть информированы об отсутствии в настоящее время патогенетически обоснованного метода лечения ВПЧ.
Согласно данным литературы, практически на всех этапах развития ВПЧ-ассоциированной патологии тактика лечения основана на выборе врача и пациентки (рис. 8).
Для выбора тактики ведения необходимо уточнить количество, размеры и точную локализацию кондилом. Лечение гигантских или множественных кондилом состоит из первичной хирургической эксцизии или удаления кондилом. При этом если консервативное лечение гигантской или множественной кондиломы оказалось успешным с элиминацией более 50% объема кондиломы, то считается предпочтительным продолжение консервативной терапии с этим же препаратом до окончания полного курса. Если уменьшение составляет менее 50% объема, то рекомендуется аблация или эксцизия кондилом. Считается, что химическая деструкция тканей является более эффективной во влажных, мягких и некератинизированных бородавках и кондиломах, а физическая деструкция — в кератинизированных папилломах.
В зависимости от локализации кондилом хирургическое лечение кондилом шейки матки рекомендуется после предварительной кольпоскопической оценки и исключения тяжелой формы дисплазии (CIN-III) и РШМ in situ. Для деструкции кондилом влагалища и прямой кишки рекомендуют применять криохирургию или трихлоруксусную кислоту, уретральных кондилом — криотерапию или Подофиллин. Однако Подофиллин не рекомендуется для кондилом, локализованных на внутренних поверхностях урогенитальной и в перианальной области.
Ситуация, когда отсутствует наружный рост кондилом, но манифестация ВПЧ-инфекции может быть установлена с помощью ацетоуксусной пробы, кольпоскопии, биопсии и других инструментальных методов, считается субклинической формой, а при положительных результатах лабораторных анализов (полимеразная цепная реакция (ПЦР) и ДНК-типирование, серология и др.) — латентной формой. По поводу тактики ведения таких больных имеются много различных противоположных мнений. Так, по рекомендациям центров контроля болезней (CDC), даже не рекомендуется применять ацетоуксусную пробу, кольпоскопию и другие методы для скрининга субклинической формы ВПЧ в общей популяции или у больных с уже установленным диагнозом ВПЧ-инфекции. Долгосрочный скрининг и мониторинг являются основой тактики ведения таких пациенток. При этом рекомендуется проведение разъяснительной беседы с такими больными о важности и необходимости скрининга путем периодического взятия цитологических мазков из цервикального канала шейки матки.
Существуют данные о синергизме комбинированного применения различных методов в повышении эффективности результатов лечения при ВПЧ-ассоциированных патологиях слизистых оболочек и кожи. Результаты данного обзора также подтверждают эффективность комбинации хирургической деструкции генитальных кондилом с назначением ИП в качестве вспомогательной иммуномодулирующей терапии.
ИП является длительно используемым в медицинской практике иммуностимулятором, который считается эффективным при различных вирусных инфекциях. ИП, по своей природе являясь производным пуринов и жизненно важным компонентом клеточного ядра, не обладает выраженным токсическим эффектом даже при назначении в высоких дозах. Обычно природные аналоги ИП поступает в организм из разнообразных пищевых продуктов. Поэтому, при правильном назначении ИП с учетом его противопоказаний в качестве иммуностимулятора, частота побочных эффектов минимальна. Об этом свидетельствуют данные более чем 35-летнего использования ИП в медицинской практике во всем мире. Назначение средней курсовой дозы ИП «6 таблеток × 10 дней» перевалило за многомиллионный рубеж (18 × 106) еще в преддверии нынешнего столетия. В предыдущих обзорах нами были проанализированы результаты применения ИП при различных вирусных, инфекционных и неинфекционных заболеваниях, где изложены особенности применения ИП у такого контингента больных, как «трудные или проблемные пациенты».
В настоящем систематическом обзоре продемонстрирована высокая эффективность комбинированного способа применения ИП при ВПЧ-ассоциированных патологиях слизистых оболочек и кожи урогенитальной и перианальной локализации. Разнообразие дизайна источников не имело существенного влияния на результаты данного систематического анализа. Так, выводы, полученные в результате метаанализа, подтверждались аналогичными выводами сравнительного анализа результатов русскоязычных и иностранных авторов, а также сравнения обобщенных результатов 14 источников с аналогичными данными, полученными при реализации программы «Астра».
Известно, что ВПЧ имеет специальные механизмы (рис. 9), подавляющие как клеточный, так и гуморальный иммунитет, в частности, интерфероновое звено иммунной системы.
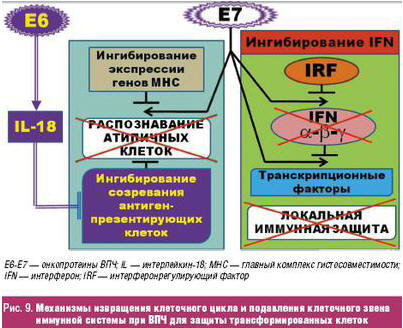
Обоснованием назначения вспомогательной иммуностимулирующей терапии можно считать данные о успешности лечения генитальных кондилом в зависимости от потенциальной способности клеточного звена иммунной системы элиминировать ВПЧ. В свою очередь, ИП обладает многосторонними взаимоотношениями с иммунной системой, активируя ее клеточное звено, с одной стороны — усиливает секрецию интерферонов и ряда других цитокинов и, с другой стороны — подавляет продукцию других провоспалительных цитокинов. Это приводит к наступлению равновесия клеточного и гуморального звена иммунной системы, что сопровождается восстановлением адекватной противовирусной защиты организма.
Результаты применения ИП в качестве системной иммуномодулирующей монотерапии при ВПЧ-ассоциированных патологиях слизистых оболочек и кожи урогенитальной и перианальной локализации были неоднозначными. При этом результаты одних авторов свидетельствуют об удовлетворительном лечебном эффекте монотерапии ИП, а данные других авторов — о низком результате. Такая вариабельность лечебного эффекта ИП, по-видимому, связана с широким диапазоном режима его применения. Так, за один курс ИП назначали от 5 дней до 12 недель. При этом краткосрочные, 5-дневные, курсы лечения повторяли от 3 до 6 раз.
Систематический обзор с элементами метаанализа в целом свидетельствует о наличии обнадеживающего эффекта вспомогательной иммунотерапии ИП на фоне традиционных методов при ВПЧ-ассоциированных патологиях слизистых оболочек и кожи урогенитальной и перианальной локализации. Из этого следует, что для элиминации как ВПЧ, так и зараженных ВПЧ клеток гуморальными и клеточными компонентами иммунной системы на фоне вспомогательной иммунотерапии необходим пусковой механизм, каковым является хирургическая деструкция. Она, по-видимому, фокусирует разносторонние механизмы иммунного ответа в очаг ВПЧ-инфекции. Исходя из этой ситуации, целесообразно дальнейшее изучение эффективности этого способа применения ИП в зависимости от тяжести клинической манифестации ВПЧ-ассоциированной патологии слизистых оболочек и кожи.
Обнадеживающие результаты комбинированного применения ИП в проанализированных нами источниках литературы, позволяют сделать вывод о целесообразности вспомогательной иммунотерапии на фоне традиционных методов лечения ВПЧ-ассоциированных патологий слизистых оболочек и кожи урогенитальной и перианальной локализации.
Литература
- Костава М. Н., Прилепская В. Н. Возможности терапии папилломавирусной инфекции //РМЖ. 2009; 17, 1: 16–19.
- Долгушина В. Ф., Ахматова А. Н., Беренда М. А. Эффективность изопринозина в лечении хронического цервицита, ассоциированного с папилломавирусной инфекцией // Фарматека. 2009; 14: 73–76.
- Забелев А. В., Долматова О. К., Сивоконева Е. Н., Волошин В. В., Холодная Т. О., Водопьянов С. О. Результаты кольпоскопического скрининга и опыт применения Изопринозина в лечении папилломавирусных поражений шейки матки // Фарматека. 2005; 3: 72–75.
- Кедрова А. Г., Подистов Ю. И., Кузнецов В. В., Брюзгин В. В., Козаченко В. П., Никогосян С. О. Роль противовирусной терапии в комплексном лечении больных эпителиальными дисплазиями и преинвазивным раком шейки матки // Гинекология. 2005; 7: 170–174.
- Линаск Л. И., Григорьева Е. Е. Опыт применения Изопринозина при заболеваниях шейки матки на фоне папилломавирусной инфекции у подростков и молодых женщин // РМЖ. 2008; 16 (19): 1221–1225.
- Потапов В. А., Демченко Т. В., Стрельцова Т. Р., Гавриш Л. П., Загурский Ю. Б., Медведев М. В., Польщиков П. И. Клинико-лабораторная оценка эффективности Изопринозина в лечении папилломавирусной инфекции, ассоциированной с цервикальной интраэпителиальной неоплазией // Репродуктивное здоровье женщины 2006; 25 (1): 134–135.
- Прилепская В. Н., Роговская С. И. Возможности Изопринозина в лечении хронических цервицитов и вагинитов // РМЖ. 2008; 16, 1: 5–9.
- Прилепская В. Н. Вирус папилломы человека: современный взгляд на проблему //Медицинский вестник. 2007; 29 (414).
- Роговская С. И., Прилепская В. Н. Оптимизация лечения хронических цервицитов с помощью Изопринозина // Гинекология. 2006; 8 (1): 2–4.
- Davidson-Parker J., Dinsmore W., Khan M. H., Hicks D. A., Morris C. A., Morris D. F. Immunotherapy of genital warts with inosine pranobex and conventional treatment: double blind placebo controlled study // Genitourin Med. 1988; 64 (6): 383–386.
- Georgala S., Katoulis A. C., Befon A., Georgala C., Rigopoulos D. Oral inosiplex in the treatment of cervical condylomata acuminata: a randomised placebo-controlled trial // BJOG. 2006; 113 (9): 1088–1091 (a).
- Mohanty K. C., Scott C. S. Immunotherapy of genital warts with inosine pranobex (Imunovir): preliminary study // Genitourin Med. 1986; 62 (5): 352–355.
- Tay S. K. Efficacy of inosine pranobex oral therapy in subclinical human papillomavirus infection of vulva: a randomized double-blinded placebo controlled study // Int J STD AIDS. 1996; 7 (4): 276–280.
- Мынбаев О. А., Елисеева М. Ю., Доорбар Дж., Манухин И. Б. Эпидемиология, молекулярная биология, патофизиология и принципы иммунотерапии папилломавирусной инфекции // Вопросы гинекологии, акушерства и перинатологии. 2009; 8 (3): 69–79.
- Kodner C. M., Nasraty S. Management of genital warts // Am Fam Physician. 2004, Dec; 70 (12): 2335–2342.
Статья опубликована в журнале Лечащий Врач
материал с сайта MedLinks.ru







