Индивидуализированный выбор антигипертензивных лекарственных средств при метаболическом синдроме: влияние на адипокины, маркеры эндотелиальной дисфункции
Т. Е. Морозова, доктор медицинских наук, профессор
Т. Б. Андрущишина, кандидат медицинских наук, доцент
С. Д. Ошорова
Первый МГМУ им. И. М. Сеченова, Москва
Метаболический синдром (МС) представляет собой чрезвычайно актуальную проблему современной медицины и в силу высокой распространенности, и в силу значимого влияния его компонентов на риск сердечно-сосудистых осложнений. Распространенность его среди населения растет по мере увеличения числа лиц с избыточным весом и ожирением. В США избыточный вес и ожирение отмечается у двух третей населения, при этом у четверти населения отмечаются признаки МС. Результаты выборочных исследований, проведенных в России, позволяют предположить, что в настоящее время не менее 30% трудоспособного населения нашей страны имеет избыточную массу тела и 25% — ожирение [1, 4, 5]. По мнению экспертов Всемирной организации здравоохранения (ВОЗ) МС является «пандемией XXI века», распространенность которого колеблется от 20% до 40%, увеличивается с возрастом и имеет некоторые этнические, половые и возрастные различия. Самая высокая частота МС после 60 лет [14, 28], однако в настоящее время отмечается рост встречаемости МС и среди подростков [11].
Различные медицинские школы и сообщества разрабатывают свои критерии для диагностики МС. Так, существуют критерии Американской ассоциации сердца (AHA), ВОЗ, Американской ассоциации клинических эндокринологов (AACE), Международной федерации диабета (IDF) [6, 13, 18]. В нашей стране принято придерживаться критериев МС, разработанных экспертами Всероссийского научного общества кардиологов (ВНОК) [3], согласно которым основным (облигатным) критерием МС является центральное (абдоминальное) ожирение — окружность талии (ОТ) более 80 см у женщин и более 94 см у мужчин. Помимо этого выделены дополнительные критерии:
- артериальная гипертензия (АД ≥ 130/85 мм рт. ст.);
- уровень триглицеридов ≥ 1,7 ммоль/л;
- уровень холестерина (ХС) липопротеинов высокой плотности (ЛПВП) < 1,04 ммоль/л у мужчин и < 1,2 ммоль/л у женщин;
- повышение уровня ХС липопротеинов низкой плотности (ЛПНП) > 3,0 ммоль/л;
- гипергликемия натощак (глюкоза в плазме крови натощак ≥ 6,1 ммоль/л);
- нарушение толерантности к глюкозе (глюкоза в плазме крови через 2 часа после нагрузки глюкозой в пределах ≥ 7,8 и ≤ 11,1 ммоль/л).
Для диагностики МС необходимо наличие у пациента центрального ожирения и как минимум двух дополнительных критериев.
Частота встречаемости в популяции полного кластера компонентов МС, как показали результаты крупного метаанализа эпидемиологических исследований, включающего 22 561 мужчину и 18 495 женщин в возрасте 20–69 лет, является низкой и составляет в среднем 3,0% у мужчин и 3,4% у женщин. В то же время сочетание трех компонентов встречается значительно чаще — 12,1% и 11,9% для мужчин и женщин соответственно. Еще более частым явлением оказалось сочетание двух дополнительных (помимо ожирения) компонентов МС — у 25,8% мужчин и у 21,9% женщин, причем у большинства из них одним из дополнительных критериев была артериальная гипертензия (АГ) [28].
В международном исследовании INTERHEART было показано, что у лиц, имеющих МС, вне зависимости от выбранной совокупности и количества дополнительных критериев риск сердечно-сосудистых осложнений, в частности риск развития острого инфаркта миокарда, очень высок и сопоставим с таковым у больных сахарным диабетом (СД) [23].
Современные принципы тактики ведения больных АГ в соответствии с международными и национальными рекомендациями предполагают обязательную оценку общего сердечно-сосудистого риска. Система стратификации риска, учитывающая факторы риска, признаки субклинического поражения органов мишеней, СД, МС и ассоциированные клинические состояния, была разработана на основании результатов Фремингемского исследования («Фремингемская модель») [19]. МС был выделен наряду с СД в отдельную категорию факторов, влияющих на прогноз, поскольку было отмечено, что сердечно-сосудистая заболеваемость и смертность у людей с МС существенно выше по сравнению с лицами без него [8, 16, 21, 23, 31]. У больных с АГ и МС сердечно-сосудистый риск всегда оценивается как высокий или очень высокий») [2, 19].
Все это требует проведения адекватной комплексной фармакотерапии, направленной как на оптимальную коррекцию всех имеющихся метаболических нарушений, так и на коррекцию повышенного уровня АД.
При выборе конкретного лекарственного средства (ЛС) из имеющегося широкого арсенала антигипертензивных классов препаратов надо стремиться следовать принципам персонализированной медицины, ориентированной на максимальное сближение возможностей лекарства и потребностей пациента. Для того чтобы обеспечить наибольшее соответствие терапии конкретному пациенту, необходимо учитывать современные достижения молекулярной биологии, проливающие свет на патофизиологические особенности возникновения и прогрессирования АГ в конкретной клинической ситуации.
Патофизиологические аспекты АГ при МС
В настоящее время известно, что МС характеризуется увеличением массы висцерального (абдоминального) жира, дисфункцией жировой ткани, снижением чувствительности периферических тканей к инсулину и гиперинсулинемией, которые вызывают развитие нарушений углеводного, липидного, пуринового обмена и артериальной гипертонии [17].
Увеличение объемов адипоцитов и инфильтрация жировой ткани макрофагами приводят к высвобождению провоспалительных цитокинов и способствуют развитию резистентности к инсулину [20]. Инсулинорезистентность является основным посредником проявлений МС [22].
Накопление адипоцитов происходит в разных областях организма, однако исследования продемонстрировали, что отложение жира в области живота (по центральному, абдоминальному типу, т. е. в висцеральной жировой ткани) имеет важные метаболические последствия [29]. Висцеральная жировая ткань, в отличие от жировой ткани другой локализации, хорошо иннервирована, имеет более широкую сеть капилляров и непосредственно сообщается с портальной системой. Висцеральные адипоциты имеют высокую плотность бета-адренорецепторов (особенно бета3-типа), кортикостероидных и андрогенных рецепторов и относительно низкую альфа2-адренорецепторов и рецепторов к инсулину. Эти особенности определяют высокую чувствительность висцеральной жировой ткани к липолитическому действию катехоламинов и низкую к антилиполитическому действию инсулина (особенно в постпрандиальный период), обеспечивая хорошую восприимчивость к гормональным изменениям, часто сопровождающим абдоминальное ожирение.
В настоящее время известно, что адипоциты вырабатывают более 50 различных цитокинов (адипокинов) [27], участвующих в развитии многих взаимосвязанных патологических процессов, таких как резистентность тканей к инсулину, дисфункция эндотелия, атеросклероз [12]. Развитие сердечно-сосудистых осложнений обусловлено тем, что у лиц, страдающих МС, увеличивается предрасположенность к тромбообразованию за счет повышения активности активатора плазминогена и уровня адипокинов, а также отмечается развитие эндотелиальной дисфункции [7].
Большое значение приобретает эндотелиальная дисфункция, которая может быть определена как неадекватное (увеличенное или сниженное) образование в эндотелии различных биологически активных веществ. Одним из методов оценки выраженности эндотелиальной дисфункции является определение в крови факторов, повреждающих эндотелий, уровень которых коррелирует с эндотелиальной дисфункцией. К таким факторам (медиаторам повреждения эндотелия) относятся гиперхолестеринемия, гипергомоцистеинемия, цитокины (интерлейкины, фактор некроза опухоли (ФНО)) и др. [9].
Одним из маркеров эндотелиальной дисфункции является эндотелин-1, который имеет прогностическое значение при сердечно-сосудистых заболеваниях. Кроме того, эндотелин-1 является маркером коронарного атеросклероза и коронарной эндотелиальной дисфункции, нарушения функционирования печени, снижения функции почек. Повышение уровня эндотелина-1 в плазме наблюдается при различных состояниях: ишемии, сепсис, высокая степень артериальной и легочной гипертензии [25].
Начальные стадии атеросклероза характеризуются адгезией циркулирующих лейкоцитов к эндотелию с последующей трансэндотелиальной миграцией. Этот процесс частично опосредован молекулами клеточной адгезии, такими как молекулы сосудистой адгезии (VCAM-1 — vascular cell adhesion moleсule-1) и молекулы межклеточной адгезии (ICAM-1 — intercelluar cell adhesion moleсule-1), и Е-селектином, которые вырабатываются на мембране эндотелия в ответ на воздействие некоторых воспалительных цитокинов (интерлейкин-1, ФНО и интерферон) [26].
МС ассоциируется с хроническим субклиническим воспалительным процессом. В настоящее время известно, что адипоциты вырабатывают более 50 различных цитокинов (адипокинов), активирующих субклинический воспалительный процесс и эндотелиальную дисфункцию [24].
Данные Фремингемского исследования свидетельствуют о том, что уровень С-реактивного белка (СРБ) более 3 мг/л связан с высоким риском сердечно-сосудистых осложнений [30]. У лиц с МС отмечается повышение уровня маркеров хронического воспаления — высокочувствительный СРБ, фибриноген, уровень лейкоцитов и т. д. Увеличение синтеза гепатоцитами воспалительных белков стимулируется такими адипокинами, как интерлейкин-1, интерлейкин-6, ФНО и др. [15].
Таким образом, висцеральная жировая ткань является эндокринным органом, секретирующим широкий спектр биологически активных веществ — адипокинов, оказывающих влияние на процессы прогрессирования атеросклероза, тромбообразования, инсулинорезистентность и пр. Среди них интерлейкины, ФНО-альфа, ингибитор тканевого активатора плазминогена-1, ангиотензиноген, лептин, резистин, оментин и др., большинство из которых имеют негативные кардиометаболические эффекты [27, 28].
По данным метаанализа крупных исследований, наличие МС ассоциируется с субклиническим поражением жизненно важных органов. Это проявляется в снижении фильтрационной функции почек, микроальбуминурии, повышении жесткости артерий, гипертрофии миокарда левого желудочка, причем многие из этих нарушений проявляются даже независимо от наличия АГ [10].
Как уже отмечалось ранее, в соответствии с рекомендациями ВНОК/РМОАГ [2] больных АГ с МС следует относить к группе высокого или очень высокого риска сердечно-сосудистых осложнений и терапевтическими целями (таблица) у них являются, помимо контроля АГ, коррекция инсулинорезистентности, эндотелиальной дисфункции, дислипидемии, нарушений углеводного обмена и воздействие на гормоны жировой ткани. С патогенетической точки зрения в наибольшей степени всем этим требованиям отвечают два класса антигипертензивных ЛС — ингибиторы ангиотензинпревращающего фермента (иАПФ) и бета-адреноблокаторы (БАБ).

В связи с этим чрезвычайно важно оценить возможные плейотропные эффекты различных антигипертензивных лекарственных средств — их влияние на адипокины, на маркеры эндотелиальной дисфункции и системного воспаления у больных АГ в сочетании с МС.
Целью нашего исследования явилась оптимизация антигипертензивной терапии у больных АГ и МС на основе изучения влияния антигипертензивных ЛС на активность адипокинов, маркеров эндотелиальной дисфункции и системного воспаления.
Материал и методы. Было проведено открытое сравнительное исследование без применения плацебо по изучению антигипертензивных и плейотропных эффектов двух ЛС — иАПФ зофеноприла и БАБ небиволола у 81 больного АГ I–II степени и МС (мужчин — 38, женщин — 43) в возрасте от 29 до 79 лет (средний возраст 53,4 ± 11,6 года), нормальным уровнем креатинина сыворотки крови (0,7–1,4 мг/дл) и скоростью клубочковой фильтрации (СКФ) более 60 мл/мин/1,73 м2. Все пять критериев МС имели 14 (17,3%) больных, четыре критерия — 27 (33,3%) больных, три критерия — 40 (49,4%) больных.
После «отмывочного периода» в 5–7 дней больных произвольным способом распределяли в одну из двух групп: принимавших зофеноприл в начальной дозе 15–30 мг один раз в день и принимавших небиволол в начальной дозе 2,5–5 мг один раз в день. Если при контрольном исследовании на фоне приема препарата достигался целевой уровень АД (систолическое АД (САД) < 140 мм рт. ст., диастолическое АД (ДАД) < 90 мм рт. ст. или снижение АД не менее 10% от исходного), то дальнейшего увеличения дозы препарата не проводили, в противном случае дозу зофеноприла и небиволола увеличивали до 45–60 мг/сут и 7,5–10 мг/сут соответственно. При сохраняющейся АГ на фоне монотерапии исследуемыми препаратами и невозможности наращивания дозы к терапии добавляли диуретик (Гидрохлортиазид 12,5 мг или Индапамид-ретард 1,5 мг). Пациенты продолжали терапию сопутствующих заболеваний в прежнем объеме. Длительность лечения составила 12 недель.
Программа клинического обследования включала в себя: анализ жалоб, сбор анамнеза, физикальный осмотр, оценку качества жизни с помощью стандартизированной анкеты «Качество жизни у больных гипертонической болезнью», адаптированной с GQI (The Goeteborg quality of life Instrument), и по визуальной аналоговой шкале (ВАШ).
Антигипертензивную эффективность оценивали по результатам офисного измерения АД и СМАД. Лабораторные исследования включали биохимическое исследование крови (ХС, триглицериды, ХС ЛПВП, ХС ЛПНП и очень низкой плотности (ЛПОНП), калий, креатинин сыворотки крови, гликемия натощак и пероральный тест толерантности к глюкозе).
Активность адипокинов лептина и адипонектина в сыворотке крови определяли методом иммуноферментного анализа (диагностический набор Leptin ELISA, DBC для лептина и набор Biovendor Human Adiponectin ELISA для адипонектина). С целью оценки функции эндотелия определяли уровень активности эндотелина-1 методом иммуноферментного анализа на диагностическом наборе Endothelin (1–21), Biomedica Gruppe. С целью оценки адгезивной функции эндотелия определяли уровень молекул межклеточной адгезии (ICAM-1) с помощью иммуноферментного метода — ELISA. Концентрация СРБ определялась методом иммунотурбидиметрии с латексным усилением в микропланшетном формате (Orion Diagnostics, Финляндия).
Результаты исследований обработаны с помощью пакета программ SPSS 11.5 for Windows. Для нормально распределенных показателей данные представлены в виде М ± σ, где М — среднее значение, σ — стандартное отклонение. Для показателей с негауссовским распределением количественные показатели представлены в виде медианы и процентилей Ме (25; 75) (Ме — медиана, 25, 75 — 25-й и 75-й процентили). Сравнение количественных показателей проводили при помощи рангового U образного критерия Манна–Уитни. При анализе повторных измерений количественных признаков применяли критерий Вилкоксона. Статистически значимыми считались различия при р < 0,05.
Результаты и обсуждение
Антигипертензивная эффективность зофеноприла и небиволола по данным офисного измерения САД и ДАД через 12 недель терапии была сопоставимо одинакова (рис. 1). Частота сердечных сокращений (ЧСС) достоверно не изменилась в группе зофеноприла (72,5 ± 10,9 исходно и 69,0 ± 7,3 в мин через 12 недель, p > 0,05) и снизилась достоверно у больных, получавших небиволол (76,1 ± 9,6 исходно и 63,4 ± 6,2 в мин через 12 недель, p < 0,05).
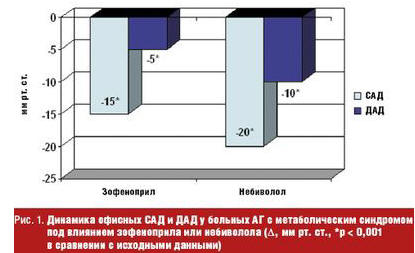
Контроль биохимических показателей позволил судить о безопасности и благоприятном метаболическом профиле зофеноприла и небиволола. Так, по результатам перорального теста толерантности к глюкозе отмечена тенденция к уменьшению доли больных с нарушенной толерантностью к глюкозе в обеих группах (50% исходно и 48,3% через 12 недель в группе зофеноприла; 44,8% исходно и 30,7% через 12 недель в группе небиволола). Не выявлено достоверной динамики показателей липидного обмена, уровня калия и креатинина сыворотки крови.
Ни один больной не выбыл из исследования в обеих группах из-за побочных эффектов.
У больных АГ с МС исходный уровень лептина составил 20,3 (13,4; 38,4) нг/мл и статистически значимо превышал аналогичный показатель в группе контроля — 9,5 (3,2; 22,3) нг/мл (р = 0,003). Концентрация адипонектина составила 9,0 (5,9; 12,2) мкг/мл, что ниже аналогичного показателя в группе контроля 12,6 (6,5; 20,9) мкг/мл (р = 0,08). Исходный уровень эндотелина-1 составил 0,38 (0,25; 0,89) фмоль/мл, что превышает нормальные показатели — 0,26 фмоль/мл (р = 0,001) и данные, полученные в группе контроля, — 0,30 (0,25; 0,59) фмоль/мл (р = 0,044). Исходный уровень ICAM-1 составил 323,69,0 (236,76; 585,45) нг/мл, что было достоверно выше аналогичного показателя в группе контроля — 277,59 (218,51; 288,33) нг/мл (р = 0,03). Концентрация высокочувствительного СРБ составила 3,1 (1,6; 6,2) мг/л, что было достоверно выше аналогичного показателя в группе контроля 1,43 (0,22; 2,6) мг/л (р = 0,001).
Под влиянием зофеноприла выявлено достоверное снижение уровня лептина с 18,7 (12,8; 34,0) до 17,5 (12,5; 30,6) нг/мл (р = 0,001). При этом значимое снижение отмечено в подгруппе женщин без нарушений углеводного обмена (22,1 (19,2; 31,3) нг/мл до лечения и 18,6 (15,3; 29,3) нг/мл через 12 недель (р = 0,05)). Под влиянием небиволола активность лептина имела тенденцию к снижению (24,7 (14,3; 47,1) исходно и 23,8 (13,6; 40,3) нг/мл через 12 недель, р = 0,34) (рис. 2).
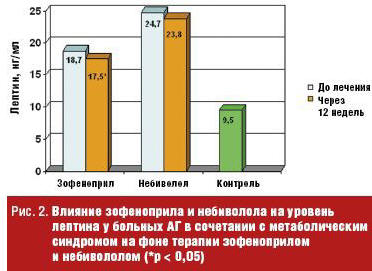
При лечении зофеноприлом выявлена тенденция к повышению уровня адипонектина с 10,4 (7,5; 14,1) до 13,6 (6,5; 17,7) мкг/мл (р = 0,12). Значимое повышение уровня адипонектина отмечено у женщин (12,2 (9,7; 15,2) до лечения и 13,9 (11,5; 16,9) мкг/мл через 12 недель, р = 0,03). Динамика активности у мужчин не достигла статистической значимости, однако наблюдалась тенденция к повышению его уровня (8,9 (7,4; 13,3) до и 10,6 (6,3; 18,0) мкг/мл после терапии, р = 0,73). Концентрация адипонектина в группе больных, получавших терапию небивололом, имела тенденцию к снижению, при этом статистическая значимость выявлена в подгруппе мужчин (6,2 (5,3; 9,6) исходно и 4,8 (5,3; 9,6) мкг/мл через 12 недель, р = 0,001).
Отмечено снижение активности эндотелина-1 под влиянием зофеноприла с 0,38 (0,25; 1,03) до 0,34 (0,14; 0,88) фмоль/мл и небиволола с 0,37 (0,25; 0,89) до 0,27 (0,18; 0,83) фмоль/мл (р = 0,001) (рис. 3).

Таким образом, по влиянию на уровень эндотелина-1 бета1-адреноблокатор небиволол превосходил ингибитор АПФ зофеноприл: снижение концентрации эндотелина-1 составило = -0,1 и -0,04 фмоль/мл соответственно (р < 0,05). Эти данные имеют важное практическое значение и свидетельствуют о том, что бета1-адреноблокатор с дополнительными вазодилятирующими свойствами не только не ухудшает функцию эндотелия, но и превосходит препарат из группы ингибиторов АПФ, которые признаны лекарственными средствами с наибольшим влиянием на эндотелиальную дисфункцию.
В группе больных, достигших целевого уровня АД, выявлена положительная динамика активности изученных адипокинов под влиянием 12-недельной антигипертензивной терапии. Так, уровень лептина достоверно снизился с 30,6 ± 3,6 до 24,3 ± 2,2 нг/мл (р = 0,047), активность эндотелина-1 снизилась достоверно с 0,65 ± 0,09 до 0,5 ± 0,1 фмоль/мл (р = 0,001). Статистически значимой динамики активности адипонектина не выявлено.
В группе больных, не достигших целевого уровня АД, также отмечалось снижение активности лептина, повышение активности адипонектина и снижение уровня вазоконстриктора эндотелина-1, что свидетельствует о наличии положительных метаболических эффектов изученных препаратов, независимо от степени снижения АД.
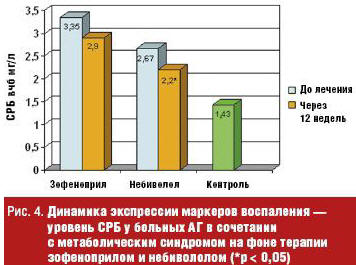
Отмечено снижение активности СРБ (высокочувствительного) под влиянием зофеноприла с 3,35 (2,25; 6,31) до 2,9 (1,34; 4,38) мг/л (р = 0,05) и небиволола с 2,67 (1,95; 3,89) до 2,2 (1,18; 4,13) мг/л (р = 0,001) (рис. 4).
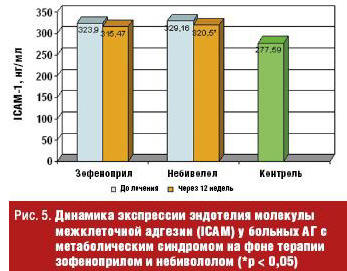
На фоне лечения у больных АГ с метаболическим синдромом отмечено снижение показателя экспрессии эндотелия — ICAM (молекулы межклеточной адгезии) под влиянием зофеноприла с 323,9 (242,25; 512,31) до 315,47 (187,31; 424,38) нг/мл и небиволола с 329,16 (271,33; 413,71) до 320,5 (218,18; 314,13) мг/мл (р = 0,001) (рис. 5).
Заключение
Таким образом, назначение иАПФ зофеноприла и бета-адреноблокатора небиволола больным АГ в сочетании с МС является патогенетически обоснованным и оправданным, т. к. данные препараты способны целенаправленно воздействовать на активность адипокинов, имеющих значение в развитии хронического воспалительного процесса и эндотелиальной дисфункции.
Литература
- Никитин Ю. П., Казека Г. Р., Симонова Г. И. Распространенность компонентов метаболического синдрома Х в неорганизованной городской популяции (эпидемиологическое исследование) // Кардиология. 2001; 9: 37–40.
- Рекомендации Российского медицинского общества по артериальной гипертонии и Всероссийского научного общества кардиологов // Кардиоваскулярная терапия и профилактика. 2008; 7 (6), приложение 2.
- Рекомендации экспертов ВНОК по диагностике и лечению метаболического синдрома (второй пересмотр) // Кардиоваскулярная терапия и профилактика. 2009; 6 (Прил. 2).
- Симонова Г. И., Мустафина С. В., Печенкина Е. А., Рымар О. Д., Никитин Ю. П. Эпидемиологические предпосылки контроля нарушений углеводного обмена //Болезни сердца и сосудов. 2009, 2.
- Токарева З. Н., Мамедов М. Н., Деев А. Д., Евдокимова А. А., Оганов Р. Т. Распространенность и особенности проявлений метаболического синдрома во взрослой городской популяции // Кардиоваскулярная терапия и профилактика. 2010; 9 (1), 10–14.
- Alberti K. G., Zimmet P. Z. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1. Diagnosis and classification of diabetes mellitus, provisional report of a WHO consultation // Diabet. Med. 1998. Vol. 15. P. 539–553.
- Alessi M. C., Juhan-Vague I. Metabolic syndrome, haemostasis and thrombosis // Thromb Haemost. 2008, Jun, 99 (6): 995 10 00.
- Canoy D., Boekholdt S. M., Wareham N. et al. Body fat distribution and risk of coronary heart disease in men and women in the European Prospective Investigation Into Cancer and Nutrition in Norfolk cohort: a population-based prospective study // Circulation. 2007; 116: 2933–2943.
- Chong A. A., Blann A. D., Lip G. Assessment of endothelial damage and dysfunction: observations in relation to heart failure // QJMed. 2003; 96 (4): 253–267.
- Cuspidi C., Sala C., Zanchetti A. Metabolic syndrome and target organ damage: role of blood pressure. Expert Rev Cardiovasc Ther. 2008, Jun, 6 (5): 731–743.
- De Ferranti S. D., Osganian S. K. Epidemiology of paediatric metabolic syndrome and type 2 diabetes mellitus // Diab Vasc Dis Res. 2007, Dec, 4 (4): 285–296.
- Despres J. P., Lemieux I., Bergeron J., Pibarot P., Mathieu P., Larose E. Abdominal obesity and the metabolic syndrome: contribution to global cardiometabolic risk // Arterioscler Thromb Vasc Biol. 2008, Jun, 28 (6): 1039–1049.
- Einhorn D., Reaven G. M., Cobin R. H. et al. American College of Endocrinology position statement on the insulin resistance syndrome // Endocr Pract. 2003; 9: 237–252.
- Ford E. S., Giles W. H., Mokdad A. H. Increasing prevalence of the metabolic syndrome among u.s. Adults // Diabetes Care. 2004, Oct, 27 (10): 2444–2449.
- Festa A. et al. Subclinical Inflammation as Part of the Insulin Resistance Syndrome The Insulin Resistance Atherosclerosis Study (IRAS) // Circulation. 2000; 102: 42–47.
- Fujimoto W. Y., Bergstrom R. W., Boyko E. J. et al. Visceral adiposity and incident coronary heart disease in Japanese-American men. The 10 year follow-up results of the Seattle Japanese-American Community Diabetes Study // Diabetes Care. 1999; 22: 1808–1812.
- Goossens G. H. The role of adipose tissue dysfunction in the pathogenesis of obesity-related insulin resistance // Physiol Behav. 2008, May 23, 94 (2): 206–218.
- Grundy S. M., Cleeman J. I., Daniels S. R. et al. Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement // Circulation. 2005; 112 (17): 2735–2752.
- Guidelines for the management of arterial hypertension The Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // European Heart Journal. 2007; 28: 1462–1536.
- Gustafson B., Hammarstedt A., Andersson C. X. et al. Inflamed adipose tissue: a culprit underlying the metabolic syndrome and atherosclerosis // Arterioscler Thromb Vasc Biol. 2007, Nov, 27 (11): 2276–2283 [Medline].
- Lakka H. M. et al. The metabolic syndrome and total and cardiovascular disease mortality in middle-aged men // JAMA. 2002; 288: 2709–2716.
- Lann D., LeRoith D. Insulin resistance as the underlying cause for the metabolic syndrome // Med Clin North Am. 2007, Nov, 91 (6): 1063–1077.
- Mente A., Yusuf S. et al. For the INTERHEART Investigators Metabolic Syndrome and Risk of Acute Myocardial Infarction // J Am Coll Cardiol. 2010; 55: 2390–2398.
- Serne E. H., de Jongh R. T., Eringa E. C. et al. Microvascular dysfunction: a potential pathophysiological role in the metabolic syndrome // Hypertension. 2007; 50 (1): 204–411.
- Shichiri M. et al. Plasma endothelin levels in hypertension and chronic renal failure // Hypertension. Vol 15, 493–496.
- Springer T. A. Traffic signals for lymphocyte recirculation and leukocyte emigration: The multistep paradigm // Cell. 1994; 76: 301–314.
- Trayhurn P., Wood I. S. Signalling role of adipose tissue: adipokines and inflammation in obesity // Biochemical Society Transactions. 2005, 33, 1078–1081.
- Trevisan M., Lui J., Menotti A. Syndrome X and mortality: a population-based study. Risk Factor and Life Expectancy Research Group // Am J Epidemiol. 1998, Nov, 15; 148 (10): 958–966.
- Turkoglu C., Duman B. S., Gunay D., Cagatay P., Ozcan R., Buyukdevrim A. S. Effect of abdominal obesity on insulin resistance and the components of the metabolic syndrome: evidence supporting obesity as the central feature // Obes Surg. 2003, Oct, 13 (5): 699–705.
- Wilson Peter et al. C-Reactive Protein and Reclassification of Cardiovascular Risk in the Framingham Heart Study Circulation: Cardiovascular Quality and Outcomes. 2008; 1: 92–97.
- Yusuf S., Hawken S., Ounpuu S. et al. Obesity and the risk of myocardial infarction in 27,000 participants from 52 countries: a case-control study // Lancet. 2005; 366: 1640–1649.
Статья опубликована в журнале Лечащий Врач
материал с сайта MedLinks.ru






