Статья посвящена механизмам развития и подходам к терапии диабетической микроангиопатии. Обсуждаются терапевтические подходы к лечению микроангиопатий, возможности применения добезилата кальция.
Сахарный диабет (СД) является глобальной медико-социальной проблемой современности в силу катастрофического роста численности больных во всем мире и тяжелых последствий заболевания для пациента. По данным Международной федерации диабета (IDF), на 2017 г. в мире насчитывалось 425 млн больных СД, а к 2040 г. прогнозируемое число больных составит 642 млн [1]. При недостаточно эффективном лечении СД может значительно ограничивать жизнь пациентов, приводить к ранней инвалидизации и преждевременной смерти из-за развития сосудистых осложнений. Хроническая гипергликемия сочетается с повреждением различных органов, особенно сердечно-сосудистой, нервной системы, почек и органа зрения [2, 3].
Хронические (сосудистые) осложнения СД разделяют на микроангиопатии и макроангиопатии. К первым относятся диабетическая нефропатия (ДН) (специфическое поражение сосудов почек) и ретинопатия (поражение сосудов глаз). Макроангиопатии (ИБС, цереброваскулярные нарушения, облитерирующие поражения периферических сосудов) обусловлены атеросклерозом, который у больных СД начинается раньше и протекает тяжелее [4]. По вине СД каждые 90 мин развивается новый случай слепоты, 60 мин — ДН, требующая гемодиализа, 19 мин — ампутация нижней конечности, 12 мин — новый случай инсульта, 19 мин — один сердечный приступ [5].
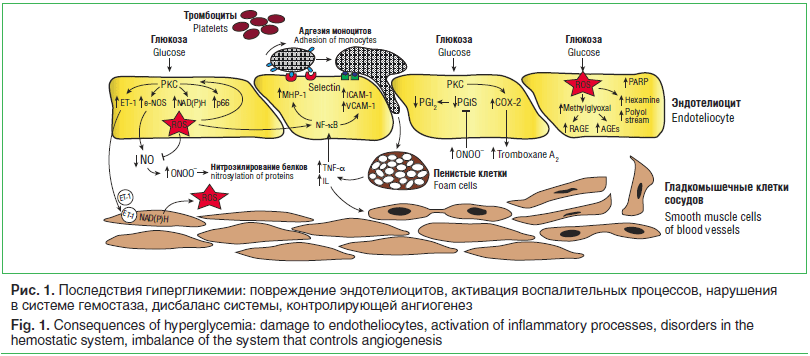
Длительная и стойкая гипергликемия — ведущий фактор развития сосудистых осложнений СД, который приводит к активации многоступенчатого каскада метаболических нарушений (рис. 1), общей конечной точкой которых являются ухудшение кровотока, гипоксия, клеточная энергетическая недостаточность, эндотелиальная дисфунк-ция [3, 6, 7]. Молекулярные механизмы развития микроангиопатий разнообразны и находятся в стадии детального изучения. Предложено несколько объяснений патологических механизмов поражения микрососудистого русла при СД. Неферментативное гликозилирование белков обусловлено способностью глюкозы образовывать с аминокислотными остатками различных белков соединения, участвующие в обмене. Последние являются исходным материалом для образования в химических реакциях веществ, которые получили название конечных продуктов гликозилирования (КПГ). Их период полураспада более длительный, чем белков (от нескольких месяцев до нескольких лет). По мере нарастания гликемии процесс гликозилирования сдвигается в сторону образования необратимых КПГ, которые накапливаются в различных тканях и сохраняются в них даже при достижении и поддержании нормогликемии. Внутриклеточная продукция КПГ, изменяя транскрипцию генов, структуру белков внеклеточного матрикса и циркулирующих белков крови, приводит к нарушению функции многих клеток, сосудистым повреждениям, повышению проницаемости базальной мембраны сосудов [4, 7]. При воздействии на КПГ-рецепторы моноцитов и макрофагов происходит активация последних, что запускает продукцию различных провоспалительных цитокинов (интерлейкина-1 (IL-1), фактора некроза опухолей-альфа (TNF-a) и факторов роста (тромбоцитарного фактора роста, трансформирующего фактора роста-бета (TGF-β)).
Хроническая гипергликемия сопровождается внутриклеточным накоплением глюкозы (в т. ч. в нейронах, эндотелии сосудов) и активацией патологических путей метаболизма глюкозы на фоне недостаточной эффективности утилизации глюкозы в пентозофосфатном пути [2, 7]. Избыток глюкозы неизбежно используется по полиоловому пути (путь ее утилизации в инсулиннезависимых тканях) с образованием сорбитола, внутриклеточное накопление которого приводит к увеличению осмолярности межклеточного пространства, отеку ткани. Накопление фруктозо-
6-фосфата стимулирует гексозаминовый путь; повышение уровня дигидроксиацетонфосфата (DGAP) приводит к продукции глицеральдегид-3-фосфата, глицерин-3-фосфата и других метаболитов, активирующих путь протеинкиназы С (РКС) [8]. Эти соединения являются предшественниками метилглиоксаля — основного вещества, приводящего к образованию КПГ.
Последствием активации РКС становится активация ядерного фактора κb (NF-κb), что приводит к снижению продукции NO, повышению уровней эндотелина-1 (ET-1), TGF-β и ингибитора активатора плазминогена-1, нарушению кровотока и возникновению окклюзии капилляров [2, 8]. Активация РКС на фоне гипергликемии способствует увеличению сосудистой проницаемости, усилению неоваскуляризации, нарушению целостности гематоретинального барьера и активации процессов перекисного окисления липидов.
Оксидативный стресс (ОС) также является важным механизмом формирования диабетических сосудистых осложнений. Гипергликемия сопровождается повышением скорости аутоокисления глюкозы с последующим увеличением свободных радикалов и развитием ОС. К метаболическому стрессу также приводит повышенное образование реактивных оксидантов, образующихся в результате аутоокисления жирных кислот в триглицеридах, фосфолипидах и эфирах холестерина [3, 8]. При этом хроническая гипергликемия снижает активность факторов антиоксидантной системы (каталазы, супероксиддисмутазы, глутатионпероксидазы). ОС и, как следствие, интенсивное перекисное окисление липидов, оказывают цитотоксическое действие, что проявляется повреждением мембран эритроцитов, лизосом; нарушается структура мембран клеток, вплоть до их разрыва; ингибируется активность цитохромоксидазы. Повреждающее действие ОС заключается также в нарушении реологических свойств крови с развитием гемостаза и тромбоза [7, 8].
Рассматривая механизмы сосудистых осложнений, нельзя не отметить состояние эндотелия у больных СД. Нормально функционирующий эндотелий отличает непрерывная базальная выработка оксида азота (NO). Биологические эффекты NO включают торможение пролиферации и миграции гладкомышечных клеток сосудов (ГМК), синтез ими коллагена, уменьшение адгезии лейкоцитов к эндотелию сосудов, торможение трансэндотелиальной миграции моноцитов, агрегации и адгезии тромбоцитов, а также антиоксидантное действие [9]. Дисбаланс между факторами, обеспечивающими нормальное функционирование эндотелия, представляет дисфункцию эндотелия, которая характерна для больных СД. Гипергликемия ингибирует продукцию NO эндотелиальными и ГМК сосудов, блокируя работу NO-синтазы и активируя генерацию активных форм кислорода. Кроме того, гипергликемия сопровождается нарушениями функционирования системы гемостаза и дисбалансом регуляторной системы, контролирующей ангиогенез (рис. 1).
Содержание статьи
Микрососудистые осложнения сахарного диабета
Диабетические микроангиопатии имеют специфическую клинико-морфологическую картину и развиваются только при СД. Наибольшего внимания среди сосудистых осложнений заслуживают диабетическая нефропатия и ретинопатия (ДР) [4]. При небольшой длительности СД 2-го типа уже 35% больных имеют непролиферативную ДР, 14% — препролиферативную, 28% — ДН на стадии микроальбуминурии, 55% — клинические стадии диабетической нейропатии [10]. При длительности заболевания более 10 лет 60% больных имеют ДР, 48% — ДН [11].
Диабетическая нефропатия
Хорошо известно, что ДН — это одно из наиболее серьезных, инвалидизирующих последствий СД 2, поскольку ведет к прогрессирующей почечной дисфункции, хронической почечной недостаточности и смерти больного [4, 12]. ДН стоит на втором месте среди причин смерти, связанных с СД 2, после сердечно-сосудистых заболеваний. Частота развития ДН колеблется в пределах 40–50% у больных СД 1 и 15–30% у больных СД 2 [13]. Клиническими исследованиями доказана устойчивая взаимосвязь между возрастом дебюта, длительностью СД и риском развития и прогрессирования ДН [14–16].
В настоящее время широко используется наднозологическое понятие хронической болезни почек (ХБП), объединяющее всех пациентов с сохраняющимися в течение 3-х и более месяцев признаками повреждения почек и/или снижением их функции, вне зависимости от первичного диагноза [17]. Для первичной диагностики патологии почек, контроля эффективности и безопасности терапии, скорости прогрессирования патологического процесса и определения прогноза важна оценка стадии почечных
нарушений по величине скорости клубочковой фильтрации (СКФ) как наиболее полно отражающей количество и суммарный объем работы нефронов и с учетом уровня альбуминурии [18–21]. Особая опасность ХБП состоит в том, что она может длительное время не вызывать никаких жалоб и изменения самочувствия, которые побудили бы больного обратиться к специалисту. Выявление ДН на ранней стадии позволяет существенно — на 10–15 лет увеличить додиализный период, наступающий при хронической почечной недостаточности [22].
Диабетическая ретинопатия
Уязвимым при гипергликемии является и орган зрения, наиболее опасным поражением которого является ДР. У лиц трудоспособного возраста среди населения развитых стран мира ДР — одна из основных причин снижения остроты зрения и слепоты, которая у больных СД наступает в 25 раз чаще, чем в общей популяции [10, 23]. Ретинальные сосудистые осложнения проявляются как у больных с СД 2, так и при СД 1, при котором относительный риск развития ДР вдвое выше, чем при СД 2 [24]. С увеличением продолжительности СД повышается вероятность сосудистых изменений в сетчатке. Показательно, что увеличение уровня HbA1c всего на 1% вдвое увеличивает риск развития ДР [23].
ДР имеет несколько стадий развития. Начальные изменения (непролиферативная ретинопатия) связаны с кровоизлияниями в ткань сетчатки, а также с просачиванием через измененную сосудистую стенку компонентов крови. Если патологическое просачивание появляется в центральных отделах глазного дна (в макулярной зоне), то сетчатка в этой области теряет свою прозрачность, что может приводить к значительному снижению зрения у таких больных — развивается диабетический макулярный отек. Развитию диабетической макулопатии способствуют два процесса: микроокклюзия капилляров (наиболее раннее проявление) и гиперпроницаемость капилляров, связанная с прорывом внутреннего гематоретинального барьера (стенки капилляров сетчатки), иногда в сочетании с нарушением наружного гематоретинального барьера (пигментного эпителия сетчатки) [25]. При этом диабетический макулярный отек не является специфическим проявлением непролиферативной ДР, а может возникать на любой стадии патологического процесса. Дальнейшие изменения связаны с нарушением проходимости сосудов (препролиферативная ДР) и разрастанием новообразованных сосудов и патологической соединительной ткани (пролиферативная ретинопатия). На этих стадиях могут происходить массивные кровоизлияния, отслойка сетчатки и, как следствие, потеря зрения [25].
Изменениям на клеточном уровне, приводящим к нарушению микроциркуляции и ангиогенеза, предшествует ряд метаболических сдвигов. Известно, что в условиях длительно существующей гипергликемии метаболические нарушения (активация полиолового и гексозаминового пути превращения глюкозы, ОС, образование КПГ, хроническое воспаление), гемодинамические факторы (ускорение кровотока, нарушение ауторегуляции тонуса сосудов, внутрикапиллярная гипертензия) играют ключевую роль в развитии и прогрессировании ДР [2, 24, 26]. Немаловажное значение в патогенезе ДР имеют и гемореологические факторы (нарушения в системе коагуляционного звена гемостаза, активация тромбоцитов), нарушение ангиогенного баланса, что приводит к образованию микротромбов, ишемии сетчатки. Сетчатка является структурой с относительно высокой метаболической активностью, уровнем клеточного дыхания и потребностью в кислороде, поэтому ишемия ткани может привести к необратимым последствиям.
В результате активации всех этих путей повреждаются нервные элементы сетчатки и контактирующие с ее слоями капилляры хориоидеи (т. е. развивается микроангиопатия). Хотя нарушение микроциркуляции служит классическим признаком осложнений СД, известно, что нейродегенерация сетчатки происходит раньше. Нейродегенерация сопровождается апоптозом нейронов и дисфункцией глии, а ранние аномалии микроциркуляции характеризуются увеличением проницаемости сосудов, нарушением микрососудистой гемодинамики и вазорегрессией (утратой перицитов и повреждением эндотелия) [26]. Прогрессирующая дисфункция эндотелиальных клеток играет решающую роль в следующих морфоструктурных и патофизиологических изменениях сетчатки: в утолщении мембраны капиллярного базального сосуда, потере периваскулярных клеток, повреждении барьера сетчатки и неоваскуляризации [9, 27].
Роль добезилата кальция в терапии осложнений СД
При ДР, как и при других осложнениях СД, первоочередное значение придается достижению целевого гликемического контроля, поскольку cуществует сильная связь между уровнем HbA1c в крови и риском развития ретинопатии [23, 28]. Вместе с тем одним из терапевтических подходов является применение ангиопротекторов, благоприятно влияющих на микроциркуляцию, функциональное состояние эндотелия и базальной мембраны сосудистой стенки и препятствующих развитию структурных изменений сосудистой стенки. К настоящему времени накоплена определенная доказательная база по применению синтетического ангиопротектора — добезилата кальция (ДК) Докси-Хема (Сербия) при различных заболеваниях, сопровождающихся нарушением сосудистой проницаемости и микроциркуляции, в т. ч. при диабетических микроангиопатиях. ДК зарекомендовал себя как препарат, улучшающий прогноз при ДР и ДН [25, 26, 29, 30].
Основное действие ДК реализуется на уровне системы микроциркуляции (рис. 2). Ангиопротективное действие ДК обусловлено целым комплексом фармакологических эффектов в отношении патофизиологических процессов при микроангиопатиях, в числе которых антиоксидантные, противовоспалительные свойства, улучшение эндотелий-
зависимой вазодилатации, реологии крови и др. [31, 32].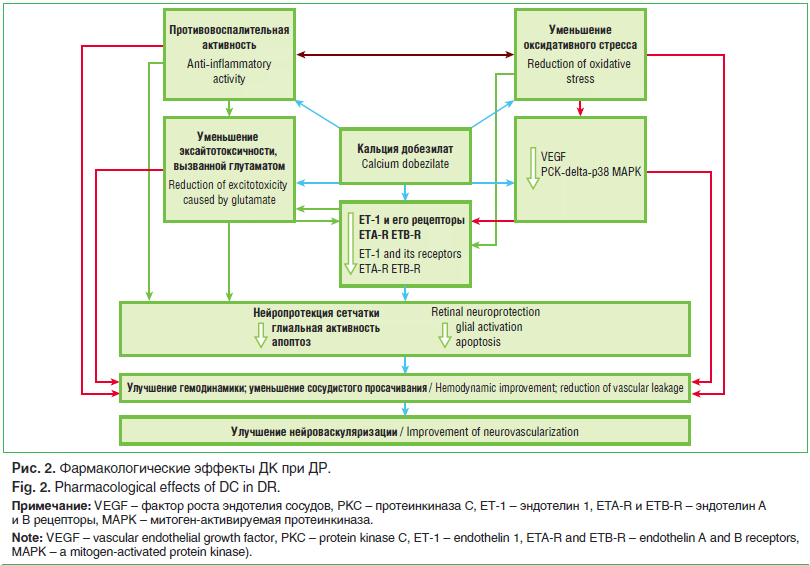
У больных СД значительно снижена продукция NO, а дисфункция эндотелия носит генерализованный характер [9], что является одним из ранних маркеров развития сосудистых нарушений. В этом плане важным свойством ДК является его способность повышать активность NO-синтазы, тем самым увеличивая синтез NO и улучшая эндотелий-зависимую вазодилатацию [33, 34]. Применение ДК сопровождается снижением уровня эндотелина-1, что связано с уменьшением тромбоксана А2, снижением уровня свободных радикалов и вязкости крови [33, 34]. Интерес представляет исследование J. Dong, в котором оценивалась эффективность ДК и ингибитора АПФ [35]. Пациенты были случайным образом распределены по трем группам (плацебо, ДК и периндоприл). В обеих группах лечения наблюдалось сравнимое снижение альбуминурии. Однако оценка динамики маркеров эндотелиальной дисфункции, таких как эндотелин-1 и NO, выявила явное преимущество ДК по сравнению с ингибитором АПФ.
Другими важными эффектами ДК, направленными на патогенетические механизмы сосудистых осложнений, являются ингибирование NF-kB и p38 митоген-активируемой протеинкиназы (p38 MAPK), уменьшение экспрессии молекул межклеточной адгезии-1 (ICAM-1) и адгезии сосудистого эндотелия-1 (VCAM-1), а также уменьшение содержания C-реактивного белка [33–36]. Стоит отметить дозозависимый антиангиогенный эффект ДК. Препарат ингибирует как сосудистый эндотелиальный фактор роста, вызывающий эндотелиальную пролиферацию и повышение сосудистой проницаемости, так и фактор роста фибробластов [32, 37].
Большой интерес представляет применение ДК и с позиции воздействия на систему тромбоцитарно-коагуляционного гемостаза. Повышенная вязкость крови обусловливает ее стаз (особенно в капиллярах и посткапиллярных венулах), которые поражаются уже на ранних стадиях диабетических микроангиопатий. Препарат способствует уменьшению агрегации тромбоцитов, снижает уровень фибриногена, тем самым улучшая реологию крови [33, 37, 38]. В частности, в исследовании С.А. Коротких и соавт. [39] было показано, что у пациентов с препролиферативной и непролиферативной ДР включение в комплексную терапию ДК способствовало увеличению остроты зрения, уменьшению извитости сосудов и калибра вен, значительному уменьшению количества и величины мягких экссудатов, сокращению количества микроаневризм.
Расширению представлений о механизмах действия ДК способствовали и результаты исследования X. Zhang et al. [40], изучавших эффективность ДК при использовании у пациентов с СД 2 и ДН (n=121). К концу периода наблюдения (12 нед.) было отмечено достоверное снижение скорости экскреции альбумина с мочой. С целью оценки безопасности клинического применения ДК был выполнен анализ данных литературы, опубликованных с 1970 по 2003 г., с фокусом на оценку профиля безопасности препарата. В результате был сделан вывод, что риск побочных явлений, связанных с применением ДК в дозе 500–1500 мг/сут, является низким [41].
Заключение
Таким образом, добезилат кальция (Докси-Хем) продемонстрировал эффективность в отношении патогенетических механизмов, ведущих к развитию и прогрессированию диабетических микрососудистых осложнений [42]. Данный представитель группы ангиопротекторов может эффективно применяться как для профилактики, так и для комплексной терапии СД на ранних стадиях ДР и ДН с целью предупреждения дальнейшего развития проявлений заболевания и регресса уже имеющихся изменений, что помогает улучшить качество и прогноз жизни пациентов. Бесспорным преимуществом ДК является хороший профиль его переносимости и безопасности.
Сведения об авторах: Бирюкова Елена Валерьевна — д.м.н., профессор ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России. 127473, Российская Федерация, г. Москва, ул. Делегатская, д. 20, стр. 1. Шинкин Михаил Викторович — эндокринолог ГБУЗ МКНЦ им. А.С. Логинова ДЗМ. 111123, г. Москва, шоссе Энтузиастов, д. 86. Контактная информация: Бирюкова Елена Валерьевна, e-mail: lena@obsudim.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 19.04.2018.
About the authors: Elena V. Birukova — MD, PhD, professor in A.I. Yevdokimov Moscow State University of Medicine and Dentistry. 20, build. 1, Delegatskaya str., Moscow, 127473, Russian Federation. Mikhail V. Shinkin — endocrinologist in the Loginov Moscow Clinical Scientific Center. 86, Shosse Entuziastov, Moscow, 111123, Russian Federation. Contact information: Elena V. Birukova, e-mail: lena@obsudim.ru. Financial Disclosure: no author has a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 19.04.2018.
материал с сайта https://www.rmj.ru/
