Цель исследования: показать возможности отечественного биологически активного комплекса АндроДоз® для лечения идиопатического мужского бесплодия.
Материал и методы: в исследовании участвовали 30 мужчин из бесплодных пар в возрасте 25−45 лет. Исследование эякулята проводили в соответствии с рекомендациями ВОЗ. Определяли содержание активных форм кислорода в нативном эякуляте и отмытых сперматозоидах. Повреждение хромосом сперматозоидов характеризовали по фрагментации ДНК, оцениваемой методом дисперсии хроматина в агарозном геле. Анализ эякулята проводили до и во время лечения препаратом АндроДоз® перорально по 4 капсулы в сутки (по 2 утром и вечером).
Результаты: через 1,5 мес. лечения у 2/3 пациентов наблюдалось уменьшение процента и степени фрагментации ДНК в среднем на 5 и 10% соответственно (р
Выводы: препарат АндроДоз® может применяться при лечении идиопатического мужского бесплодия с признаками оксидативного стресса и нарушениями целостности ДНК сперматозоидов; на данную терапию позитивными изменениями качества спермы реагируют около 2/3 пациентов.
Ключевые слова: мужское бесплодие, оксидативный стресс, фрагментация ДНК, антиоксиданты.
Для цитирования: Божедомов В.А., Липатова Н.А., Божедомова Г.Е., Щербакова Е.В., Комарина Р.А. Применение комплекса нутриентов для лечения мужского бесплодия // РМЖ. 2016. №23. С. 1546-1552
Bozhedomov V.A.1−4, Lipatova N.A.2, Bozhedomova G.E.2,3, Shcherbakova E.V.2, Komarina R.A.2
1 Outpatient Department No. 1 of the Department for Presidential Affairs, Moscow
2 N.A. Semashko Road Clinical Hospital, Moscow
3 .M. Sechenov First Moscow State Medical University
4 Peoples’ Friendship University of Russia, Moscow
Half of the barren marriage cases accounts for male infertility. The most common causes (35−40%) of male infertility are idiopathic oligospermia, asthenospermia, and/or teratospermia. In these cases, abnormal sperm quantity and quality are not associated with anamnestic risk factors, abnormal medical examinations or hormonal imbalances. Antioxidants are popular agents for male infertility, however, their efficacy is controversial.
Aim. To analyze the efficacy of domestic bioactive additive AndroDoz® for idiopathic male infertility.
Patients and methods. 30 men from infertile couples aged 25−45 were enrolled. Ejaculate was examined according to WHO recommendations (including ROS measurement in native ejaculate and washed spermatozoa). Chromosomal aberrations in spermatozoa were assessed by DNA fragmentation evaluated with sperm chromatin dispersion test. Ejaculate was tested before and in the course of the treatment (oral AndroDoz® 2 capsules twice a day).
Results. After 1.5 months, the percentage and the degree of DNA fragmentation reduced by 5% and 10%, respectively, in two-third of the patients (p<0.01). The severity of oxidative stress decreased more than twice in 70% of the patients (p<0.05). Standard spermogram parameters remained unchanged.
Conclusions. AndroDoz® can be recommended for idiopathic male infertility with oxidative stress and altered DNA integrity of spermatozoa. Two-third of the patients respond to this treatment demonstrating sperm quality improvement.
Key words: male infertility, oxidative stress, DNA fragmentation, antioxidants.
For citation: Bozhedomov V.A., Lipatova N.A., Bozhedomova G.E. et al. Food additive for male infertility // RMJ. 2016. № 23. P.1546 –1552.
В статье рассматривается применение комплекса нутриентов для лечения мужского бесплодия
Содержание статьи
Введение
Мужской фактор имеет место в половине случаев бесплодного брака [1−4]. В настоящее время принято считать, что наиболее частой причиной мужского бесплодия − 35−40% случаев − являются идиопатическая олиго-, астено- или тератозооспермия, когда нарушения в количественных и качественных показателях спермы наблюдаются при отсутствии анамнестических факторов риска, отсутствии нарушений в результатах медицинского осмотра и гормональных исследований [2−7].
Большое количество различных лекарственных препаратов испытывали в таких случаях в целях улучшения качества спермы [2−12]. В последние годы активно используют антиоксиданты, которые представляют собой природные или синтетические биомолекулы, препятствующие повреждению клеток вследствие оксидативного стресса (ОС), вызванного действием избыточного количества активных форм кислорода (АФК) [13−17]. К антиоксидантам относят витамины Е, С, А, карнитины, цинк, селен, растительные экстракты и некоторые другие препараты и вещества. Несколько рандомизированных клинических испытаний показали возможность применения антиоксидантных добавок для лечения мужской субфертильности [10, 18−20]. По результатам метаанализов M.G. Showell et al. [21] антиоксиданты улучшают жизнеспособность, концентрацию и прогрессивную подвижность, связывание с яйцеклеткой, снижают фрагментацию ДНК сперматозоидов, повышают процент беременностей при естественном зачатии и программах вспомогательных репродуктивных технологий. Но характеризуя качество включенных в анализ исследований, авторы обзора отмечают, что уровень доказательности при этом «низкий» и «очень низкий». Авторы заключают: «Антиоксиданты, возможно, могли быть эффективны в лечении субфертильных мужчин, но представление результатов исследований было слишком непоследовательным, чтобы быть уверенными в этих результатах» [21]. По мнению E.G. Hughes et al. [8], комбинация антиоксидантов более эффективна: вероятность спонтанной беременности повышается в 4,2 раза (95% ДИ 2,7−6,6), рождения детей – в 4,9 раза (95% ДИ 1,9−12,2). Невысокая стоимость и относительно низкий риск токсичности антиоксидантов являются привлекательными для пациентов и врачей, поэтому они рекомендованы Европейской ассоциацией урологов (EAU) для лечения мужского бесплодия, однако, как подчеркивается в последнем Руководстве EAU, не для идиопатических форм [4].
Цель настоящего исследования: показать возможности отечественного биологически активного комплекса АндроДоз® для лечения идиопатического мужского бесплодия. АндроДоз® является дополнительным источником L-карнозина, карнитина, коэнзима Q10, глицирризиновой кислоты, селена, цинка, витаминов Е и А.
Материал и методы
Исследование проходило в период с февраля по июль 2016 г. В нем участвовали 30 мужчин из бесплодных пар в возрасте 25−45 лет. Критериями включения в исследование являлись:
• отсутствие беременности в браке более 12 мес. половой жизни без контрацепции;
• наличие сперматозоидов в эякуляте;
• идиопатическая олиго-, астено- или тератозооспермия;
• отсутствие инфекций репродуктивного тракта (Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis, Trichomonas vaginalis), диагностированных методом полимеразной цепной реакции;
• отсутствие клинических и лабораторных признаков воспалительного процесса дополнительных половых желез;
• отсутствие выраженных аутоиммунных реакций против сперматозоидов, когда антиспермальные антитела (АСАТ) покрывают не более десятой части подвижных гамет (MAR IgG
• отсутствие пальпируемого варикоцеле;
• отсутствие выраженной соматической патологии;
• отсутствие психосексуальной и эякуляторной дисфункций.
Критериями исключения являлись:
• установленные генетические причины бесплодия (синдром Клайнфельтера, микроделеции AZF, CFTR);
• азооспермия;
• пиоспермия;
• гиперпродукция фолликулостимулирующего гормона;
• пальпируемое варикоцеле, подтвержденное результатами УЗИ;
• наличие иммунного фактора бесплодия (MAR IgG>10%);
• выраженная соматическая патология;
• психосексуальная и эякуляторная дисфункции.
Исследование эякулята проводили в соответствии с требованиями ВОЗ [22]: определяли концентрацию, подвижность и долю нормальных форм, вычисляли количество прогрессивно подвижных сперматозоидов в эякуляте и интегральный индекс качества спермы (объем эякулята × концентрация сперматозоидов × доля прогрессивно подвижных форм × доля нормальных форм). Методом смешанной реакции агглютинации определяли процент подвижных сперматозоидов, покрытых АСАТ (SpermMar Kit, FertiPro, Belgium). Оценку ОС осуществляли путем определения интенсивности свободнорадикальных процессов методом люминолзависимой хемилюминесценции [23] с использованием люминометра «LKB-Wallac 1256» (Финляндия) и «Хемилюминометра-003» (Россия). Об интенсивности хемилюминесценции судили по светосумме и максимальной амплитуде свечения, которые соответствовали скорости образования АФК. Определяли АФК в нативном эякуляте и отмытых сперматозоидах в соответствии с протоколом, описанным в Руководстве ВОЗ [22]. Повреждение хромосом сперматозоидов характеризовали по фрагментации ДНК, оцениваемой методом дисперсии хроматина (Halosperm®; Halotech DNA, Spain) в геле инертной агарозы с визуальной оценкой под микроскопом образования ореола после кислотной денатурации ДНК и лизирования протеинов ядра [24]. В соответствии с рекомендациями производителя тест-системы оценивали процент сперматозоидов с признаками апоптоза и степень нарушения образования ореола по 5-балльной шкале.
Анализ эякулята проводили до и во время лечения препаратом АндроДоз® перорально по 4 капсулы в сутки (по 2 утром и вечером). В нескольких отечественных публикациях уже были описаны эффекты применения данного препарата у мужчин [25−29]. Особенность нашего исследования заключалась в оценке не только показателей стандартной спермограммы, но и продукции АФК и состояния хроматина, который нередко нарушен при ОС [21, 30].
Обработку эмпирических данных проводили с использованием программы «Statistica» (StatSoft, USA). Средние значения по группам представляли в виде M±SD, медианы, 25−75% процентилей, диапазона «невыпадающих значений». На графиках Box-and-whisker «выпадающими» являлись точки, находящиеся далеко от центра распределения и нехарактерные для него (возможно, это результаты ошибок наблюдения или выбросы). Значимость различий между группами проверяли с помощью критерия Стьюдента для попарно связанных вариант (t), знаков (Z), Вилкоксона (W); различия считали значимыми при p
Мы представляем данные об эффектах, наблюдаемых в ранние сроки (1,5 мес.) лечения.
Результаты
Средний возраст пациентов, включенных в исследование, составлял 34,0+6,95 года. Первичное бесплодие было у 18 человек (59%), длительность бесплодия составляла в среднем по группе 28,9±15,9 мес.
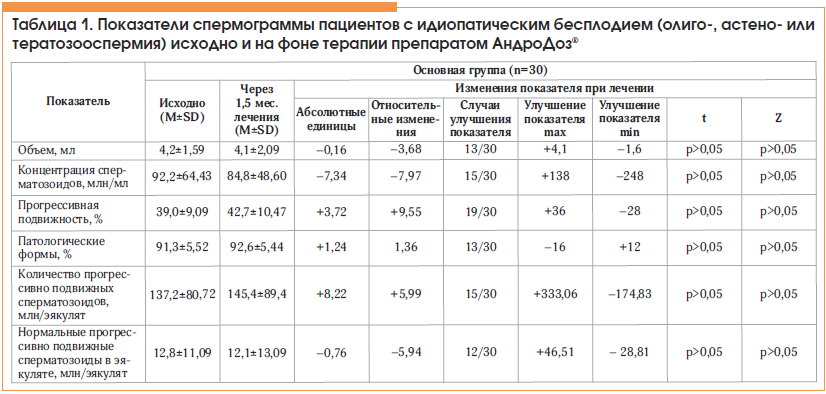
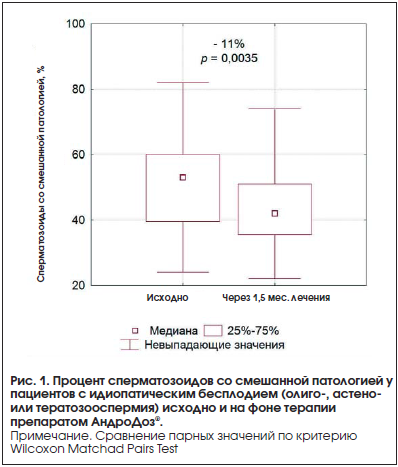
Основные показатели спермограммы – объем эякулята, концентрация, процент прогрессивно подвижных и морфологически нормальных сперматозоидов через 1,5 мес. лечения существенных изменений не претерпели (табл. 1). Соответственно не изменились и интегральные расчетные величины: количество прогрессивно подвижных сперматозоидов в эякуляте и индекс качества спермы (см. табл. 1; p>0,05). В то же время отмечено статистически значимое уменьшение процента сперматозоидов со смешанной патологией: в абсолютных значениях − 8% для средней по группе и 11% для медианы (рис. 1; p
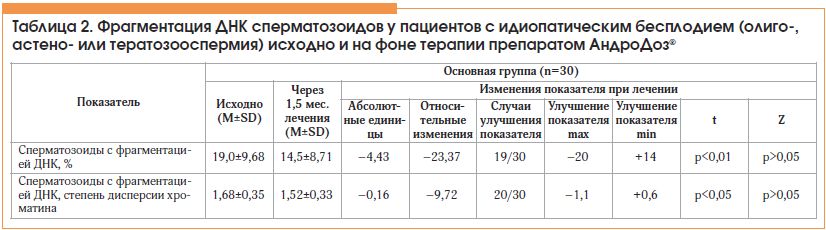
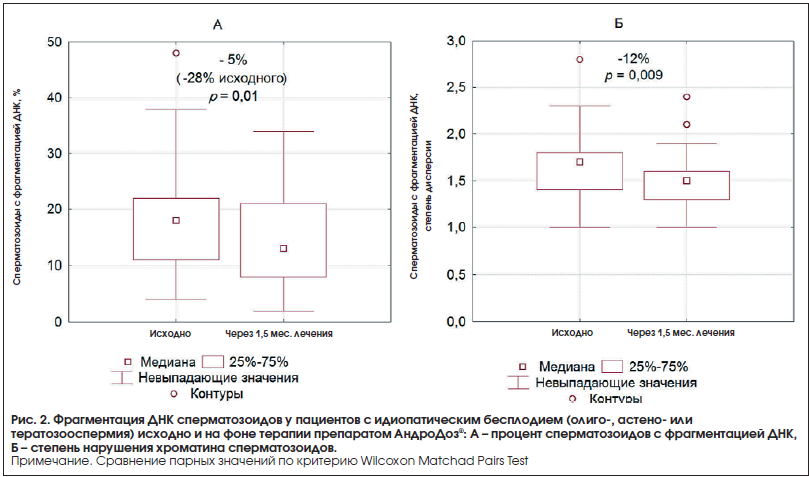
Через 1,5 мес. лечения наблюдалось значимое уменьшение повреждения ДНК сперматозоидов (табл. 2; рис. 2). Процент сперматозоидов с фрагментацией ДНК в абсолютных значениях снижался в среднем по группе на 4%, медиана – на 5% (относительно исходного уровня −23% для средней, p<0,01 и −28% для медианы, р=0,01); меньше стала степень выраженности таких нарушений, оцениваемых по степени дисперсии хроматина (−10% для средней, p<0,05 и −12% для медианы, p<0,01). Положительная динамика фрагментации ДНК на фоне лечения имела место у 67% мужчин (p>0,05).
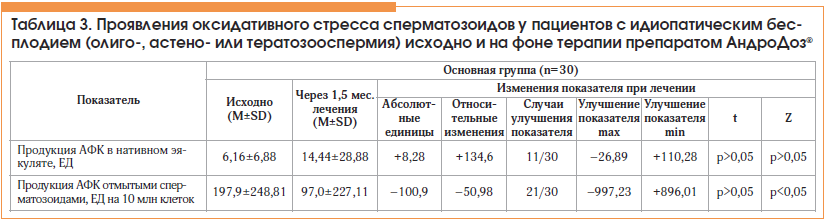
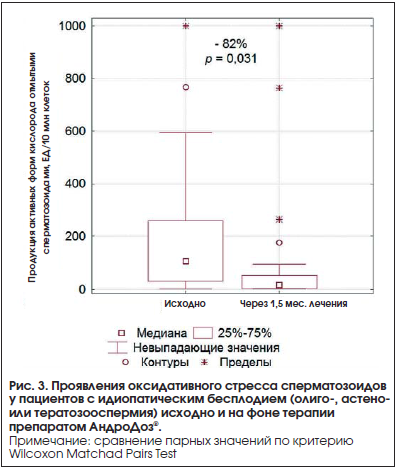
На фоне лечения статистически значимо уменьшилась выраженность ОС, о чем свидетельствовало уменьшение продукции АФК отмытыми сперматозоидами в 70% случаев (табл. 3; p<0,05) в среднем по группе более чем в 2 раза; изменения медианы были еще более наглядны – −82% (рис. 3; p<0,05). При этом продукция АФК в нативном эякуляте изменялась статистически несущественно и даже имела тенденцию к повышению (см. табл. 3; p>0,05).
Обсуждение
Антиоксиданты – популярные препараты для лечения нарушений качества спермы, по данным разных публикаций [3, 8, 10, 15, 21 и др.]. Различные фармкомпании предлагают готовые комплексы нутриентов, способных, по мнению производителей, улучшать мужскую фертильность. Наши данные подтвердили положительный эффект отечественного комплекса АндроДоз® при мужском бесплодии, связанном с ОС. Продукция АФК отмытыми сперматозоидами уменьшалась, по данным нашего исследования, в среднем в 2−5 раз по сравнению с исходным уровнем. Выраженность внутриклеточного ОС, оцениваемого по продукции АФК отмытыми сперматозоидами, имеет особое значение, поскольку непосредственная близость между сперматогенными свободными радикалами и ДНК сперматозоида обусловливает их наибольшую роль в нарушении фертильности.
Одновременно происходило уменьшение процента сперматозоидов с фрагментацией ДНК и выраженность таких нарушений хроматина. Снижение индекса фрагментации составило в среднем 4−5% в абсолютных значениях, или почти четверть от исходного уровня. Поскольку взаимосвязь между количеством АФК в сперме, выраженностью ОС сперматозоидов и фрагментацией их ДНК признается большинством специалистов [8, 13, 15, 21, 30], такие результаты нашего исследования представляются вполне логичными.
В то же время было установлено, что положительная динамика продукции АФК и фрагментации ДНК на фоне лечения имела место только в 2/3 случаев. При этом не всегда улучшение данных показателей наблюдалось при высоких уровнях ОС и фрагментации ДНК и наоборот. Нам остается непонятным, почему уменьшилась выраженность внутриклеточного ОС, оцениваемого по продукции АФК отмытыми сперматозоидами, но не изменилась продукция АФК в нативном эякуляте, ведь антиоксиданты должны были химически связать активные радикалы и в том и в другом случае. Поскольку в данное исследование были включены пациенты без признаков инфекционно-воспалительного процесса, эффект трудно объяснить влиянием спермальных лейкоцитов. Выяснение данных закономерностей должно стать предметом дальнейших исследований.
Одновременно полученные нами данные показали, что стандартные показатели спермограммы – объем, концентрация, подвижность и морфология сперматозоидов − менялись на фоне проведенного лечении несущественно, в то время как, по данным А.А. Камалова и соавт. [25], увеличение показателей спермограммы происходит в 87,6%, по данным М.К. Алчинбаева и соавт. [26] − в 92% случаев. Е.С. Дендеберов и соавт. [27] пишут о том, что применение АндроДоза через 3 мес. привело к увеличению объема эякулята на 45,7%, концентрации сперматозоидов на 18,5%, общей подвижности на 33,7%, активной подвижности на 38,4% и количества морфологически нормальных форм на 50%. Данные А.А. Проскурина и соавт. [28] еще более оптимистичны: увеличение объема в 1,95 раза, подвижности в 7,43 раза, концентрации в 1,53 раза и процента нормальных форм в 6,75 раза от исходных значений. Однако такие данные вызывают сомнения: на сегодняшний день не существует способов лечения, способных увеличить долю нормальных форм на 50−675% [2−8].
Отсутствие значимого улучшения показателей стандартной спермограммы в нашем исследовании (за исключением уменьшения процента сперматозоидов со смешанной патологией, положительная динамика данного показателя имела место в 80% случаев), возможно, объясняется тем, что период наблюдения составил лишь 1,5 мес., в то время как продолжительность цикла сперматогенеза, включая период прохождения через придаток, составляет порядка 3-х месяцев [2−4, 7]. Возможно, улучшение других показателей стандартной спермограммы может произойти при более длительном применении препарата. Также очевидно, что имеют значение исходные показатели спермограммы: степень олиго-, астено- и тератозооспермии и их сочетания. Уточнение возможностей препарата при лечении различных форм патозооспермии станет предметом обсуждения в последующих публикациях.
Вывод о том, что применение коммерческих витаминных и антиоксидантных комплексов не всегда приводит к выраженному улучшению параметров стандартной спермограммы, согласуется с данными ряда зарубежных контролируемых исследований [21, 31, 32]. Так, назначение комплекса антиоксидантов показало улучшение подвижности сперматозоидов только в 3 из 6 подобных исследований [33−35], концентрация увеличилась только в 1 из 6 [36].
Возможно, эффективность того или иного антиоксидантного препарата зависит от его качественного и количественного состава. Эффективные дозы монопрепаратов антиоксидантов, по данным ряда обзоров, составляют: витамин Е >300 мг/сут, витамин С >1000 мг/сут, карнитины (L- и acetyl-) >3000 мг/сут, селен – 100−225 мкг/сут, коэнзим Q10 – 60−200 мг/сут, цинк (ZnSO4) – 66−400 мг/сут, глутатион – 600 мг/сут [20, 21, 31, 37], что значительно превышает установленные суточные верхние допустимые уровни потребления для этих веществ и делает небезопасным их длительное применение. Несбалансированные антиоксидантные комплексы могут вызвать чрезмерную элиминацию свободных радикалов кислорода, необходимых для нормального протекания акросомной реакции и капацитации сперматозоидов [20, 27, 31, 37] и индуцировать восстановительный стресс в качестве ребаунд-эффекта. Имеются данные, что при переизбытке антиоксидантов наблюдается увеличение деконденсации ядерного хроматина сперматозоидов более 20%, что, по мнению F. Absalan, Y. Menezo et al., приводит к привычному невынашиванию беременности [38, 39]. Изменение структуры хроматина может вызвать изменения в экспрессии генов и повлиять на процесс имплантации в результате асинхронной конденсации хромосом, а также наличия цитоплазматических фрагментов в эмбрионе. Установлено, что длительный прием такого известного антиоксиданта, как аскорбиновая кислота, или высокие ее дозировки имеют весьма неоднозначное значение для стимуляции сперматогенеза. Витамин С в гипердозах разрушает дисульфидные связи белков, способствуя их денатурации, что приводит к окислению мембран в фазе I и III сперматогенеза и неправильной упаковке ДНК [40].
Поэтому зачастую коммерчески выпускаемые препараты представляют собой компромисс, где низкие (безопасные для применения, на уровне физиологических) дозировки антиоксидантов компенсируются широким набором действующих веществ, в надежде на их синергизм.
Таким образом, несмотря на все преимущества антиоксидантной терапии, назначать препараты этой группы следует с определенной осторожностью, выбирая сбалансированные препараты с хорошей доказательной базой.
Кроме того, антиоксиданты могут быть эффективны только в случае избытка АФК и развития ОС. Поскольку ОС является причиной ухудшения качества спермы далеко не всегда − в 30−80% случаев, по данным M.G. Showell et al. [21], и около 40% по нашим данным [13], − назначение антиоксидантов для лечения мужского бесплодия кажется оправданным только для этих случаев.
Очевидно, поэтому Руководство EAU [4] также не рекомендует назначать прием антиоксидантов всем мужчинам подряд с идиопатическим бесплодием. В настоящее время имеются убедительные данные об эффективности приема мужчинами оральных антиоксидантов лишь при подготовке пары к последующему экстракорпоральному оплодотворению, в то время как роль антиоксидантов в процессе естественного зачатия пока нуждается в дальнейшем изучении [4].
Исходя из последнего, посвященного настоящей теме Кохрановского обзора M.G. Showell et al. [21], включающего 48 исследований, в которых сравнивали монокомпонентные и комбинированные антиоксиданты с плацебо, отсутствием лечения или другим антиоксидантом в популяции из 4179 субфертильных мужчин, антиоксиданты, по всей вероятности, все же являются эффективными в качестве прегравидарной подготовки у субфертильных мужчин. Ожидаемая частота наступления клинической беременности для субфертильных мужчин, которые не принимали каких-либо антиоксидантов, составила 6 случаев из 100 по сравнению с 11−28 случаями из 100 мужчин, принимавших антиоксиданты. Также результаты обзора показали, что ожидаемый уровень живорождений для субфертильных мужчин в группе плацебо или без терапии составляет 5 из 100 по сравнению с мужчинами, принимавшими антиоксиданты, – от 10 до 31 из 100.
Таким образом, нами показано, что применение отечественного комплекса АндроДоз® в дозе 4 капсулы в сутки уже через 1,5 мес. лечения приводит к улучшению качества сперматозоидов − значимому уменьшению процента сперматозоидов со смешанной патологией и/или фрагментацией ДНК на фоне уменьшения продукции АФК отмытыми сперматозоидами, что связано с уменьшением выраженности ОС мужских гамет.
Целостность мужской ДНК имеет жизненно важное значение для взаимодействия сперматозоида и яйцеклетки, оплодотворения и раннего эмбрионального развития, в связи с чем полученные результаты представляют несомненный практический интерес.
Выводы
1. Препарат АндроДоз® может применяться при лечении идиопатического мужского бесплодия с признаками ОС и нарушениями целостности ДНК сперматозоидов; на данную терапию позитивными изменениями качества спермы реагируют около 2/3 пациентов.
2. На фоне данного лечения статистически значимо уменьшается продукция АФК отмытыми сперматозоидами, что свидетельствует об уменьшении выраженности ОС мужских гамет.
3. На фоне данного лечения происходит значимое улучшение структуры ДНК сперматозоидов у 67% мужчин.
4. Отмечено статистически значимое уменьшение процента сперматозоидов со смешанной патологией в спермограмме в 80% случаев.
5. За 1,5 мес. лечения препаратом АндроДоз® значимого улучшения остальных показателей спермограммы (объем, концентрация, доля прогрессивно подвижных и морфологически нормальных форм) не наблюдалось, изменения этих показателей имели разнонаправленный характер.
6. Существенно ограничивали исследование отсутствие контрольной группы, непродолжительность наблюдения и отсутствие учета наступивших беременностей. Соответственно требуются дополнительные исследования.
Литература
1. WHO Manual for the Standardized Investigation, Diagnosis and Management of the Infertile Male. Cambridge: Cambridge University Press, 2000; 91.
2. Andrology: Male Reproductive Health and Disfunction. 3rd. E.Nieschlag., H.M. Behre, S. Nieschlag (Ed.), 2010; 629.
3. Male infertility / S.J. Parekattil, A. Agarwal (Ed.), 2012, Springer; 518.
4. Jungwirth A. (Ed.), Diemer T., Dohle G.R. et al. Guidelines on Male Infertility. © European Association of Urology. 2016; 42.
5. Сухих Г.Т., Божедомов В.А. Мужское бесплодие. Практическое руководство для урологов и гинекологов, М.: Эксмо, 2009. 240 с.: ил. Медицинская практика [Suhih G.T., Bozhedomov V.A. Muzhskoe besplodie. Prakticheskoe rukovodstvo dlja urologov i ginekologov, M.: Jeksmo, 2009. 240 s.: il. Medicinskaja praktika (in Russian)].
6. Божедомов В.А. Мужской фактор бездетного брака – пути решения проблемы. Урология. 2016. № 1 (Приложение 1). С. 28–34 [Bozhedomov V.A. Muzhskoj faktor bezdetnogo braka – puti reshenija problemy. Urologija. 2016. № 1 (Prilozhenie 1). S. 28– 34 (in Russina)].
7. Mirone V. (Ed.). Clinical Uro-Andrology. Springer; 2015. P. 197–205.
8. Hughes E.G., Grantmyre J., Zini A. An integrated approach to male-factor subfertility: bridging the gap between fertility specialists trained in urology and gynaecology // J Obstet Gynaecol Can. 2015 Mar. Vol. 37(3). P. 258–265.
9. Jae Hung Jung, Ju Tae Seo. Empirical medical therapy in idiopathic male infertility: Promise or panacea? // Clin Exp Reprod Med. 2014. Vol. 41(3). P. 108–114.
10. Singh A., Jahan N., Radhakrishnan G. et al. To Evaluate the Efficacy of Combination Antioxidant Therapy on Oxidative Stress Parameters in Seminal Plasma in the Male Infertility // J Clin Diagn Res. 2016. Vol. 10(7). P. 14–17.
11. Garolla A., Ghezzi M., Cosci I. et al. FSH treatment in infertile males candidate to assisted reproduction improved sperm DNA fragmentation and pregnancy rate. Endocrine. 2016 Jul 27. [Epub ahead of print].
12. Simoni M., Santi D., Negri L. et al. Treatment with human, recombinant FSH improves sperm DNA fragmentation in idiopathic infertile men depending on the FSH receptor polymorphism p.N680S: a pharmacogenetic study // Hum Reprod. 2016 Sep. Vol. 31(9). P. 1960–1969.
13. Божедомов В.А., Торопцева М.В. Ушакова И.В. и соавт. Активные формы кислорода и репродуктивная функция мужчин: фундаментальные и клинические аспекты (обзор литературы) // Андрология и генитальная хирургия. 2011. №. 3. С. 26–33 [Bozhedomov V.A, Toropceva M.V. Ushakova I.V. i soavt. Aktivnye formy kisloroda i reproduktivnaja funkcija muzhchin: fundamental’nye i klinicheskie aspekty (obzor literatury). Andrologija i genital’naja hirurgija. 2011. № 3. S. 26–33 (in Russian)].
14. Zini A., Fischer M.A., Nam R.K. et al. Use of alternative and hormonal therapies in male infertility. Urology 2004. Vol. 63. P. 141–143.
15. Tremellen K. Oxidative stress and male infertility – a clinical perspective. Hum.Reprod.Update. 2008. Vol. 14(3). P. 243–258.
16. Agarwal A., Sekhon L.H. Oxidative stress and antioxidants for idiopathic oligoasthenoteratospermia: Is it justified? // Indian J Urol 2011. Vol. 27. P. 74.
17. Sabeti P., Pourmasumi S., Rahiminia T. et al. Etiologies of sperm oxidative stress. Int J Reprod BioMed 2016. Vol. 14. P. 231–240.
18. Akmal M., Qadri J.Q., Al-Waili N.S. et al. Improvement in human semen quality after oral supplementation of vitamin C // J Med Food. 2006 Fall. Vol. 9(3). P. 440–442.
19. Ross C., Morriss A., Khairy M. et al. A systematic review of the effect of oral antioxidants on male infertility // Reprod Biomed Online. 2010. Vol. 20(6). P. 711–123.
20. Zini A., Al-Hathal N. Antioxidant therapy in male infertility: fact or fiction? // Asian J Androl. 2011. Vol. 13(3). P. 374–381.
21. Showell M.G., Mackenzie-Proctor R., Brown J. et al. Antioxidants for male subfertility. Cochrane Database Syst Rev. 2014. (12):CD007411. doi: 10.1002/14651858.CD007411.pub3. Epub 2014 Dec 15.
22. WHO (2010) WHO Laboratory Manual for the Examination and Processing of Human Semen, 5th edn. WHO, Geneva.
23. Agarwal A., Deepinder F. Determination of seminal oxidants (reactive oxygen species) // Infertility in the Male, 4th edn (eds L.I. Lipshults, S.S. Howards & C.S. Niederberger), 2009. P. 618–632.
24. Gosalvez J., Lopez-Fernandez C., Fernandez J.L.Sperm chromatindispersion test: technical aspects and clinical applications // Sperm Chromatin. Biological and Clinical Applications in MaleInfertility and Assisted Reproduction. Zini A., Agarwal A. (Eds.), Springer. 2011. P. 151–170.
25. Камалов А.А., Абоян И.А., Ситдыкова М.Э. и соавт. Применение биологически активного комплекса Андродоз® у пациентов с патоспермией и иммунолгическим фактором инфертильности. Результаты мультицентрового клинического исследования // Фарматека. 2014. № 4. С. 29–40 [Kamalov A.A., Abojan I.A., Sitdykova M.Je. i soavt. Primenenie biologicheski aktivnogo kompleksa Androdoz® u pacientov s patospermiej i immunolgicheskim faktorom infertil’nosti. Rezul’taty mul’ticentrovogo klinicheskogo issledovanija. Farmateka. 2014. № 4. S. 29–40 (in Russian)].
26. Алчинбаев М.К., Медеубеков У.Ш., Хусаинов Т.Э. и соавт. Новые подходы к лечению патоспермии // Урология. 2013. № 2. С. 46–49 [Alchinbaev M. K., Medeubekov U. Sh., Husainov T.Je. i soavt. Novye podhody k lecheniju patospermiiju Urologija. 2013. № 2. S. 46–49 (in Russian)].
27. Дендеберов Е.С., Виноградов И.В. Опыт применения биокомплекса АндроДоз для фертилизации больных с идиопатической патоспермией // Эффективная фармакотерапия. № 2014. Т. 47 (Урология и нефрология № 4). С. 2–3 [Dendeberov E.S., Vinogradov I.V. Opyt primenenija biokompleksa AndroDoz dlja fertilizacii bol’nyh s idiopaticheskoj patospermiej. Jeffektivnaja farmakoterapija. 2014. Т. 47 (Urologija i nefrologija № 4). S. 2–3 (in Russian)].
28. Проскурин А.А., Голубкин Е.А., Поливин П.А., Казарян Э.Э. Сравнительная оценка эффективности комплексной терапии идиопатического бесплодия // Проблемы репродукции. 2013. № 6. С. 65– 66 [Proskurin A. A., Golubkin E. A., Polivin P. A., Kazarjan Je. Je. Sravnitel’naja ocenka jeffektivnosti kompleksnoj terapii idiopaticheskogo besplodija. Problemy reprodukcii. 2013. № 6. S. 65–66 (in Russian)].
29. Неймарк А.И., Клепикова И.И., Неймарк Б.А. и соавт. Применение препарата АндроДоз у мужчин с нарушением фертильности // Андрология и генитальная хирургия. 2013. № 4. С. 44–52 [Nejmark A.I., Klepikova I.I., Nejmark B.A. i soavt. Primenenie preparata AndroDoz u muzhchin s narusheniem fertil’nosti. Andrologija i genital’naja hirurgija. 2013. № 4. S. 44–52 (in Russian)].
30. Aitken J.R., De Iuliis G.N. Role of oxidative stress in the etiology of sperm DNA damage // Sperm chromatin: biological and clinical application in male infertility and assisted reproduction / A.Zini, A.Agarwal (Ed.). 2011. Springer. Р. 277–294.
31. Agarwal A., Durairajanayagam D., du Plessis D.S. Utility of antioxidants during assisted reproductive techniques: an evidence based review // Reproductive Biology and Endocrinology 2014. Vol. 12. P. 112.
32. Yao D.F., Mills J.N. Male infertility: lifestyle factors and holistic, complementary, and alternative therapies // Asian Journal of Andrology. 2016. Vol. 18. P. 410–418.
33. Scott R., MacPherson A., Yates R.W., Hussain B., Dixon J. The effect of oral selenium supplementation on human sperm motility // Br J Urol. 1998. Vol. 82. P. 76–80.
34. Keskes-Ammar L., Feki-Chakroun N., Rebai T., Sahnoun Z., Ghozzi H., Hammami S. et al. Sperm oxidative stress and the effect of an oral vitamin E and selenium supplement on semen quality in infertile men // Syst Biol Reprod Med. 2003. Vol. 49. P. 83–94.
35. Omu A., Al-Azemi M., Kehinde E., Anim J., Oriowo M., Mathew T. Indications of the mechanisms involved in improved sperm parameters by zinc therapy // Med Princ Pract. 2008. Vol. 17. P. 108–116.
36. Galatioto G.P., Gravina G.L., Angelozzi G. et al. May antioxidant therapy improve sperm parameters of men with persistent oligospermia after retrograde embolization for varicocele? // World Journal of Urology. 2008. Vol. 26. P. 97–102.
37. Lombardo F., Sansone A., Romanelli F. et al. The role of antioxidant therapy in the treatment of male infertility: an overview // Asian Journal of Andrology. 2011. Vol. 13. P. 690–697.
38. Menezo Y.J., Hazout A., Panteix G., Robert F., Rollet J., Cohen-Bacrie P., Chapuis F., Clement P., Benkhalifa M. Antioxidants to reduce sperm DNA fragmentation: an unexpected adverse effect .// Reprod Biomed Online 2007. Vol. 14. P. 418– 421.
39. Absalan F., Ghannadi A. Value of sperm chromatin dispersion test in couples with unexplained recurrent abortion. J Assist Reprod Genet. 2012. Vol. 29. P. 11–14.
40. Gharagozloo P., Aitken R.J. The role of sperm oxidative stress in male infertility and the significance of oral antioxidant therapy // Hum Reprod. 2011. Vol. 26(7). P. 1628–1640.
41. Lombardo F., Sansone A., Romanelli F., Paoli D., Gandini L., Lenzi A. The role of antioxidant therapy in the treatment of male infertility: an overview // Asian J Androl. 2011. Vol. 13. P. 690–737.
42. Giustarini D., Dalle-Donne I., Colombo R., Milzani A., Rossi R. Is ascorbate able to reduce disulfide bridges? // A cautionary note. Nitric Oxide 2008. Vol. 19. P. 252–258.
43. Menezo Y., Evenson D., Cohen M., Dale B. Effect of antioxidants on sperm genetic damage // Adv Exp Med Biol. 2014. Vol. 791. P. 173– 89. doi: 10.1007/978-1-4614-7783-9_11. Review. PubMed PMID: 23955679.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
материал с сайта https://www.rmj.ru/
