Содержание статьи
Введение
Острый риносинусит (ОРС) представляет собой инфекционное воспаление слизистой оболочки полости носа и околоносовых пазух длительностью менее 12 нед. Сопровождаясь, как правило, триадой симптомов (цефалгиями, болью в проекции околоносовых пазух и лихорадкой), риносинуситы значительно снижают качество жизни пациентов [1]. Согласно данным, полученным в США, частота развития ОРС составляет 1:3000 случаев, тогда как расходы на один случай составляют порядка 1100 долл. США [2]. В основе патогенеза ОРС лежит инфекционное воспаление слизистой оболочки носа, сопровождающееся отеком, транссудацией плазмы и гиперсекрецией желез. Нарушение механизмов мукоцилиарного клиренса приводит к увеличению длительности взаимодействия инфекционных агентов с клетками слизистой оболочки носа и последующему развитию синусита [3, 4]. Как следствие, выраженность нарушений механизмов цилиарного транспорта в значительной степени связана с тяжестью синоназальной патологии при риносинуситах [5, 6]. В связи с этим, наряду с эрадикацией инфекционного агента, важную роль в фармакотерапии воспалительных заболеваний полости носа играет мукоактивная терапия, направленная на восстановление мукоцилиарного транспорта, в комплексе с деконгестантами способствующая восстановлению дренажной функции полости носа и параназальных синусов [7, 8]. В течение последних лет возрастает интерес к применению в оториноларингологии, в том числе при ОРС, гиалуроновой кислоты, обладающей противовоспалительным, иммуномодулирующим, цитопротективным и мукоактивным действием [9]. Высказывается предположение о повышении клинической эффективности мукоактивной терапии и деконгестантов в сочетании с гиалуроновой кислотой [10], что является основанием для проведения углубленных исследований при лечении воспалительной патологии верхних дыхательных путей у взрослых и детей [11].
Цель исследования: изучение влияния гиалуроновой кислоты на клиническую эффективность сочетания туаминогептана и N-ацетилцистеина и функциональную активность цилиарного аппарата слизистой оболочки носа при ОРС.
Материал и методы
Исследование было выполнено в соответствии с этическими стандартами, установленными в Хельсинкской декларации (1964 г.) и ее последними действующими поправками. Протокол исследования был одобрен локальным этическим комитетом ФГБУ «СПб НИИ ЛОР» Минздрава России. Перед включением в настоящее исследование было получено письменное информированное согласие от пациентов и (или) их законных представителей. Исследование проведено с участием 60 взрослых (возраст 17–65 лет) пациентов и 60 детей (возраст 6–16 лет) с диагнозом «острый риносинусит средней степени тяжести», среди которых были выделены основная группа и группа сравнения, по 30 пациентов в каждой.
Пациенты основной группы получали стандартную терапию согласно действующим клиническим рекомендациям Минздрава России, а также применяли Препарат 1 (Риностейн®) в виде дозированного спрея для местного применения, содержащий в составе туаминогептан, N-ацетилцистеин и гиалуронат натрия. Пациенты группы сравнения на фоне стандартной терапии использовали интраназально Препарат 2 в виде спрея для местного применения, содержащего туаминогептан и N-ацетилцистеин.
Критерии невключения в исследование: наличие известной гиперчувствительности к туаминогептану и ацетилцистеину, другим компонентам, содержащимся в препаратах; тяжелые, декомпенсированные или нестабильные соматические заболевания; существенные отклонения от нормы в лабораторных показателях; острая психическая продуктивная симптоматика; наличие данных об инфицированности вирусом иммунодефицита человека (ВИЧ-инфекции); пациенты (взрослые), страдающие алкогольной, лекарственной и/или наркотической зависимостью; беременность или кормление грудью; любое сопутствующее заболевание, которое, по мнению исследователя, может препятствовать оценке реакции на лечение; пациенты, принимавшие участие в каком-либо клиническом исследовании в течение 1 мес. до скрининга или одновременное участие пациента в другом клиническом исследовании; невозможность/неспособность пациента (родителей ребенка) выполнять процедуры исследования.
В ходе исследования были предусмотрены следующие контрольные точки:
Визит 1 (первичное обращение): консультация и ЛОР-обследование, постановка диагноза, включение в исследование, заполнение индивидуальной регистрационной карты (ИРК) на пациента, взятие браш-биоптата слизистой оболочки полости носа с выполнением видеоцитоморфометрии, рандомизация, назначение и выдача пациенту препаратов.
Визит 2 (5–7-е сутки после начала лечения): клиническая оценка состояния больного, ЛОР-обследование, оценка эффективности лечения и переносимости препаратов, наличие побочных эффектов, заполнение ИРК на пациента, взятие браш-биоптата слизистой оболочки полости носа с выполнением видеоцитоморфометрии.
Визит 3 (10–14-е сутки после начала лечения): клиническая оценка состояния больного, ЛОР-обследование, оценка эффективности лечения и переносимости препаратов, заполнение ИРК на пациента, фиксирование наличия побочных эффектов.
Оценка жалоб пациентом проводилась по степени выраженности симптомов заболевания в сравнении с желаемым (асимптомным) состоянием по модифицированной 10-балльной визуальной аналоговой шкале (ВАШ) (0 баллов — очень хорошо, 10 баллов — очень плохо). С использованием шкалы проводилась оценка жалоб на слабость/недомогание, головную боль, нарушение носового дыхания, выделения из носа, нарушение обоняния, сухость в горле, кашель, нарушение качества жизни. На основании полученных данных рассчитывалась суммарная выраженность жалоб.
Оценка клинического состояния пациентов с ОРС проводилась ЛОР-специалистом по балльной системе, где отсутствию нарушений соответствовала оценка 0 баллов, тогда как максимальная выраженность отмечалась в 3 балла. При этом оценивали выраженность ринореи, затруднения носового дыхания, гнойный характер носового секрета, выраженность гиперемии слизистой оболочки, сужения носовых ходов, отека слизистой оболочки, гипертермии, а также интоксикации. На основании полученных данных анализировали суммарную выраженность симптомов синоназальной патологии.
Также проводилась оценка безопасности исследуемых препаратов, основанная на регистрации нежелательных явлений. При этом под нежелательным явлением понималось любое неблагоприятное медицинское явление, наблюдаемое у получившего препарат субъекта, которое может и не иметь причинно-следственной связи с данным видом лечения. Отсутствие терапевтического эффекта не считалось нежелательным явлением.
Исследование функции мукоцилиарного транспорта выполняли методом видеоцитоморфометрии нативных препаратов браш-биопсий слизистой оболочки полости носа с использованием прямого светового исследовательского микроскопа Nikon Eclipse E200 (Nikon, Япония), оснащенного высокоскоростной цифровой цветной видеокамерой Basler (Basler AG, Германия) с функцией Image ROI и частотой не менее 150 кадров в 1 с в пяти зонах интереса, отвечающих критериям отбора: площадь пласта с апикальными краями клеток при съемке в проекции к исследователю не менее 2500 мкм2 или длина ряда клеток в боковой проекции не менее 50 мкм. Для дальнейшего анализа проводили обработку видеофайлов и микрофотографий в программе MMCSoft (Россия). Морфометрический анализ включал оценку характера расположения клеток в образце, длительности двигательной активности цилиарного аппарата, выживаемости клеток (определение признаков цитолиза более чем в 15–30% клеток), с оценкой сохранения цилиарного аппарата на клетках, измерением длины цилий, высоты клеток, размеров клеток и ядер, частоты, амплитуды биения цилий. Также проводили цитологический анализ браш-биоптатов для выявления инфильтрации слизистой оболочки носа и околоносовых пазух нейтрофилами и эозинофилами [5].
Статистический анализ полученных данных выполняли с использованием программного пакета Statistica 10.0 (Statsoft, США). Характер распределения данных оценивали с использованием критерия Шапиро — Уилка. В связи с отсутствием Гауссового распределения в качестве описательных статистик использовали медиану и границы межквартильного интервала (Me (IQR)). Достоверность изменения параметров в динамике оценивалась посредством применения критерия знаков. В свою очередь, межгрупповое сравнение в соответствующие контрольные точки осуществлялось с использованием U-критерия Манна — Уитни. Различия считали статистически значимыми при p<0,05.
Результаты исследования
При оценке суммарной выраженности жалоб взрослых пациентов в динамике отмечено значительное снижение данного параметра на фоне применения обоих препаратов (все р<0,001). На момент обоих контрольных визитов суммарная оценка выраженности жалоб у взрослых пациентов основной группы была ниже таковой в группе сравнения. Так, суммарная выраженность жалоб пациентов на визитах 1, 2 и 3 в основной группе составила 54 (47–60), 19 (16–21) и 2 (1–3) балла соответственно, в группе сравнения — 49,5 (47–58), 26,5 (25–30) и 9,5 (9–11) балла соответственно. Несмотря на выраженное снижение суммарной выраженности жалоб в обеих группах, при сравнении соответствующих показателей у пациентов, применявших различные препараты, выявлены межгрупповые различия.
Так, на фоне отсутствия статистически значимых различий в исходных показателях суммарной выраженности жалоб (p=0,242) значения данного показателя на визитах 2 и 3 в основной группе пациентов были ниже таковых в группе сравнения на 28% (p<0,001) и 79% (p<0,001) соответственно. Влияние препаратов на динамику выраженности отдельных жалоб у взрослых пациентов представлено в таблице 1.
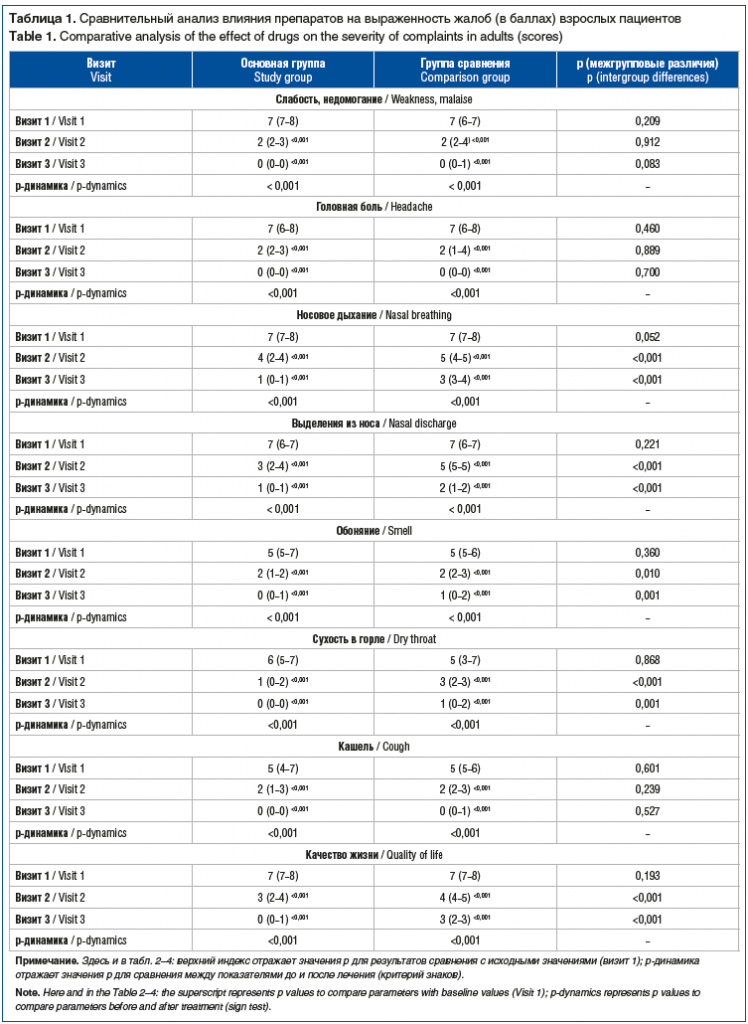
Аналогичный характер изменений на фоне применения препаратов был выявлен у пациентов детского возраста. Так, суммарная выраженность жалоб до лечения, к визитам 2 и 3 у пациентов, получавших Препарат 1 (Риностейн®), составила 52,5 (49–57), 14,5 (11–19) и 1 (0–4) балл, в группе, получавшей Препарат 2, — 47,5 (39–54), 32,5 (27–36) и 13 (10–15) баллов соответственно. При этом снижение суммарной выраженности жалоб в обеих группах было статистически значимым (p<0,001). Несмотря на то, что в основной группе пациентов изначальная выраженность жалоб была выше таковой в группе сравнения на 11% (р=0,030), на визитах 2 и 3 значения данного показателя были ниже такового в 2,2 и 13 раз соответственно. Влияние препаратов на динамику выраженности отдельных жалоб у пациентов детского возраста представлено в таблице 2.
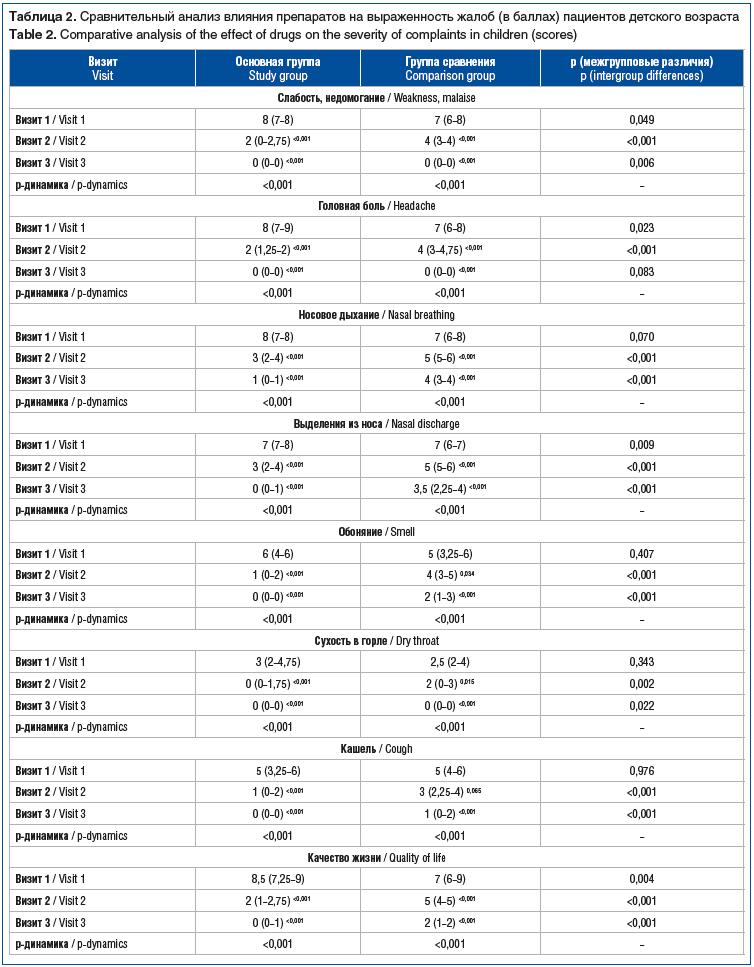
Наряду с оценкой влияния проводимого лечения на выраженность жалоб у пациентов также изучен характер изменения суммарной выраженности симптомов синоназальной патологии. Установлено, что у взрослых пациентов основной группы значения данного параметра до начала лечения составляли 19 (18–20) баллов, при этом характеризуясь достоверным (p<0,001) снижением к моменту повторного и контрольного визитов в 2,7 раза (7 (5–9) баллов) и 9,5 раза (2 (1–3) балла) соответственно. В группе сравнения суммарная выраженность симптомов синоназальной патологии при обращении составляла 17 (16–18) баллов, при этом достоверно (p<0,001) снижаясь к визитам 2 и 3 на 35% (11 (9–12) баллов) и 65% (6 (5–7) баллов) соответственно. Несмотря на изначально большую суммарную выраженность симптомов синоназальной патологии, у взрослых пациентов основной группы значения данного показателя на визитах 2 и 3 были на 36% и в 3 раза ниже соответствующих в группе сравнения (все p<0,001). Влияние препаратов на динамику выраженности объективных симптомов у взрослых пациентов представлено в таблице 3.
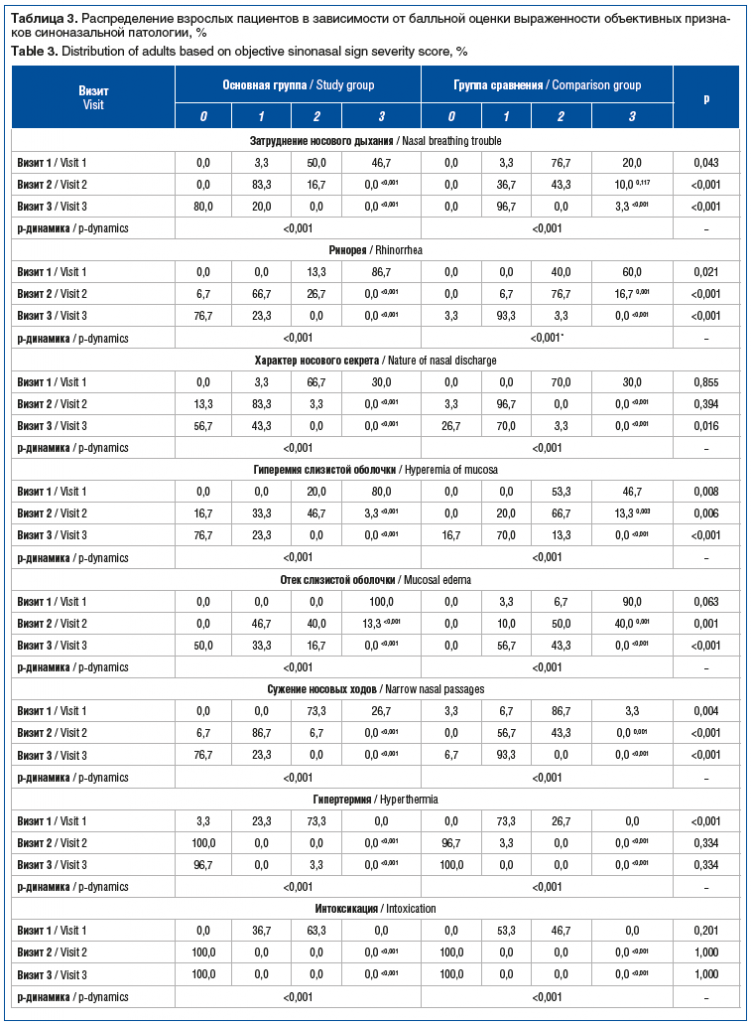
При обследовании пациентов детского возраста выявлены сходные закономерности. В частности, применение Препарата 1 (Риностейн®) приводило более чем к трехкратному снижению суммарной выраженности симптомов к визиту 2 (5 (3–8) баллов) по сравнению с исходными показателями (17 (16–19) баллов). В свою очередь, к окончанию периода наблюдения симптомы синоназальной патологии в данной группе пациентов практически отсутствовали (0 (0–2) баллов). Применение Препарата 2 приводило к статистически значимому (p<0,001) снижению суммарной выраженности симптомов у детей на 25 и 53% относительно исходных значений (16 (14–18) баллов) к моменту визита 2 (12 (10–13) баллов) и визита 3 (7,5 (6–9) балла) соответственно. При этом значения суммарной выраженности симптомов в основной группе детей были достоверно ниже таковых в группе сравнения во всех контрольных точках (p<0,001). Влияние препаратов на динамику выраженности отдельных признаков синоназальной патологии представлено в таблице 4.
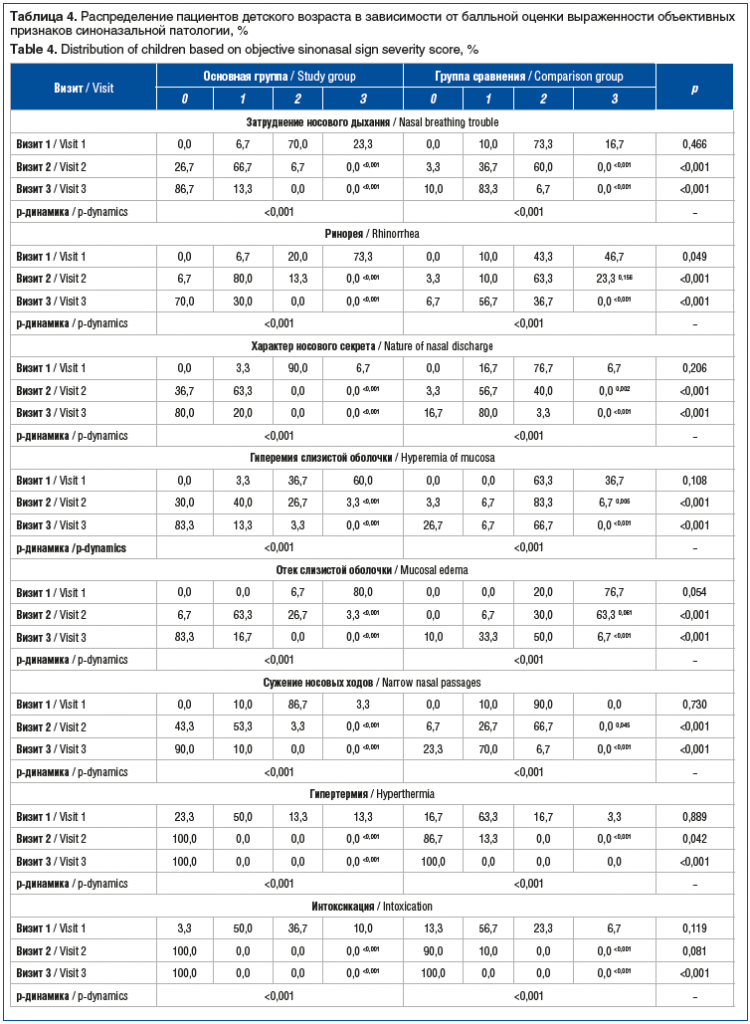
Наряду с влиянием на выраженность жалоб и симптомов синоназальной патологии применение исследуемых препаратов оказывало значительное влияние на функциональную активность цилиарного аппарата эпителия слизистой оболочки носа у взрослых пациентов. На момент первого обращения различий изучаемых показателей между группами выявлено не было (рис. 1).
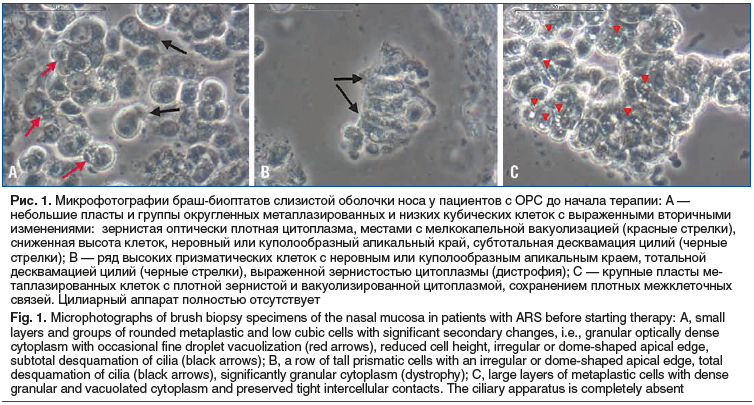
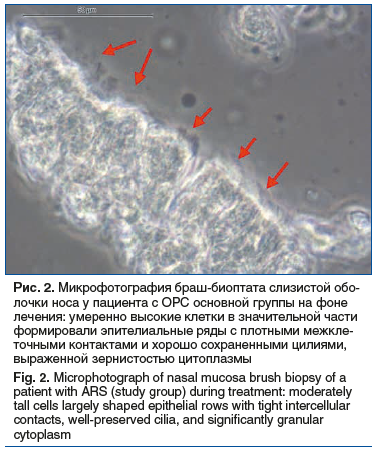
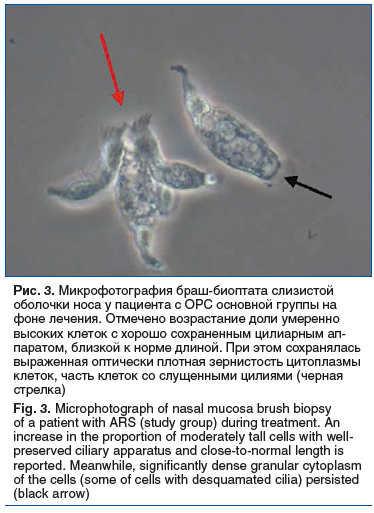
На фоне применения Препарата 1 (Риностейн®) отмечалось достоверное увеличение относительного количества клеток с подвижными цилиями, частоты биения цилий, а также выживаемости клеток эпителия более чем в 32, 3 и 3 раза по сравнению с исходными показателями соответственно (рис. 2). Использование Препарата 2 приводило к статистически значимому снижению значений данных показателей. Применение обоих препаратов приводило к статистически значимому увеличению длины цилий (рис. 3). В то же время к моменту визита 2 доля клеток с подвижными цилиями, частота биения цилий, длина цилий, а также выживаемость эпителия у пациентов основной группы достоверно превышала таковую у лиц из группы сравнения.
Сходный характер изменений был зарегистрирован у пациентов детского возраста. Установлено, что применение Препарата 1 (Риностейн®) приводило к статистически значимому повышению относительного количества клеток с подвижными цилиями в 25 раз, выживаемости клеток более чем в 2 раза, а также длины цилий на 21% по сравнению с исходными показателями. В отличие от взрослых пациентов, применение Препарата 2 не приводило к статистически значимому изменению показателей функциональной активности цилиарного аппарата, хотя и отмечалась некоторая тенденция к снижению. Как следствие, у детей основной группы отмечались достоверно более высокие значения доли клеток с подвижными цилиями, частоты биения и длины цилий, а также выживаемости эпителиальных клеток по сравнению с группой сравнения (табл. 5).
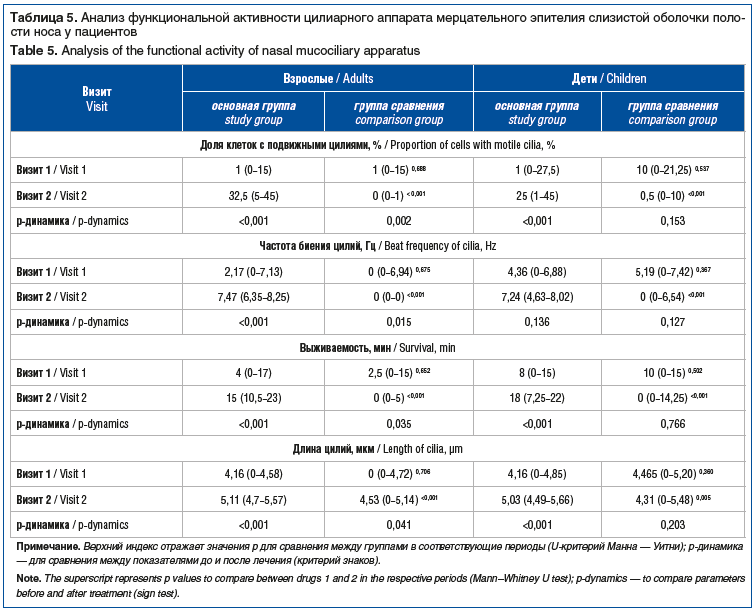
Наряду с изменением функциональной активности цилиарного аппарата применение исследуемых препаратов также приводило к изменениям морфологических характеристик слизистой оболочки носа. В частности, у взрослых пациентов применение Препарата 1 сопровождалось достоверным (р=0,006) увеличением высоты клеток эпителия (высокие клетки — 21,7%, кубические — 43,4%, округлые — 35%) по сравнению с исходными показателями (высокие клетки — 10%, кубические — 23,3%, округлые — 66,7%) (рис. 4).
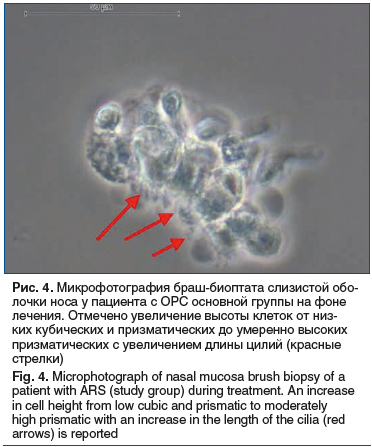
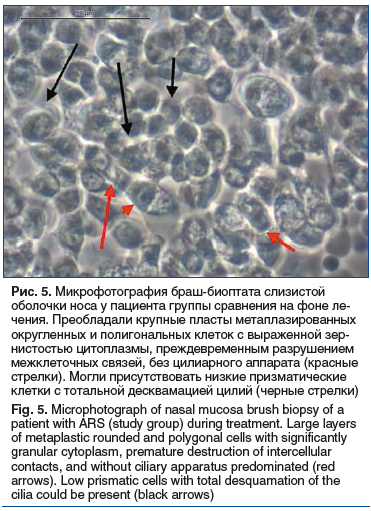
В свою очередь, в группе сравнения существенных изменений показателей высоты клеток при сравнении значений до (высокие клетки — 5%, кубические — 30%, округлые — 65%) и после (высокие клетки — 3,3%, кубические — 25%, округлые — 71,7%) не отмечалось (р=0,540). У пациентов детского возраста применение Препарата 1 (Риностейн®) также приводило к достоверному увеличению высоты клеток (высокие клетки — 5,6%, кубические — 66,7%, округлые — 27,8%) по сравнению с соответствующими показателями при первичном обращении (высокие клетки — 8,3%, кубические — 43,3%, округлые — 48,3%; р=0,046). В группе сравнения, напротив, высота клеток после завершения курса лечения (высокие клетки — 8,5%, кубические — 25,4%, округлые — 66,1%) была достоверно ниже исходных значений (высокие клетки — 15,3%, кубические — 35,6%, округлые — 49,2%; р=0,038) (рис. 5). Как следствие, к визиту 2 высота клеток как у взрослых, так и у детей основных групп достоверно превышала таковую в соответствующих группах сравнения (p<0,001). Значимых изменений и межгрупповых различий в относительном количестве клеток с цилиями, дистрофии эпителия и расположении клеток как у детей, так и у взрослых выявлено не было. При этом оба исследуемых препарата в равной степени снижали количество нейтрофилов в образцах браш-биоптатов слизистой оболочки носа.
Нежелательные явления у пациентов как детского, так и взрослого возраста при применении исследуемых препаратов не зафиксированы.
Обсуждение
Результаты проведенного исследования продемонстрировали, что оба исследуемых препарата в сочетании с системной антибиотикотерапией приводили к статистически значимому снижению выраженности жалоб и симптомов синоназальной патологии у пациентов с ОРС как взрослого, так и детского возраста. Данные наблюдения согласуются с ранее продемонстрированной ролью системной антибиотикотерапии, а также деконгестантов и мукоактивной терапии при ОРС. В частности, в соответствии с ведущей ролью бактериальной инфекции в патогенезе ОРС системное применение антибиотиков сопровождается снижением выраженности симптомов как у детей [12], так и у взрослых [13, 14]. Также показано, что применение спрея, содержащего туаминогептана сульфат и ацетилцистеин, сопровождается снижением выраженности симптомов у детей с острым неосложненным ринитом [15]. Положительное влияние ацетилцистеина при этом может быть обусловлено его антиоксидантным действием, снижением продукции провоспалительных цитокинов, а также уменьшением выраженности гипертрофических изменений подслизистых желез [16]. Помимо этого, являясь мукоактивным соединением, ацетилцистеин способен снижать вязкость назального секрета [17]. В свою очередь, эффективность туаминогептана, являющегося деконгестантом, при ОРС обусловлена его сосудосуживающим эффектом, сопровождающимся уменьшением отека слизистой оболочки носа и гиперпродукции слизи [18].
В то же время применение препарата с гиалуронатом натрия (Риностейн®) характеризовалось более выраженным клиническим эффектом. Данные наблюдения согласуются с результатами A. Ciofalo et al. [19], продемонстрировавшими достоверное снижение нарушений обоняния, заложенности носа, а также отделяемого из носа у пациентов с ОРС после 2 нед. орошения слизистой оболочки носа раствором, содержащим гиалуронат натрия, однако через 1 мес. различия по сравнению с контрольной группой сохранялись лишь в случае отделяемого из носа. Аналогично применение гиалуроновой кислоты достоверно снижало выраженность жалоб и симптомов синоназальной патологии у беременных женщин с риносинуситом, повышая при этом качество жизни обследуемых [20].
Результаты проведенного исследования позволяют предположить, что более выраженный клинический эффект гиалуронатсодержащего препарата Риностейн® обусловлен его влиянием на функциональную активность цилиарного аппарата слизистой оболочки носа. Это предположение подтверждается данными, свидетельствующими о сокращении времени сахаринового теста на фоне орошения полости носа раствором, содержащим гиалуроновую кислоту [21]. Аналогичные результаты были получены при обследовании пациентов с аллергическим ринитом [22]. Также показано, что орошение слизистой оболочки носа гиалуронатсодержащим раствором у пациентов после проведения функциональной эндоскопической риносинусохирургической операции способствует повышению подвижности цилий [23]. Положительное влияние гиалуроната натрия может быть обусловлено стимуляцией формирования цилий назальными эпителиальными клетками вследствие активации регулятора цилиогенеза, FOXJ1 (Forkhead box protein J1) [24]. Несмотря на противовоспалительный эффект гиалуроновой кислоты [25], отсутствие значимых различий в выраженности нейтрофильной инфильтрации браш-биоптатов слизистой оболочки носа на фоне лечения различными препаратами свидетельствует о том, что различия в клиническом эффекте не опосредованы влиянием гиалуроната натрия на выраженность воспалительной инфильтрации. Таким образом, результаты проведенного исследования согласуются с ранее высказанным предположением о более высокой эффективности туаминогептана и ацетилцистеина в сочетании с гиалуронатом натрия в лечении воспалительных заболеваний полости носа за счет активации мукоцилиарного транспорта [10]. В то же время следует отметить, что в наше исследование была включена ограниченная выборка взрослых и детей. Для более тщательного изучения вопроса и повышения уровня достоверности полученных результатов требуется проведение многоцентрового исследования.
Заключение
Результаты исследования показали, что оба препарата достоверно снижают выраженность системных нарушений и локальных синоназальных симптомов ОРС, однако в отношении последних бóльшую клиническую эффективность показал препарат, содержащий туминогептан, ацетилцистеин и гиалуронат натрия. Оба препарата продемонстрировали выраженную противовоспалительную активность по результатам видеоцитоморфометрии как у взрослых, так и у пациентов детского возраста, однако применение гиалуронатсодержащего препарата оказывало более значимое положительное воздействие на морфологию и выживаемость клеток эпителия слизистой оболочки полости носа, а также на активность цилиарного аппарата мерцательного эпителия, что может объясняться действием гиалуроната натрия. Оба препарата показали высокую степень безопасности в обеих возрастных группах (100% отсутствие нежелательных явлений).
Таким образом, комбинированный назальный спрей, содержащий туминогептан, ацетилцистеин и гиалуронат натрия, может рассматриваться в качестве эффективного и безопасного топического средства комплексной терапии ОРС у детей и взрослых.
Сведения об авторах:
Рязанцев Сергей Валентинович — д.м.н., профессор, заместитель директора по научно-координационной работе ФГБУ «СПб НИИ ЛОР» Минздрава России; 190013, Россия, г. Санкт-Петербург, ул. Бронницкая, д. 9; ORCID iD 0000-0001-1710-3092.
Кривопалов Александр Александрович — д.м.н., руководитель научно-исследовательского отдела патологии верхних дыхательных путей ФГБУ «СПб НИИ ЛОР» Минздрава России; 190013, Россия, г. Санкт-Петербург, ул. Бронницкая, д. 9; доцент кафедры оториноларингологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0002-6047-4924.
Дворянчиков Владимир Владимирович — д.м.н., профессор, заслуженный врач России, директор ФГБУ «СПб НИИ ЛОР» Минздрава России; 190013, Россия, г. Санкт-Петербург, ул. Бронницкая, д. 9; ORCID iD ORCID iD 0000-0002-0925-7596.
Алексеенко Светлана — д.м.н., доцент, ведущий научный сотрудник научно-исследовательского отдела патологии верхних дыхательных путей ФГБУ «СПб НИИ ЛОР» Минздрава России; 198013, Россия, г. Санкт-Петербург, ул. Бронницкая, д. 9; доцент кафедры оториноларингологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; заведующая оториноларингологическим отделением СПб ГБУЗ «ДГКЦ ВМТ им. К.А. Раухфуса»; 193036, Россия, г. Санкт-Петербург, Лиговский пр-т, д. 8; ORCID iD 0000-0002-3377-8711.
Кузовков Владислав Евгеньевич — д.м.н., заместитель директора по инновациям ФГБУ «СПб НИИ ЛОР» Минздрава России; 190013, Россия, г. Санкт-Петербург, ул. Бронницкая, д. 9; ORCID iD 0000-0002-2581-4006.
Барашкова Светлана Валерьевна — младший научный сотрудник лабораторно-диагностического научно-исследовательского отдела уха ФГБУ «СПб НИИ ЛОР» Минздрава России; 190013, Россия, г. Санкт-Петербург, ул. Бронницкая, д. 9; врач-патологоанатом патологоанатомического отделения СПб ГБУЗ «ДГМКЦ ВМТ им. К.А. Раухфуса»; 193036, Россия, г. Санкт-Петербург, Лиговский пр-т, д. 8; ORCID iD 0000-0002-5618-4510.
Тихомирова Екатерина Константиновна — к.м.н., врач-оториноларинголог оториноларингологического отделения СПб ГБУЗ «ДГМКЦ ВМТ им. К.А. Раухфуса»; 193036, Россия, г. Санкт-Петербург, Лиговский пр-т, д. 8; ORCID iD 0000-0001-6952-6543.
Контактная информация: Алексеенко Светлана, e-mail: svolga-lor@mail.ru.
Источник финансирования: публикация осуществлена при поддержке компании Solopharm в соответствии с внутренней политикой и действующим законодательством РФ.
Конфликт интересов отсутствует.
Статья поступила 20.07.2023.
Поступила после рецензирования 14.08.2023.
Принята в печать 29.08.2023.
Информация с rmj.ru
