Урология
Цель работы: оценить непосредственные и отдаленные результаты хирургического лечения больных РПЖ.
Материал и методы: в отделении онкоурологии МНИОИ им. П.А. Герцена проведен ретроспективный анализ базы данных 1846 больных РПЖ, которым выполнена РПЭ с 1998 по 2016 г. Подробно проанализированы предоперационные характеристики пациентов, данные патоморфологического исследования, интра- и послеоперационные осложнения, а также отдаленные функциональные и онкологические результаты хирургического лечения. Выявлена тенденция увеличения числа больных РПЖ с высоким риском прогрессирования заболевания и наличием неблагоприятных факторов прогноза, когда необходимо хирургическое лечение.
Заключение: накопление хирургического опыта позволяет существенно оптимизировать результаты лечения больных РПЖ, снизить частоту осложнений. Преимуществами хирургического лечения является возможность точного стадирования и выявления неблагоприятных патоморфологических факторов, что позволяет выработать рациональную тактику лечения. У больных с неблагоприятными послеоперационными факторами прогноза (лимфогенные метастазы, в т. ч. с экстракапсулярной инвазией) рекомендовано рассмотрение вопроса о проведении адъювантной терапии с целью улучшения показателей выживаемости.
Ключевые слова: рак предстательной железы, радикальная простатэктомия, дистанционная лучевая терапия, брахитерапия.
Для цитирования: Алексеев Б.Я., Нюшко К.М., Крашенинников А.А., Воробьев Н.В., Сафронова Е.Ю., Калпинский А.С., Сергиенко С.А., Тараки И.А., Темиргереев М.З., Каприн А.Д. Хирургическое лечение больных локализованным и местнораспространенным раком предстательной железы: результаты одноцентрового исследования // РМЖ. 2017. №27. С. 2019-2025
B.Ya. Alekseev, K.M. Nyushko, A.A. Krasheninnikov, N.V. Vorobiev, E.Yu. Safronova, A.S. Kalpinskiy, S.A. Sergienko, I.A. Taraki, M.Z. Temirgereev, A.D. Kaprin
National Medical Research Radiological Center, Moscow
At present prostate cancer (PC) is an extremely urgent oncological problem in Russia because of a steady increase in the incidence and mortality of men due to this pathology. The introduction of new methods of laboratory and radiation diagnostics allows not only to diagnose PC, but also to more accurately assess the clinical stage of the disease. A multidisciplinary individual approach to each patient provides more treatment opportunities. Many new methods of PC treatment are being developed and studied. Radical prostatectomy (RPE) and radiotherapy (remote radiation therapy, brachytherapy) are currently the «gold standard» for radical treatment of patients with PC, nevertheless surgical treatment remains the main method of therapy for patients with localized and locally advanced prostate cancer, demonstrating satisfactory oncological and functional results.
Aim: to evaluate immediate and long-term results of surgical treatment of patients with PC.
Patients and methods: professionals of the oncourology department of the Moscow Scientific Oncological Institute named after P.A. Herzen made a retrospective analysis of 1 846 patients with prostate cancer who underwent RPE from 1998 to 2016. A detailed analysis of preoperative characteristics of patients, data of pathomorphological study, intra- and postoperative complications, as well as distant functional and oncological results of surgical treatment is given. It has been revealed, that there is a tendency to an increase in the number of PC patients with a high risk of disease progression and the presence of unfavorable prognosis factors, requiring surgical treatment.
Conclusion: the accumulation of surgical experience allows to significantly optimize the results of treating the patients with PC, and to reduce the frequency of complications. The advantage of surgical treatment is the possibility of precise staging and detection of unfavorable pathomorphological factors, which allows to develop rational treatment tactics. In patients with adverse postoperative prognostic factors (lymphogenic metastases, including extracapsular invasion), an adjuvant therapy is recommended to improve survival rates.
Key words: prostate cancer, radical prostatectomy, remote radiation therapy, brachytherapy.
For citation: Alekseev B.Ya., Nyushko K.M., Krasheninnikov A.A. et al. Surgical treatment of patients with localized and locally advanced prostate cancer: the results of a single center study // RMJ. 2017. № 27. P. 2019–2025.
Представлены результаты исследования хирургического лечения больных локализованным и местнораспространенным раком предстательной железы. Преимуществами хирургического лечения является возможность точного стадирования и выявления неблагоприятных патоморфологических факторов, что позволяет выработать рациональную тактику лечения. У больных с неблагоприятными послеоперационными факторами прогноза рекомендовано рассмотрение вопроса о проведении адъювантной терапии с целью улучшения показателей выживаемости.
Содержание статьи
Эпидемиология, факторы риска
Рак предстательной железы (РПЖ) является одной из наиболее актуальных проблем современной онкоурологии по причине сохраняющихся высоких показателей заболеваемости и смертности от данной патологии. В 2012 г. в мире зарегистрировано 1 млн 100 тыс. новых случаев РПЖ и 307 тыс. летальных исходов. РПЖ занимает 2-е место в структуре онкологической заболеваемости среди мужчин в России после злокачественных новообразований легких, трахеи и бронхов. В 2015 г. в РФ зарегистрировано 38 812 новых случаев РПЖ. Средний возраст больных с впервые выявленным РПЖ в 2015 г. в России снизился по сравнению с 2005 г.: 69,6 и 70,6 года соответственно. По темпу ежегодного прироста заболеваемости РПЖ занимает 1-е место среди других онкологических заболеваний у мужчин, что соответствует 7,76%. Прирост показателя заболеваемости в России за 10 лет (2005–2015 гг.) составил 135,5% [1]. В настоящее время наблюдается увеличение общей 5-летней выживаемости. Так, для больных РПЖ в 1999–2001 гг. она составила 73,4%, а в 2005–2007 гг. 83,4% [2]. Несмотря на улучшение методов диагностики данной патологии и внедрение в ряде клиник обязательного определения уровня простатического специфического антигена (ПСА) у мужчин пожилого возраста, частота выявления запущенных форм РПЖ в Российской Федерации остается высокой, хотя и наблюдается тенденция к увеличению диагностики локализованных форм РПЖ. Так, по данным 2015 г., локализованный РПЖ выявлен у 55,1% больных, местнораспространенный РПЖ ‒ у 27,4% пациентов. Отдаленные метастазы и метастазы в лимфатических узлах выявлены в 15,9% случаев [1].
Тактика лечения
Наиболее важными факторами при выборе метода лечения являются: распространенность опухолевого процесса (TNM), морфологическая структура (дифференцировка по шкале Глисона, ISUP грейд), уровень ПСА, возможные осложнения при каждом методе лечения, общее состояние больного, сопутствующая патология, ожидаемая продолжительность жизни больного, качество жизни и индивидуальное желание пациента.
На сегодняшний день химиотерапия и гормональная терапия (ГТ) не могут считаться радикальными методами лечения, т. к. при применении данных методов не достигается элиминация всех опухолевых клеток из организма даже в случае локализованного процесса.
Радикальная простатэктомия (РПЭ) и лучевая терапия (дистанционная лучевая терапия — ДЛТ, брахитерапия) в настоящее время являются «золотым стандартом» радикального лечения больных РПЖ. В то же время пациентам низкой группы риска РПЖ может быть рекомендовано активное наблюдение (ежегодный контроль ПСА, повторные биопсии) с целью отсрочить проведение радикального лечения, а также различные варианты фокальной терапии [3].
Хирургическое лечение
РПЭ является одним из основных методом лечения РПЖ в течение последних 150 лет [4]. Основными преимуществами РПЭ является полное удаление предстательной железы в сочетании с минимальным риском развития осложнений при ее правильном техническом выполнении. Рандомизированные многоцентровые клинические исследования подтверждают, что РПЭ ассоциирована с увеличением показателей общей выживаемости (для промежуточной и высокой групп риска) и увеличивает время до развития отдаленных осложнений по сравнению с наблюдением, а у ряда больных позволяет достигнуть полного излечения. Проведено множество работ, сравнивающих онкологические и функциональные результаты хирургического лечения больных РПЖ в зависимости от доступа (промежностный, позадилонный, лапароскопический или робот-ассистированный) [5-18]. Сравнение функциональных и онкологических результатов операций в зависимости от вида доступа зачастую затруднено из-за разнородной выборки пациентов, ретроспективного характера исследований с разными критериями включения, различным объемом сопутствующей патологии. В ряде исследований получены противоречивые результаты, однако авторы сходятся во мнении, что качество и эффективность хирургического лечения в первую очередь зависят не от типа операции или доступа, а от опыта хирурга, выполняющего оперативное вмешательство. Доказано, что снижение интра- и послеоперационных осложнений напрямую коррелирует с опытом хирурга [17-20]. Пациенту следует рекомендовать выбирать не из различных техник выполнения РПЭ, а выбрать эксперта, обладающего наибольшим опытом выполнения операций.
Лечение РПЖ высокого риска прогрессирования
Исторически стандартным подходом к лечению больных РПЖ группы высокого риска, особенно при выявлении местнораспространенных опухолей, явлалось гормоно-лучевая терапия. Хирургическое лечение данной категории пациентов до недавнего времени применялось редко, и сейчас оно остается спорным методом лечения больных РПЖ группы очень высокого риска прогрессирования.
Meng et al. в 2005 г. на основе данных регистра
CaPSURE подтвердили, что пациенты группы высокого риска значительно реже подвергались хирургическому лечению, чем ДЛТ или ГТ [21]. Исследование Cooperberg и Carroll показало изменение подходов к лечению у больных РПЖ высокого риска [22]. За последние 5–8 лет количество РПЭ значительно выросло, тогда как от ГТ в монорежиме отказываются все больше специалистов, снизилась также частота применения ДЛТ. Тенденции лечения больных РПЖ высокого риска в последние годы меняются. Эти изменения вызваны большим числом исследований роли РПЭ и расширенной ТЛАЭ у больных РПЖ с высоким риском прогрессирования [23].
Akre et al. в 2011 г. опубликовали результаты когортного исследования, проведенного в Швеции. В анализ включено 12 184 больных местнораспространенным РПЖ (клиническая стадия T3–T4) или локализованным РПЖ сT2 с уровнем ПСА в 50–99 нг/мл, без данных за наличие отдаленных метастазов. Всем больным проводилась либо ГТ в различных вариантах, либо динамическое наблюдение и симптоматическая терапия. Опухолеспецифическая смертность к 8 годам наблюдения составила: 28% при наличии высокодифференцированного РПЖ (2–6 баллов по Глисону), 52% при дифференцировке опухоли 8 баллов по Глисону и 64% при дифференцировке 9–10 баллов. При анализе причин смерти у пожилых больных РПЖ установлено, что даже у мужчин старше 85 лет с наличием низкодифференцированного РПЖ (индекс Глисона 8–10) последний являлся причиной смерти в 42% случаев. Учитывая уровень заболеваемости и летальности при РПЖ высокого риска, возраст не должен рассматриваться как абсолютное противопоказание для радикального лечения [24].
Согласно данным, полученным Ward в 2005 г. [25], у 842 пациентов с клинической стадией cT3 (медиана времени наблюдения 10,3 мес.) опухолеспецифическая выживаемость (ОСВ) после РПЭ составила 90% и 79% при 10 и 15 годах наблюдения соответственно. Более 78% пациентов получали адъювантную ГТ или сальважную лучевую терапию. В 27% случаев выявлено гиперстадирование: при патоморфологическом исследовании диагностирован локализованный РПЖ (pT2NoMo). Показатели смертности при местнораспространенном и локализованном РПЖ сопоставимы, что подтверждает целесообразность хирургического лечения данной группы больных.
В 2008 г. Yossepowitch et al. опубликовали данные клиники Memorial Sloan Kettering Cancer Center (MSKCC), которые продемонстрировали удовлетворительные результаты ОСВ больных РПЖ высокого риска [26].
В 2009 г. Stephenson опубликовал данные по хирургическому лечению более 12 000 тыс. мужчин в 4-х академических центрах (Baylor, ClevelandClinic, MSKCC, U. Of Michigan) за 1987–2005 гг. Более 1900 больных РПЖ относились к группе высокого риска. Опухолеспецифическая смертность составила 8% (95% ДИ 7–10) и 19% (95% ДИ 14–24) для 10 и 15 лет наблюдения соответственно [27].
Mitchell et al. в 2012 г. опубликовали результаты 20-летнего наблюдения за больными РПЖ после лечения. В послеоперационном периоде 42% больных не получали ни один из видов ГТ, показатель ОСВ составил 81% [28].
Briganti в 2015 г. привел результаты хирургического лечения больных РПЖ высокого риска. Ретроспективно проанализрованы данные 2065 пациентов, которым выполняли РПЭ в 7 центрах с 1991 по 2011 г., все пациенты, получившие лучевую терапию или ГТ, исключены из анализа. При медиане наблюдения 70 мес. пятилетняя выживаемость без биохимического рецидива составила 55,2%. В зависимости от наличия неблагоприятных факторов риск развития биохимического рецидива снижался или оставался стабильным. Так, в случае верификации низкодифференцированной опухоли (индекс Глисона 8–10) риск биохимического рецидива постепенно снижался, а при выявлении местнораспространенных опухолей ≥pT3a риск рецидива оставался стабильным на протяжнии всего времени наблюдения. Показатель 10-летней опухолеспецифической смертности составил 14,8%. У больных с ранним биохимическим рецидивом после хирургического лечения (
Собственные результаты исследования
Материал и методы. В отделении онкоурологии МНИОИ им. П.А. Герцена проведен ретроспективный анализ базы данных, включающей 1846 больных РПЖ, которым выполнили РПЭ в 1998–2016 гг. Средний возраст пациентов составил 63,03±6,4 года (41–84 лет), средний уровень ПСА 15,6±15,4 (0,14–242) нг/мл, средний процент положительных биоптатов 47,7±29,9 (5,6–100%). У большинства больных отмечены клинически локализованные опухоли: локализованный РПЖ (сТ1–Т2с) выявлен у 1458 (79 %) больных (сТ1-Т2b – 703 (38,1%), сТ2с – 755 (40,9%)), местнораспространенные формы заболевания сТ3а диагностированы у 271 (14,7%), сТ3b – у 117 (6,3%) больных. Высокодифференцированные опухоли с индексом Глисона 6 верифицированы у 1013 (54,9%) больных, умеренно дифференцированные опухоли с индексом Глисона 7 баллов (4+3) – у 203 (11,1%), 7 (3+4) – у 356 (19,3%) больных, низкодифференцированные опухоли с индексом Глисона 8–10 выявлены у 163 (8,8%) пациентов. Дифференцировка опухоли не установлена у 111 больных по причине недостаточного количества гистологического материала (табл. 1). 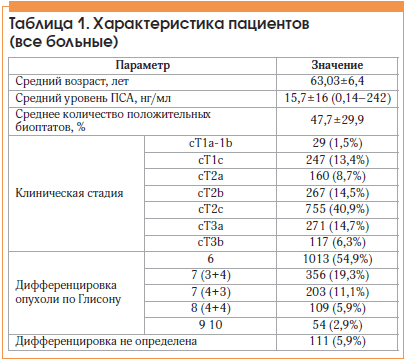
РПЖ низкого риска (стадия ≤сТ2а, ПСА 20 нг/мл, или дифференцировка опухоли по Глисону 8–10 баллов) отмечен у 1206 (65,3%) пациентов. В группе высокого риска локализованный РПЖ выявлен у 819 (67,9%) больных, местнораспространенные опухоли диагностированы у 387 (32,1%) пациентов. РПЖ крайне высокого риска прогрессирования (клиническая стадия сT3b) верифицирован у 117 (9,7%) больных. При пальцевом ректальном исследовании (ПРИ) узловые образования в предстательной железе выявлены у 719 больных группы высокого риска (59,6%), при трансректальном УЗИ (ТРУЗИ) опухолевые очаги визуализировались в 1152 (95,4%) случаях. В группе РПЖ умеренного риска показатели при ПРИ и ТРУЗИ составили 137 (34,4%) и 225 (56,5%) случаев соответственно. В группе низкого риска: при ПРИ опухоль пальпировалась у 40 (16,5%) больных, при ТРУЗИ опухолевые очаги выявлены у 77 (31,8%). Распределение больных РПЖ по группам риска показано на рисунке 1.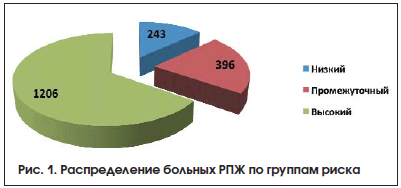
Позадилонная РПЭ выполнена 1755 больным, в т. ч. 114 пациентам с применением нервосберегающей методики; РПЭ промежностным доступом (РППЭ) выполнена 80 больным и лапароскопическая РПЭ – 11 больным.
Характеристика больных, которым выполнили позадилонную нервосберегающую РПЭ, представлена в таблице 2.
В числе больных, которым выполнили позадилонную РПЭ, 1665 больным дополнительно выполнили ТЛАЭ: 718 (43,1%) – стандартную ТЛАЭ (СТЛАЭ) (эти операции выполнены до 2008 г.), 947 (56,9%) – радикальную ТЛАЭ (РТЛАЭ). Характеристика пациентов представлена в таблице 3.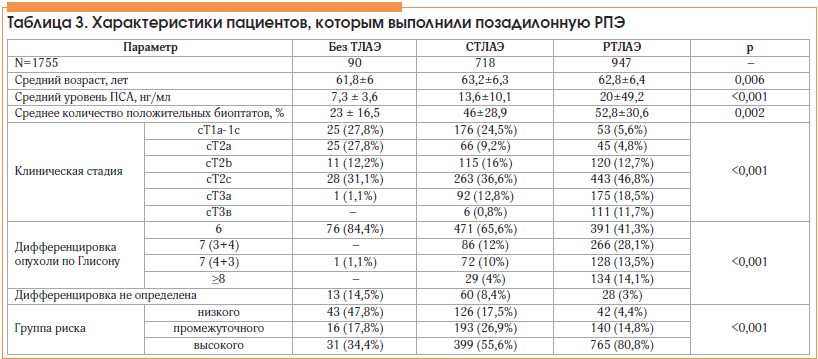
Следует отметить, что РПЭ без ТЛАЭ и с СТЛАЭ у пациентов в группах промежуточного и высокого риска выполняли только до 2008 г., т. е. до внедрения в практику методики расширенной ТЛАЭ.
РППЭ выполнена 80 больным, характеристика больных данной группы представлена в таблице 4. В этой группе РПЖ низкого риска выявлен у 29 (36,25%) больных, умеренного риска – у 66 (82,5%), высокого риска – у 15 (18,75%).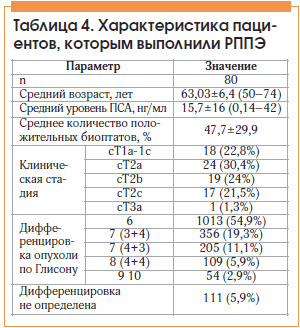
Лапароскопическая РПЭ выполнена 71 пациенту, в данную группу также вошли пациенты, у которых применяли нервосберегающую технику. Характеристика больных представлена в таблице 5. На рисунках 2-4 представлены общая характеристика больных (рис. 2), распределение больных в зависимости от клинической стадии (рис. 3), распределение больных по группам риска в зависимости от техники РПЭ и примененного доступа (рис. 4).
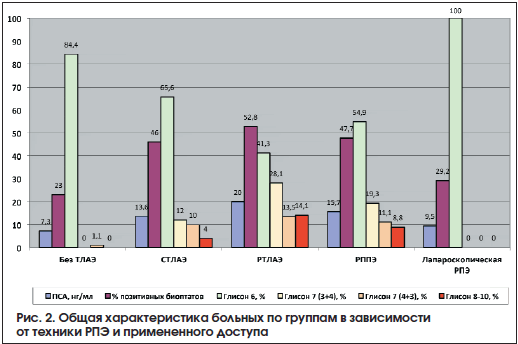
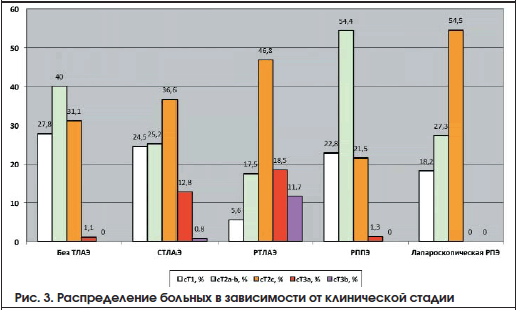
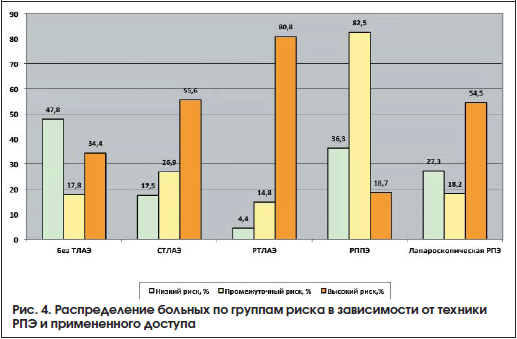
Результаты
Непосредственные результаты хирургического лечения больных РПЖ. Средняя продолжительность хирургического вмешательства в общей группе составила 172,7±43,9 (60–300) мин, медиана – 160 мин. Средняя продолжительность ТЛАЭ (стандартной и расширенной) 43±17,9 (10–200) мин, медиана – 40 мин. Средний объем интраоперационной кровопотери 476,8±512,9 (50–5000) мл, медиана – 350 мл. Необходимо отметить, что медиана и средний объем кровопотери снижались по мере накопления опыта хирургами. Средний объем кровопотери при выполнении ТЛАЭ 119,2±178,7 (0–2500) мл, медиана – 60 мл. Среднее количество удаленных ЛУ в общей группе больных составило 20±10 (2–64), метастазы в ЛУ диагностированы у 327 (17,7%) больных. Положительный хирургический край верифицирован у 182 (9,8%) больных. При анализе подгрупп больных в зависимости от выполненного объема ТЛАЭ установлено, что средняя продолжительность операции в подгруппе СТЛАЭ составила 178,6±48,7 мин, длительность СТЛАЭ – 36,2±16,9 мин, в подгруппе РПЭ с РТЛАЭ общее время операции составило 175±35,2 (70‒390) мин, продолжительность лимфаденэктомии – 47,5±17,1 мин. Средний объем общей кровопотери при выполнении РПЭ и СТЛАЭ составил 1156,5±805,7 мл, при выполнении РПЭ и РТЛАЭ 335,6±509 мл. Кровопотеря в процессе лимфодиссекции в группах СТЛАЭ и РТЛАЭ составила 175,7±217,94 и 80,4±131,7 мл соответственно. Возможно, больший объем кровопотери в подгруппе СТЛАЭ связан с ретроспективным характером данной группы, т. е. с тем, что в этой группе преобладали пациенты, оперированные ранее 2008 г., в период накопления хирургического опыта. В данной подгруппе преобладали больные, хирургическое вмешательство у которых выполнено на этапе освоения методики РПЭ и ТЛАЭ (рис. 5). 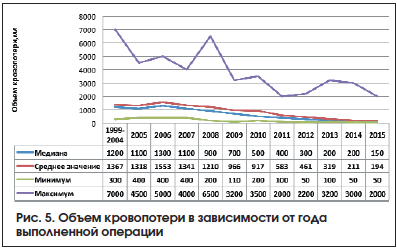
При анализе подгрупп больных установлено, что медиана удаленных ЛУ в группе РПЭ и РТЛАЭ составила 24 (5–64), в группе СТЛАЭ 12 (2–42) ЛУ. Метастазы в ЛУ при выполнении РТЛАЭ обнаружены у 246 (26%) больных, в группе СТЛАЭ – у 83 (11,6%) (табл. 6). В группе больных, перенесших РПЭ и РТЛАЭ, с наибольшей частотой метастазы верифицированы в наружных подвздошных ЛУ – в 34,2% случаев, в обтураторных – в 27,5%, внутренних подвздошных – в 26,6%, общих подвздошных – в 10,4% и пресакральных – в 1,3% случаев (рис. 6). 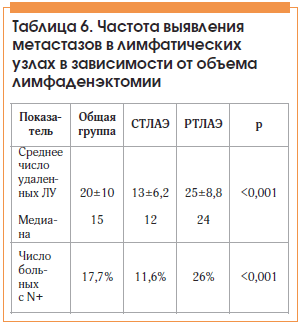
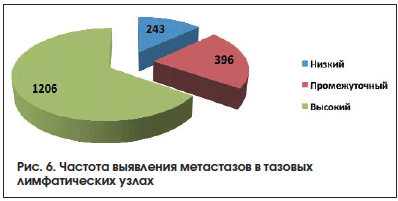
Таким образом, в группе РТЛАЭ за пределами границ зоны стандартной лимфодиссекции метастазы выявлены в 38,3% случаев, что свидетельствует о недостаточной диагностической точности СТЛАЭ. Выполнение расширенной ТЛАЭ ассоциировано с достоверно большим количеством удаляемых ЛУ и существенно улучшает диагностическую эффективность лимфаденэктомии за счет увеличения частоты выявления метастазов в ЛУ.
Распределение больных по патоморфологической стадии (рТ) представлено в таблице 7.
Среди интраоперационных осложнений отмечены следующие: травма прямой кишки – 53 (2,9%) случая, ранение мочеточников – 26 (1,4%) случаев. У большинства больных с травмой прямой кишки ушивали стенку кишки атравматическим двухрядным швом без формирования разгрузочной кишечной стомы. В случае травмы мочеточника выполняли стентирование и ушивание стенки последнего.
По данным гистологического анализа операционного материала положительный хирургический край выявлен у 182 больных (8,4%).
Отдаленные результаты хирургического лечения больных РПЖ. Отдаленные показатели выживаемости оценивали по методу Каплана – Майера. Критерием биохимического рецидива являлось трехкратное последовательное повышение уровня ПСА >0,2 нг/мл после операции.
Отдаленные результаты хирургического лечения оценены у 1224 (66,3%) больных. Медиана наблюдения составила 32 мес., средний период наблюдения – 36,2±32,5 (3–198) мес. За этот период в общей группе больных биохимический рецидив выявлен у 335 (27,4%) пациентов, показатель пятилетней биохимической БРВ в общей группе составил 58,8±2,2% (рис. 7). В группе низкого риска биохимический рецидив выявлен у 20 (11,8%) больных из 169, в группе промежуточного риска – у 58 (21,7%) из 267, в группе высокого риска – у 257 из 788 (32,6%) пациентов. 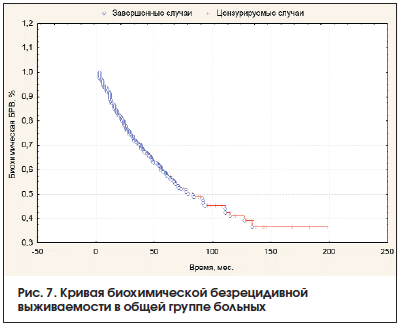
Пятилетняя ПСА-БРВ в группе больных с высоким риском составила 50,3±2,7%, 10-летняя БРВ – 20,1±5,2%. В группах промежуточного и низкого риска показатели 5- и 10-летней БРВ составили 61,6±5,3%; 47,6±7,2% и 84,8±4,3%; 67,4±11,4% соответственно.
Умерли 66 пациентов, из них 22 – от прогрессирования РПЖ, таким образом, показатель 5-летней общей выживаемости составил 94,2±1,2%, а показатель 5-летней ОСВ – 98,1±0,7%.
Показатели выживаемости зависели от объема оперативного вмешательства и группы риска (табл. 8).
Необходимо отметить, что при сравнении патоморфологических характеристик в зависимости от объема хирургического вмешательства (РПЭ с расширенной ТЛАЭ и РПЭ без стандартной ТЛАЭ или со стандартной ТЛАЭ) выявлено достоверно большее количество местнораспространенных (pТ3а и pT3b) (р20 нг/мл (26,5% против 20,3% в группе больных, оперированных до 2010 г.; р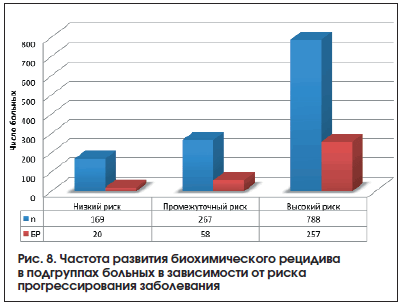
Заключение
РПЖ стоит в ряду наиболее актуальных проблем в онкологии на сегодняшний день. Разрабатывается и изучается множество новых методик лечения данного заболевания, тем не менее хирургическое лечение остается одним из основных методов лечения больных локализованным и местнораспространенным РПЖ и демонстрирует удовлетворительные онкологические и функциональные результаты. Накопление хирургического опыта позволяет существенно оптимизировать результаты данного метода у больных РПЖ, в т. ч. в когорте пациентов с высоким риском прогрессирования заболевания. Преимуществом хирургического лечения является возможность точного стадирования онкологического процесса и выявления неблагоприятных патоморфологических факторов прогноза, что позволяет выработать наиболее рациональную тактику лечения. Стратификация больных РПЖ высокого риска прогрессирования является критически важным параметром при определении терапевтической концепции и должна быть осуществлена с использованием комплекса клинических данных и факторов прогноза. Существует тенденция увеличения числа больных РПЖ с высоким риском прогрессирования и неблагоприятными факторами прогноза, которым выполняют хирургическое лечение. У больных с неблагоприятными послеоперационными факторами прогноза (наличие лимфогенных метастазов, в т. ч. с экстракапсулярной инвазией) рекомендовано рассмотрение вопроса о проведении адъювантной терапии с целью улучшения показателей выживаемости.
Литература
1. Злокачественные новообразования в России в 2015 г. (заболеваемость и смертность) / под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М., 2017 [Zlokachestvennye novoobrazovaniya v Rossii v 2015 g. (zabolevaemost’ i smertnost’) / pod red. A.D. Kaprina, V.V. Starinskogo, G.V. Petrovoj. M., 2017 (in Russian)].
2. De Angelis R., Sant M., Coleman M.P. et al. EUROCARE-5 Working Group. Cancer survival in Europe 1999‒2007 by country and age: results of EUROCARE-5-a population-based study // Lancet Oncol. 2014 Jan. Vol. 15(1). Р.23–34. doi: 10.1016/S1470-2045(13)70546-1. Epub 2013 Dec 5.
3. Bill-Axelson A., Holmberg L., Garmo H. et al. Radical prostatectomy or watchful waiting in early prostate cancer // N Engl J Med. 2014 Mar 6. Vol. 370(10). P.932–942. doi: 10.1056/NEJMoa1311593.
4. Sakr W.A., Haas G.P., Cassin B.F. et al. The frequency of carcinoma and intraepithelial neoplasia of the prostate in young male patients // J Urol. 1993 Aug. Vol. 150(2 Pt 1):379–385.
5. Lassen P.M., Kearse W.S. Rectal injuries during radical perineal prostatectomy // Urology 1995. Vol. 45:266–269.
6. Jansson K.F., Akre O., Garmo H. et al. Oncologic outcome after laparoscopic radical prostatectomy: 10 years of experience // Eur Urol. 2009 May. Vol. 55(5). Р.1014–1019. doi: 10.1016/j.eururo.2008.10.036. Epub 2008 Nov 6.
7. Prostate Cancer: Diagnosis and Treatment. National Collaborating Centre for Cancer (UK). Cardiff (UK): National Collaborating Centre for Cancer (UK). 2014 Jan.
8. Алексеев Б.Я., Нюшко К.М., Калпинский А.С. и др. Методологические аспекты и результаты радикальной промежностной простатэктомии у больных раком предстательной железы // Онкология. Журнал им. П.А. Герцена. 2016. Т.5. №1. С.5–11 [Alekseev B.Ya., Nyushko K.M., Kalpinskij A.S. i dr. Metodologicheskie aspekty i rezul’taty radikal’noj promezhnostnoj prostatehktomii u bol’nyh rakom predstatel’noj zhelezy // Onkologiya. Zhurnal im. P.A. Gercena. 2016. T.5. №1. S.5–11 (in Russian)].
9. Dahm P., Yang B., Salmen C. et al. Radical perineal prostatectomy for the treatment of localized prostate cancer in morbidly obese patients // The Journal of Urology. 2005. Vol. 174(1). Р.131–134. doi:10.1097/01.ju.0000161593.29525.e2.
10. Paiva C., Andreoni C., Cunha G. et al. Differences among patients undergoing perineal or retropubic radical prostatectomy in pain and perioperative variables: a prospective study // BJU International. 2009. Vol. 104(9). Р.1219–1226. doi:10.1111/j.1464-410x.2009.08551.x.
11. Fichtner J., Gillitzer R., Melchior S. Perineal Complications Following Radical Perineal Prostatectomy // Aktuelle Urologie. 2003. Vol. 34(4). Р.223–225. doi:10.1055/s-2003-41599.
12. Hoskin P.J., Rojas A.M., Ostler P.J. et al. Quality of life after radical radiotherapy for prostate cancer: longitudinal study from a randomised trial of external beam radiotherapy alone or in combination with high dose rate brachytherapy. Clinical Oncology. 2013. Vol. 25. Р.321–327.
13. Joseph J.V., Vicente I., Madeb R. et al. Robot-assisted vs pure laparoscopic radical prostatectomy: are there any differences? // BJU Int. 2005. Vol. 96. Р.39–42.
14. Asimakopoulos A.D., Pereira Fraga C.T., Annino F. et al. Randomized comparison between laparoscopic and robot-assisted nerve-sparing radical prostatectomy // J of Sexual Medicine. 2011. Vol. 8(5). Р.1503–1512.
15. Berge V., Berg R.E., Hoff J.R. et al. A prospective study of transition from laparoscopic to robot-assisted radical prostatectomy: quality of life outcomes after 36-month follow-up // Urology. 2013. Vol. 81(4). Р.781‒786.
16. Fiori C.M. Pure versus robot-assisted laparoscopic prostatectomy: Single centre, single surgeon experience // J. of Urology Conference(var.pagings) 2005. e458.
17. Magheli A., Gonzalgo M.L., Su L.M. et al. Impact of surgical technique (open vs laparoscopic vs robotic-assisted) on pathological and biochemical outcomes following radical prostatectomy: an analysis using propensity score matching // BJU International. 2011. Vol. 107(12). Р.1956‒1962.
18. Ramsay C., Pickard R., Robertson C. et al. Systematic review and economic modelling of the relative clinical benefit and cost-effectiveness of laparoscopic surgery and robotic surgery for removal of the prostate in men with localised prostate cancer // Health Technology Assessment. 2012. Vol. 16(41). Р.iv-313.
19. Willis D.L., Gonzalgo M.L., Brotzman M. et al. Comparison of outcomes between pure laparoscopic vs robot-assisted laparoscopic radical prostatectomy: a study of comparative effectiveness based upon validated quality of life outcomes // BJU International. 2012. Vol. 109(6). Р.898‒905.
20. Wolanski P., Chabert C., Jones L. et al. Preliminary results of robot-assisted laparoscopic radical prostatectomy (RALP) after fellowship training and experience in laparoscopic radical prostatectomy (LRP) // BJU International. 2012. Vol. 110(Suppl 4). Р.64‒70.
21. Meng M.V., Elkin E.P., Latini D.M. et al. Treatment of patients with high risk localized prostate cancer: results from cancer of the prostate strategic urological research endeavor (CaPSURE) // J. Urol. 2005. Vol. 173. P.1557–1561.
22. Cooperberg M.R., Carroll P.R. Trends in management for patients with localized prostate cancer. 1990–2013 // JAMA. Vol. 314. P.80–82.
23. Freedland S.J., Partin A.W., Humphreys E.B. et al. Radical prostatectomy for clinical stage T3a disease // Cancer. 2007. Vol. 109. Р.1273–1278.
24. Akre O. et al. Mortality among men with locally advanced prostate cancer managed with noncurative intent: a nationwide study in PCBaSeSweden // Eur. Urol. Vol. 60. P. 554–563.
25. Ward J.F., Slezak J.M., Blute M.L. et al. Radical prostatectomy for clinically advanced (cT3) prostate cancer since the advent of prostate-specific antigen testing: 15-year outcome // BJU Int. Vol. 95. P. 751–756.
26. Yossepowitch O. et al. Secondary therapy, metastatic progression, and cancer-specific mortality in men with clinically high-risk prostate cancer treated with radical prostatectomy // Eur. Urol. Vol. 53. P. 950–959.
27. Stephenson A.J. et al. Prostate cancer-specific mortality after radical prostatectomy for patients treated in the prostate-specific antigen era // J. Clin. Oncol. Vol. 27. P.4300–4305.
28. Mitchell C.R. et al. 20-year survival after radical prostatectomy as initial treatment for cT3 prostate cancer // BJU Int. Vol. 110. P. 1709–1713.
29. Briganti A. et al. Natural history of surgically treated high-risk prostate cancer // Urol. Oncol. Vol. 33. P.163.e7–163.e13.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
материал с сайта https://www.rmj.ru/
