Введение
Уротелиальная карцинома, или уротелиальный рак (УР), является одним из распространенных злокачественных новообразований и остается важнейшей проблемой современной медицины. УР поражает значимую по удельному весу группу мужчин, составляя 4,6% от всех злокачественных новообразований у мужского населения в Российской Федерации за 2021 г., и занимает 9-е место по смертности в России и 10-е — в мире [1]. Несмотря на успехи в лечении УР, клинические исходы при метастатическом заболевании остаются неудовлетворительными: 5-летняя выживаемость составляет около 8% [2].
Парадигма лечения пациентов с метастатическим УР (мУР) при неэффективности химиотерапии первой линии на основе препаратов платины изменилась с появлением иммуноонкологических препаратов — ингибиторов иммунных контрольных точек (ИИКТ), которые ингибируют взаимодействие между рецептором запрограммированной смерти 1 (PD-1) и его лигандом (PD-L1) на Т-лимфоцитах. В настоящее время эти препараты считаются стандартной терапией второй линии при мУР. При неэффективности цисплатинсодержащей полихимиотерапии и невозможности использования иммуноонкологических препаратов для увеличения продолжительности жизни пациентов, согласно федеральным клиническим рекомендациям, показано назначение винфлунина. Винфлунин на сегодняшний день является единственным химиотерапевтическим препаратом, продемонстрировавшим свое преимущество над плацебо в рандомизированном исследовании III фазы, увеличив медиану беспрогрессивной и общей выживаемости с 1,5 до 3 мес. и с 4 до 7 мес. соответственно в общей популяции пациентов [3]. А систематический обзор 10 исследований реальной клинической практики, включавший 797 пациентов с мУР (средний возраст 62–69 лет) с ECOG 0–1 из десяти европейских стран (140 исследовательских центров), получавших терапию винфлунином во второй линии после прогрессирования на препаратах платины, показал, что частота объективного ответа (ЧОО), оцененная с использованием модели с фиксированными эффектами (ФЭ), составила 18% (95% доверительный интервал (ДИ) 15–21), а с помощью модели со случайными эффектами (СЭ) — 19% (95% ДИ 15–23) при среднем уровне гетерогенности анализируемых исследований I2=42,63%. Объединенная частота контроля заболевания, оцененная с использованием модели с ФЭ, составила 49% (95% ДИ 46–53), а с использованием модели с СЭ — 49% (95% ДИ 42–55) при I2=66,48%. Медиана выживаемости без прогрессирования (ВБП) варьировала от 2,3 до 6,2 мес., а медиана общей выживаемости (ОВ) — от 5,2 до 11,9 мес. [4].
В статье представлено клиническое наблюдение пациента c длительным контролем распространенного мУР, прогрессирующим после платиносодержащей химиотерапии.
Клиническое наблюдение
Больной Т., 65 лет, обратился в ГБУЗ КОД № 1 ДЗ КК (г. Краснодар) в феврале 2019 г. с жалобами на примесь крови в моче. При сборе анамнеза было установлено, что пациент к врачу с этой проблемой длительное время не обращался. По результатам обследования заподозрена опухоль мочевого пузыря, выявлен гидронефроз справа. Из сопутствующих заболеваний были выявлены: гипертоническая болезнь 2-й степени, ожирение 2-й степени, варикозное расширение вен нижних конечностей. На постоянной основе принимает ингибиторы АПФ (эналаприл 5 мг/сут), антикоагулянты (ривароксабан 10 мг/сут).
05.02.2019 была выполнена чрескожная пункционная нефростомия, 06.02.2019 — трансуретральная резекция мочевого пузыря (ТУР) и выставлен диагноз C97 первично-множественный синхронный рак: C-r мочевого пузыря, Т1N0M0, I стадия, EСOG 1. По результатам гистологического исследования от 10.02.19 было установлено, что опухоль представляет собой высокодифференцированную папиллярную уротелиальную карциному. По месту жительства с февраля по апрель 2019 г. было проведено 6 курсов адъювантной внутрипузырной химио-терапии препаратом доксорубицин 50 мг в 50 мл 0,9% раствора натрия хлорида. По данным контрольной компьютерной томографии (КТ) в марте 2019 г. были выявлены инфильтративные изменения паранефральной клетчатки справа, диагноз: C-r правого мочеточника Т3N0M0, III cтадия. 25.04.2019 выбрана тактика лечения в виде лапароскопической радикальной нефруретерэктомии справа. В ноябре 2019 г. по данным контрольной КТ без контрастирования по месту жительства выявлен очаг — образование крестца, назначено дообследование. По результатам дообследования в ГБУЗ КОД № 1 ДЗ КК было диагностировано метастатическое поражение крестца с литическим компонентом размером 5 мм. В начале 2020 г. пациент стал отмечать усиление болевого синдрома — заподозрен рецидив опухоли мочевого пузыря.
По результатам гистологического исследования биоптата 30.04.2020, полученного в ходе лапароскопической радикальной нефруретерэктомии от 25.04.2019: инфильтративная уротелиальная карцинома G2 c прорастанием через мышечный слой в клетчатку вокруг мочеточника. В шести лимфоузлах опухолевый рост не обнаружен. Края резекции без опухолевого роста. Край резекции мочеточника без опухолевого роста. Паракавальная жировая клетчатка с лимфатическими узлами без опухолевого роста. Получал адъювантную внутрипузырную химиотерапию препаратом доксорубицин.
По результатам КТ от 03.07.2020 выявлены очаговые образования в паренхиме печени в S3, S4, S8, вероятно вторичного характера, размером 10×15 мм. Для верификации под УЗИ-контролем очаги не были доступны.
Врачебным консилиумом ГБУЗ КОД № 1 ДЗ КК в июле 2020 г. выбрана тактика лечения в виде назначения трех курсов схемы: цисплатин 120 мг во 2-й день + гемцитабин 1800 мг 1, 8, 15-й дни каждые 28 дней.
По результатам контрольной КТ от 05.10.2020: состояние после нефрэктомии справа, ТУР мочевого пузыря. Структурные изменения задней стенки мочевого пузыря, стабильные гиперваскулярные образования в печени. Конкременты в левой почке. Минимальный двухсторонний гидроторакс, гидроперикард (рис. 1).
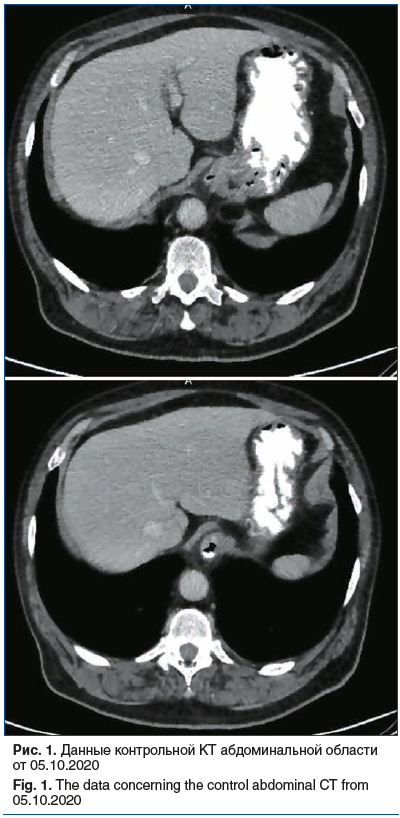
Пациент терапию переносил неудовлетворительно: имели место почечная дисфункция (скорость клубочковой фильтрации (СКФ) <55 мл/мин/1,73 м2), нарастание болевого синдрома (интенсивность боли по ВАШ 40%). В связи с этим было принято решение о переводе пациента на вторую линию терапии.
С октября 2020 г. пациент был переведен на терапию препаратом винфлунин в дозе 280 мг/м2 1 раз, цикл 21 день. На фоне терапии пациент отмечал уменьшение болевого синдрома (интенсивность боли по ВАШ 30%).
После трех курсов терапии винфлунином на контрольной КТ от 27.01.2021 наблюдалась выраженная положительная динамика (рис. 2). По стандартам Recist 1.1 отмечен полный ответ очагов в печени. Состояние после нефрэктомии справа, ТУР мочевого пузыря. Возникшие в динамике интерстициальные изменения нижней доли правого легкого — более вероятно поствоспалительного характера. Минимальный двухсторонний гидроторакс, гидроперикард — динамика положительная.
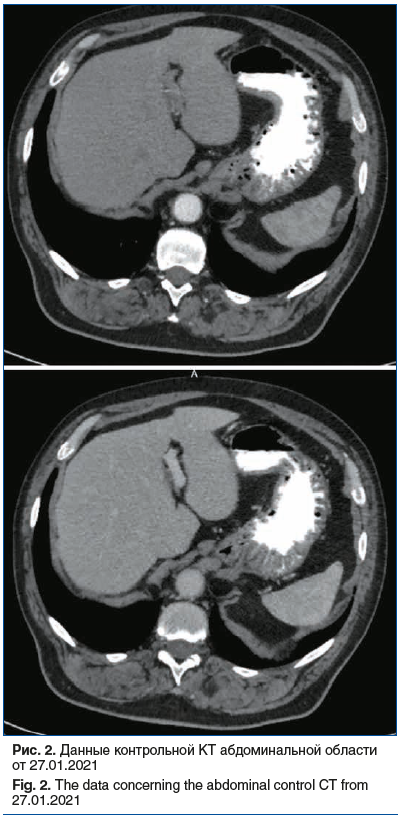
На фоне лечения пациент отмечал уменьшение выраженности болевого синдрома, что позволило отказаться от приема анальгетиков.
Учитывая удовлетворительную переносимость терапии и положительную динамику, было решено продолжить лекарственную терапию в прежнем режиме.
По данным последующих контрольных КТ от 07.07.2021 и 09.11.2021, на терапии винфлунином по критериям Recist 1.1 наблюдалась стабилизация заболевания: стабильная картина гиперваскулярных образований в печени.
Пациент вел активный образ жизни, терапию переносил удовлетворительно. Однако в конце февраля 2022 г. принял решение закончить терапию препаратом винфлунин, мотивируя это тем, что устал ездить на инфузии, и был взят под динамическое наблюдение.
По данным контрольной КТ от 22.02.2022 состояние после нефрэктомии справа, состояние после ТУР мочевого пузыря, структурные изменения предстательной железы. Двусторонний малый гидроторакс, малый гидроперикард. Стабильные гиперваскулярные образования в печени — без динамики. Стабильное очаговое образование в S4, S8 печени. КТ-признаки портальной гипертензии. Конкременты в левой почке. Единичные кисты левой почки.
С октября 2020 г. по февраль 2022 г. пациент получил 24 цикла терапии препаратом винфлунин. На протяжении лечения винфлунином была отмечена гематологическая токсичность в виде анемии и нейтропении 1-й степени и не гематологическая токсичность — астения 2-й степени, миалгия 1-й степени, боли в костях 2-й степени. Однако все нежелательные явления хорошо контролировались и не потребовали редукции дозы или отмены терапии. С февраля 2022 г. по настоящее время пациент находится под динамическим наблюдением. По данным контрольной КТ от 21.03.2023 — стабилизация процесса.
Обсуждение
Стандартом терапии первой линии до сих пор является проведение химиотерапии платиносодержащими препаратами [3]. Схемы с включением производных платины (MVAC, цисплатин + гемцитабин) обеспечивают увеличение продолжительности жизни больных до 14,8 и 13,8 мес. соответственно [4]. Однако, несмотря на очевидную эффективность платиносодержащей терапии, довольно большое число пациентов не получают этой терапии. Противопоказанием могут быть сопутствующие заболевания у пациентов старшей возрастной группы, ECOG>2, снижение СКФ менее 50 мл/мин/1,73 м2 [5].
В последние несколько лет альтернативой цитостатическим комбинациям стало применение ИИКТ, помогающих собственной иммунной системе лучше распознавать опухолевые клетки [6–9].
В качестве второй линии терапии при резистентности к платиносодержащим комбинациям и отсутствии возможности проведения иммунотерапии больным с благоприятными прогностическими характеристиками (состояние по шкале ECOG≤1, уровень гемоглобина >10 г/дл, отсутствие метастазов в печени) возможно назначение винфлунина в дозе 280–320 мг/м2 1 раз в 3 нед.1 [5]. Ретроспективный анализ данных по применению винфлунина у пациентов с метастатическим раком мочевого пузыря в условиях реальной клинической практики в России показал более высокую (53,3%) клиническую эффективность по сравнению с показателями регистрационного исследования и других международных исследований реальной клинической практики, а медиана выживаемости без прогрессирования оказалась сопоставимой с данными европейских исследований [10].
Прогрессирование рака мочевого пузыря после предшествующей химиотерапии на основе препаратов платины и предшествующего лечения с применением ИИКТ остается сложной клинической ситуацией с малым количеством данных в пользу выбора последующих вариантов терапии. С этой точки зрения интересными представляются результаты ретроспективного многоцентрового исследования F. Riedel et al. [11], посвященного анализу данных 105 пациентов с мУР, получавших винфлунин в шести исследовательских центрах в 2010–2021 гг. В исследуемой когорте 61 (58,1%) пациент получал предшествующую терапию с использованием ИИКТ до начала лечения винфлунином (группа ИИКТ+), и 44 (41,9%) пациента ранее не получали терапию с применением ИИКТ (группа ИИКТ-). В группе ИИКТ+ ЧОО составила 22,4%, в группе ИИКТ- — 15,6% (p=0,451), а частота клинической эффективности — 51,0 и 25,0% соответственно (p=0,02). У пациентов группы ИИКТ+ была зарегистрирована более длительная ОВ (8,78 мес. против 5,72 мес. в группе ИИКТ-, p=0,467) и более длительная ВБП (3,09 мес. против 2,14 мес., p=0,105). У пациентов, получавших предшествующую терапию ИИКТ, риск смерти был ниже на 35,5%, хотя уровень статистической значимости не был достигнут (отношение рисков (ОР) 0,6451; 95% ДИ 0,3983–1,045; р=0,074). Плохое общее состояние (оценка 1 или выше по шкале ECOG) и низкий уровень гемоглобина <10 г/дл в значительной степени ассоциировались с более высоким риском смерти (ОР 2,248 и 1,737 соответственно). Нежелательные явления 3–4-й степени были зарегистрированы у 30,0 и 38,1% пациентов в группе ИИКТ+ и ИИКТ- соответственно [12]. Как показал анализ литературы, это исследование представляет собой первый комплексный анализ данных по эффективности винфлунина, применяемого в качестве монохимиотерапии у пациентов с мУР, в зависимости от наличия предшествующей терапии ИИКТ. Полученные результаты свидетельствуют о том, что применение винфлунина как в качестве второй линии терапии после платиновой терапии, так и в качестве третьей линии терапии у пациентов, получавших платиновые дублеты и затем ИИКТ, обеспечивает поддающуюся оценке клиническую пользу.
В представленном наблюдении терапия винфлунином в качестве препарата второй линии после прогрессии на платиносодержащей терапии продемонстрировала стойкий и длительный (17 мес.) ответ на лечение. При этом, несмотря на наличие сопутствующих заболеваний у пациента, на фоне лечения винфлунином отмечено меньшее количество клинически значимых нежелательных побочных явлений в отличие от платиносодержащих схем. Степень тяжести осложнений была приемлемой и не потребовала редукции дозы винфлунина или отмены препарата. Пациент отмечал уменьшение болевого синдрома, что позволило отказаться от приема анальгетиков и вести активный образ жизни.
Заключение
Представленное клиническое наблюдение демонстрирует возможность длительного контроля метастатической уротелиальной карциномы, резистентной к платиносодержащей терапии, с удовлетворительной переносимостью химиотерапии у пациента с сопутствующей патологией.
Сведения об авторе:
Шатохина Алина Станиславовна — врач-онколог, заведующая отделением противоопухолевой лекарственной терапии и химиотерапии ГБУЗ КОД № 1 ДЗ КК; 350040, Россия, г. Краснодар, ул. Димитрова, д. 146; ORCID iD 0000-0001-7719-370X.
Контактная информация: Шатохина Алина Станиславовна, e-mail: alina.shatokhina@yandex.ru.
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 04.04.2023.
Поступила после рецензирования 27.04.2023.
Принята в печать 22.05.2023.
About the author:
Alina S. Shatokhina — oncologist, Head of the Department of Anticancer Drug Therapy and Chemotherapy, Clinical Oncological Dispensary No 1; 146, Dimitrova str., Krasnodar, 350040, Russian Federation; ORCID iD 0000-0001-7719-370X.
Contact information: Alina S. Shatokhina, e-mail: alina.shatokhina@yandex.ru.
Financial Disclosure: the author has no a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 04.04.2023.
Revised 27.04.2023.
Accepted 22.05.2023.
Информация с rmj.ru
