Выражаем искреннюю благодарность авторам данной статьи за междисциплинарный подход к исследованию акустической плотности и ригидности структур глаза в норме и при открытоугольной глаукоме (ОУГ). Авторы попытались выявить ключевые биомеханические параметры роговицы и склеры как возможные маркеры развития заболевания. Однако в рассматриваемом исследовании выборка по количеству глаз в принципе не являлась репрезентативной (по 20 здоровых и глаукомных глаз, что явно недостаточно для статистически значимых выводов), а погрешности измерений при использовании разных методов диагностики в этом исследовании практически не учитывались. И без сомнения, во многом это повлияло на достоверность полученных результатов.
Стоит признать, что в мировой офтальмологии при выполнении научных или клинических исследований погрешности измерений почти никогда не учитываются, что зачастую приводит к ошибочному диагнозу и неадекватному выбору способа лечения. И это сегодня проблема всей мировой офтальмологии, когда, например, относительные погрешности измерений внутриглазного давления (ВГД) разными способами часто превышают 15–20% и более [1, 2]. Между тем в технике результаты измерений считаются достоверными, если относительная погрешность измерений не превышает 2%.
Стоит отметить, что вершиной своей научной и организаторской деятельности Герман Людвиг Фердинанд фон Гельмгольц считал построенный по его инициативе в Шарлоттенбурге в 1877 г. первый в мире Институт метрологии (тогда Физико-техническое имперское ведомство, а ныне — Физический институт Берлинского университета), чтобы создавать высокоточные средства измерения. Физик, механик, акустик, метеоролог, физиолог и военный врач Гельмгольц уже тогда прекрасно понимал, что без точных измерений невозможно заниматься настоящей наукой, включая и офтальмологию как раздел медицины. К сожалению, в современной медицине редко встретишь работы, в которых выводы основаны на учете погрешностей измерений.
Мы уже более 30 лет занимаемся проблемой ОУГ на меж-дисциплинарном уровне, и поэтому нам ясна неадекватность законам механики тех результатов, которые получили авторы статьи. К сожалению, в постановке задачи исследования, в примененных авторами методиках, а также в трактовке полученных результатов имеются не в полной мере корректные, а иногда и ошибочные представления о биомеханических характеристиках глаза, которые во многом и определяют патологическую физиологию глаза при ОУГ.
Стоит особо подчеркнуть, что мы с уважением относимся к авторам рассматриваемого исследования и хорошо понимаем, какие трудности они преодолели в постановке задачи. Однако использование архаичных представлений об отсутствии взаимосвязанной работы всех структур глаза сыграло с авторами злую шутку: полученные результаты и их трактовка в большей части противоречат законам механики.
В частности, одним из предложенных авторами научных результатов является вывод о снижении окулярной ригидности в глаукомных глазах по сравнению со здоровыми. Это катастрофическая ошибка. Далее мы постараемся кратко объяснить и обосновать неадекватность этого и других выводов авторов. Но сначала разберемся в биомеханических особенностях происходящих патофизиологических процессов. Ведь без этого будет не понятна суть наших замечаний. И тогда ошибки, которые сделали авторы рассматриваемой статьи, будут повторять и другие исследователи глаза.
![Рисунок. Обобщенный ход кривых изменения ригидности, флуктуации (состояния функций склеры) и ВГД в разные возрастные периоды жизни человека при ВОГ и ОУГ [3]. Шкала возраста выбрана не с традиционным шагом 10 лет, а согласно периодам возрастного старения Рисунок. Обобщенный ход кривых изменения ригидности, флуктуации (состояния функций склеры) и ВГД в разные возрастные периоды жизни человека при ВОГ и ОУГ [3]. Шкала возраста выбрана не с традиционным шагом 10 лет, а согласно периодам возрастного старения](https://medblog.su/wp-content/uploads/2023/11/Diskussiya-akusticheskaya-plotnost-i-rigidnost-struktur-glaza-v-norme-i.png)
Для пояснения последних представлений о патогенезе ОУГ мы показали на рисунке обобщенную теоретическую диаграмму наших многолетних динамических исследований на нескольких тысячах здоровых и глаукомных глаз на пневматическом анализаторе ORA (Rieсhert, США) (по собственным новым и простым методикам), а также с помощью кратковременной статической аппланационной тонометрии двумя разными грузами по нашей расчетной схеме. Эти измерения фактически проводились при неизменном объеме глаза за время 0,02 с (пневматическое воздействие на ORA) и 0,25 с (аппланационное воздействие грузом 10 и 15 г по Маклакову) c 15-минутным интервалом между измерениями, т. е. в условиях, близких к «закрытой гидравлической системе глаза», когда объем глаза практически не изменялся.
Из рисунка хорошо видно, что до 45 лет изменений ригидности фиброзной оболочки глаза (ФОГ), уровня ВГД и флуктуации склеры нет. Однако начиная с 45 лет ригидность здоровых глаз постепенно повышается. В ответ синхронно повышается и уровень ВГД. Именно в ответ на рост ригидности (жесткости) ФОГ повышается ВГД, а не само по себе из-за возможного «засорения» путей оттока водянистой влаги с возрастом. Поэтому основная причина возможного развития возрастной офтальмогипертензии (ВОГ) — это постепенный рост ригидности ФОГ.
Отметим, что аналогичный нормальный возрастной процесс старения происходит и во всей сосудистой системе организма человека, когда ригидность (жесткость) стенок сосудов с возрастом растет, а в ответ синхронно возрастает и уровень АД. И кардиологи, и офтальмологи сегодня испытывают трудности с обоснованием уровня целевого давления соответственно при артериальной гипертензии, ВОГ или ОУГ не только из-за отсутствия объективных индивидуальных критериев его достижения, но и из-за наличия «черных дыр» в теориях их патогенеза. Практикующие врачи хорошо знают, как трудно бывает отделить ВОГ от так называемой «преглаукомы» или подозрения на ОУГ, используя такой не в полной мере достоверный критерий, как «уровень ВГД» [4–6].
Однако сегодня многие кардиологи и офтальмологи уже четко понимают, что физиологическое повышение АД или ВГД при ВОГ почему-то необходимо стареющему организму здорового человека! И что традиционный путь длительного применения гипотензивной фармакотерапии при артериальной гипертонии, ВОГ или ОУГ, по-видимому, всегда ухудшает процессы метаболизма и ускоряет старение соответствующих структур. А это неминуемо приведет к следующему (уже рукотворному!) скачку АД или ВГД и к ускорению процессов старения.
Опрос 111 случайно выбранных американских офтальмологов (2004) показал, что большинство (87%) врачей позволяли пациентам с ВОГ без факторов риска перехода в ОУГ иметь истинное ВГД >25 мм рт. ст., в то время как почти 30% врачей позволяли таким пациентам иметь уровень ВГД >30 мм рт. ст. до начала терапии. И только при превышении этого физиологического порога истинного ВГД принимались меры к его снижению. Уровень ВГД от 28 до 30 мм рт. ст. считали порогом 62% врачей, а уровень ВГД от 22 до 27 мм рт. ст. — 71% врачей [3]. Поэтому мы совершенно согласны с авторами рассматриваемой в отклике статьи в том, что «у большинство пациентов при повышенном ВГД не развивается глаукома» (р. 932).
Для достоверной оценки изменения функциональных характеристик ФОГ при ВОГ и при ОУГ мы ввели новое в офтальмологии понятие — флуктуация. Это мера текущей физиологической способности оболочки глаза осуществлять свои основные функции (мы их нашли и описали в 2009 г.): поддерживать тургор глаза, нивелировать пульс АД (т. е. нивелировать изменение объема сосудов в систолу-диастолу, приводящее к микроизменениям объема глаза), выталкивать за счет дренирования наружу по путям оттока внутриглазную жидкость и поддерживать необходимый текущий объем глаза [6–8].
Эти функции ФОГ осуществляет за счет эластических структур склеры, а мозг контролирует текущий необходимый объем глаза посредством механорецепторов в склере, а также рецепторов простагландинов в склере. Важно отметить, что уровень ВГД в глазу не контролируется, поскольку морфологи пока не обнаружили в глазу барорецепторы [9, 10]. То есть мозг контролирует не уровень ВГД, а текущий объем глаза.
Это первое базовое положение в биомеханике ФОГ. Причем главная физиологическая задача глаза — это ежесуточное прокачивание через его полость постоянного объема водянистой влаги (около 4,5 мкл/мин) для поддержания метаболизма в норме. Аналогично сердечно-сосудистая система ежесуточно прокачивает физиологически необходимый нам, примерно постоянный объем крови (иногда 2–4 м3) для поддержания метаболизма во всех структурах организма.
Второе базовое положение в биомеханике ФОГ — это то, что давление в глазу может возникнуть только тогда, когда ФОГ сожмет снаружи все внутриглазные структуры (которые по своей сути состоят в основном из несжимаемых водянистых образований). Это фундаментальное положение до сих пор непонятно огромному числу специалистов, которые считают, что в тканях глаза есть собственное давление, которое и «распирает изнутри» капсулу глаза, создавая ВГД [11], или рассматривают в качестве причины повышения ВГД в глазу не увеличение ригидности склеры, а повышение сопротивления оттоку водянистой влаги [12].
Эти архаичные представления фактически не позволяют огромному числу исследователей глаза понять, что уровень ВГД в глазу в каждый момент определяется в первую очередь уровнем объемной ригидности ФОГ при конкретном объеме глаза. Говоря коротко: какова ригидность, таков и уровень ВГД (р<0,001) [3, 6]. И не наоборот! Это фактически проявление закона природы и теории оболочек.
На рисунке также представлено индивидуально подвижное глаукомное поле продолжительностью обычно 10–15 лет, в рамках которого происходит патологический процесс ускоренного старения капсулы глаза. В результате этого ригидность ФОГ возрастает в 2–3 раза, а флуктуация падает в 4–8 раз [13, 14]. ФОГ фактически теряет способность выполнять свои физиологические функции в полном объеме. Подчеркнем, что этот патологический процесс ускоренного старения ФОГ приводит к ответному и иногда катастрофическому скачку уровня ВГД. Лучше всего этот патологический процесс описывает классическое определение известного офтальмолога, доцента СПбМАПО Г.В. Родзевич (2000): «Глаукома — это ускоренное старение глаза, опережающее возраст»!
Полученные в классической работе морфолога Н.Л. Пригожиной [цит. по 15, с. 57] «гистологические данные позволяют считать, что вследствие дистрофических и атрофических процессов, ведущих к исчезновению эластических волокон из стромы склеры, к нарастающему склерозу и ожирению, склера теряет способность к растяжению и компенсации при увеличении содержимого глаза, при изменениях оттока и притока крови и внутриглазных жидкостей». Действительно, многое уже было сделано и доказано в более ранних клинических исследованиях нашими учителями. Надо просто чаще возвращаться к фундаментальным исследованиям, чтобы наконец-то суметь «увидеть» и другие их грани на новом витке обобщений [16].
Итак, первое ключевое звено в развитии глаукомного процесса — это патологическое возрастание ригидности склеры из-за ускоренного старения, причем этот патологический процесс наблюдается в глаукомных глазах обычно после 45 лет и далее практически не зависит от возраста (р<0,001) [13, 14]. Здесь стоит отметить, что любое рукотворное снижение уровня нормального метаболизма в глазу будет также приводить к дополнительному ускоренному старению склеры, росту ее текущей ригидности и к ответному скачку уровня ВГД [7].
Поэтому наше часто неоправданное интенсивное медикаментозное или хирургическое воздействие для снижения уровня ВГД будет всегда приводить к уменьшению текущего объема глаза, существенному сокращению объема присутствующей в полости глаза свежей водянистой влаги и к ответному ускоренному старению ФОГ. И важно, что это обязательно и безусловно приведет к очередным скачкам ригидности и ВГД.
Второе ключевое звено в патогенезе ОУГ — это индивидуальная склонность диска зрительного нерва (ДЗН) к экскавации, которая приводит к деформации (перегибу, сжатию и сколу) аксонов ганглиозных клеток. И здесь стоит отметить, что повышенная предрасположенность аксонов к деформации в области ДЗН присуща именно человеку, поскольку в его аксонах отсутствует миелиновая оболочка в месте их перехода сквозь структуры решетчатой пластинки склеры [10].
Деформация аксонов, в свою очередь, приводит не только к частичному снижению уровня аксоно-плазматического тока, но и к возрастанию электрического сопротивления аксонов в очаге деформации. Внутри глаза в местах деформации аксонов перед решетчатой мембраной склеры возникает «электрическая нейропатия», при которой в зрительные участки коры головного мозга приходит от колбочек и палочек ослабленный электрический потенциал (статическое электрическое напряжение). И возможно, такой сигнал мозг просто игнорирует как заведомо слабый, т. е. ослабленный в месте деформации аксона первоначальный нормальный электрический импульс от колбочек и палочек мозгом не воспринимается. Стоит отметить, что здесь речь в принципе не идет о патологии других структур зрительного тракта, поскольку причина фатального ослабления электрического сигнала от палочек и колбочек располагается всегда только в месте деформации аксонов на сравнительно жестком склеральном пояске. И мы хорошо знаем о возможности полного восстановления полей зрения при снижении ВГД в глазах с начальной ОУГ [17]: распрямившиеся после деформации аксоны начинают доставлять в мозг электрический сигнал необходимого уровня напряжения в вольтах.
Сегодня стало понятно, что одним из перспективных путей борьбы с глаукомой может быть создание медикаментозных препаратов для увеличения электропроводимости аксонов в месте их деформации.
Лучше всего интенсивность процесса местной деформации аксонов на жестком склеральном ободке при их дальнейшем осаживании кзади совместно со структурами решетчатой пластинки склеры можно надежно и достоверно отследить по индивидуальному изменению объема экскавации ДЗН на томографе типа HRT-II. Чем больше объем экскавации, тем больше прогибается целиком поверхность ДЗН (осаживается кзади, например, как плунжер в шприце), причем наибольшая деформация аксонов происходит по краям ДЗН при перегибе на жестком и сравнительно остром склеральном ободке, т. е. именно на краях склерального ободка возникают самые большие по величине деформации аксонов. И именно обобщенный параметр «объем экскавации» лучше всего это отслеживает [18, 19]. Из сказанного следует важный вывод: чем выше текущая ригидность (жесткость) склеры, тем более интенсивной будет деформация аксонов в области склерального ободка.
Стоит рассмотреть также распространенное ошибочное мнение о том, что чем выше ригидность склеры (и входящих в нее структур ДЗН), тем будет меньше экскавация. А чем меньше ригидность (жесткость) ДЗН, тем якобы эта склонность к прогибу у ДЗН возрастет. Это сродни мифу о влиянии толщины роговицы на уровень ВГД.
Если смотреть в корень, то объем экскавации даже у молодого эластичного ДЗН будет зависеть от перепада (не путать с градиентом!) внутричерепного давления (ВЧД) и ВГД. Стоит пояснить на примере ключевое различие этих двух терминов, которые традиционно не вполне корректно используют офтальмологи во всем мире. Перепад высот — это разница в высоте двух горных вершин или двух точек (начальной и конечной) при спуске альпиниста с вершины. То есть перепад — это абсолютная разница значений, например, уровня ВГД и ВЧД в мм рт. ст. А градиент — это скорость изменения этой абсолютной разницы значений, например, по толщине решетчатой пластинки склеры. По аналогии с горами — это скорость потери высоты при спуске альпиниста с горы. Можно быстро «потерять высоту» — мастерски спуститься по альпинистской веревке вниз вдоль отвесной скалы, а можно медленно спускаться пешком по длинной обводящей тропе. На пути по отвесной скале будет высокое значение градиента потери высоты (потери разницы высот), а на пологой тропе — низкое, хотя перепад высот и там, и там будет одинаков. Но для экскавации ДЗН важен не градиент, а перепад уровней ВГД и ВЧД, что соответствует абсолютной разнице сил, действующих на ДЗН с обеих сторон. И понятие «градиент» совершенно не позволяет оценить склонность к экскавации у ДЗН: мы можем иметь малый перепад давлений с огромным градиентом, а можем иметь большой перепад давлений, но с мизерным градиентом!
И с точки зрения механики нам важно понимать, что изнутри со стороны полости глаза на площадь ДЗН действует ВГД плюс текущее аккомодационное давление в стекловидной камере (максимальное при взгляде вдаль, почему — поясним чуть позже), а со стороны черепа — ВЧД. И нам важно знать именно абсолютную разницу в величине этих сил (т. е. перепад давлений), потому что именно от этого в первую очередь и зависит величина смещения, т. е. экскавации ДЗН. Причем как быстро изменяется эта разница давлений по толщине решетчатой пластинки склеры для прогнозирования склонности ДЗН к экскавации, уже не так важно. Поэтому выражение «градиент ВГД/ВЧД» с научной точки зрения стоит применять только корректно, например, для описания скорости изменения давления по толщине ДЗН, а в общеклинической практике для описания предрасположенности к экскавации у ДЗН всегда следует употреблять только безусловно грамотный термин — «перепад давлений». Ведь, как говорили в древности китайцы, — «если мы правильно называем, значит, мы правильно понимаем»!
Однако даже при высокой жесткости решетчатой пластинки склеры ДЗН ее склонность к экскавации может быть также высокой. Вспомним жестяную крышку консервной банки, когда даже от легкого нажатия сверху пальцем она «прощелкивается» внутрь. В механике это явление называется «потеря устойчивости». Именно так выворачивается зонтик наизнанку при сильном порыве ветра — теряет устойчивость.
Мы предложили диагностировать склонность ДЗН к динамическому прогибу (прощелкиванию) с помощью двух последовательных измерений экскавации на HRT-II — сначала без мидриатика, а потом — с мидриатиком [18, 19]. Поясним это. При расслаблении ресничной мышцы максимально натягиваются передняя и задняя порции волокон ресничного пояска, из-за чего хрусталик осаживается кзади и вжимается в поверхность стекловидной камеры (СК) [20]. При этом давление в СК локально увеличивается на фоне неизменного текущего ВГД. На практике это приводит к увеличению экскавации ДЗН на 45–65% примерно у 8% пациентов с ОУГ, особенно в сочетании с миопией [19]. Налицо высокая подвижность ДЗН, что требует незамедлительных действий врача. Итак, второе ключевое звено в патогенезе глаукомы — это статическая и динамическая подвижность ДЗН.
Целью снижения уровня ВГД должно быть восстановление физиологических функций глаза в системе притока/оттока водянистой влаги для поддержания процессов метаболизма, а нижний уровень целевого давления в принципе не должен приводить к гипотонии. Однако надежные достоверные критерии для объективного расчета индивидуального целевого давления на сегодняшний день так и не разработаны. И вообще, критерий «уровень ВГД» в принципе не позволяет грамотно решить задачу выбора целевого давления [3, 6]. В результате ряд клинических рекомендаций в разных странах предписывает при ОУГ любых стадий значимо снижать текущий индивидуальный уровень ВГД сразу на 30% и более, без учета других первоочередных физиологических характеристик данного глаза, и в первую очередь — его принадлежности к определенной зоне ригидности ФОГ, т. е. к зоне низкого ВГД (до 13 мм рт. ст.); зоне среднего ВГД (14–20 мм рт. ст.); зоне повышенного ВГД (21–26 мм рт. ст); зоне высокого ВГД (27–32 мм рт. ст.); зоне субкомпенсации ВГД (33–39 мм рт. ст.) и зоне некомпенсации ВГД (≥40 мм рт. ст.) [6, 21].
Теперь, после своеобразного введения в проблему ОУГ, возможно, будут более понятны наши замечания, касающиеся достоверности научных результатов в рассматриваемой статье. Ведь на разборе ошибок мы все учимся! Пойдем по порядку изложения текста.
В цели исследования авторы указывают, что они хотели измерять акустическую плотность (авторы считают, что это якобы позволяет сделать показатель эластичности роговицы) и жесткость (ригидность) здорового и глаукомного глаза. Показатель эластичности (в медицине это величина, обратная ригидности: El = 1 / Ri), как правило, определяется через прямое или косвенное измерение ригидности Ri. Причем авторы явно не понимают того, что, например, любое смещение несжимаемой водянистой влаги из-под роговицы внутрь глаза неминуемо и мгновенно приведет к ответному расширению ФОГ и растягиванию ее возвратно-эластических структур (в результате такого воздействия эти «биологические пружины» будут растянуты). Поэтому само по себе измерение параметров роговицы без учета параметров склеры, да еще и при ограниченном (не бесконечном) объеме глаза, является серьезной системной ошибкой, поскольку нарушает основные законы механики. И таких, безусловно, ошибочных статей в мире — сотни! Кроме того, судя по всему, авторы путают эластичность (как параметр, обратный ригидности) со способностью склеры (не роговицы!) к обратимому упругому растяжению (аналог — пружина с запаздыванием). В механике это иногда определяется термином «податливость». Хороший пример — наружная пружина с доводчиком на двери, обеспечивающая ее медленное, постепенное закрытие в конце процесса. Именно так работают эластические структуры глаза: фаза быстрого «начала закрытия двери» — это работа высокоригидного наружного слоя склеры, не имеющего вязко-эластических структур, а фаза медленного «дозакрытия двери» — это уже продолжительная работа эластических структур в двух внутренних слоях склеры по выдавливанию водянистой влаги обратно под роговицу в конце, например, пневмовоздействия (или, как у авторов статьи, пьезоэлектрического воздействия со стороны акустического излучателя, установленного на склере или роговице).
Наши исследования показали, что склера (как и стенка кровеносного сосуда) состоит из трех функциональных слоев, когда в наружном тонком слое склеры практически отсутствуют эластические волокна. То есть наружный слой склеры (кстати, самый ригидный!) ведет себя при «растяжении — сжатии» как упругая биологическая пружина, но не как полностью эластичная структура «с запаздыванием». Фактически это «силовая скорлупа глаза», которая позволяет выдерживать даже значительные ударные нагрузки, однако диапазон возможного «растяжения — сжатия» наружного слоя ФОГ в норме даже в молодом возрасте довольно ограничен.
Важное биомеханическое отличие склеры от роговицы заключается в том, что склера способна функционально мгновенно растягиваться в моменты прохождения в глазу пульсовой волны и затем возвращаться в исходное состояние «с запаздыванием» за счет работы своих вязко-эластических структур. Однако, как мы все хорошо знаем, геометрические параметры роговицы при прохождении пульсовой волны в систолу-диастолу практически не изменяются. Отсутствие в роговице вязко-эластических структур позволяет ей сохранять свои анатомические размеры и оптические свойства практически постоянными, быть прозрачной и сравнительно жесткой, малорастяжимой биологической рассеивающей линзой, что необходимо для обеспечения качественного зрения и, в конце концов, для выживания вида [10].
Средний и внутренний слои склеры, наоборот, буквально пронизаны фибробластами и другими эластическими структурами и волокнами, которые собраны в пластины. Эти слои пластин ведут себя как биологическая пружина «с эффективным запаздыванием», что при их сокращении позволяет эффективно, но не мгновенно, а именно постепенно выталкивать наружу (дренировать) водянистую влагу, а также демпфировать пульсовую волну, возникающую из-за изменения объема кровеносных сосудов в глазу во время систолы-диастолы [10, 21].
При ВОГ общий функциональный диапазон «дыхания склеры» в норме незначительно снижается, а при ОУГ далеко зашедших стадий катастрофически падает. Стоит отметить, что в офтальмологии до недавнего времени не было общепринятого точного термина, который бы адекватно описывал процесс работы эластических структур ФОГ. Поэтому нам пришлось тщательно разобраться с этим и ввести такой адекватный, с нашей точки зрения, термин, как «флуктуация». Как уже было сказано выше, это новое понятие в офтальмологии, которое подробно рассмотрено в нашем авторском разделе 5.10 «Ретроспективный взгляд на роль соединительной ткани в патогенезе глаукомы» главы «Патогенез ОУГ» в новом издании «Национального руководства по ОУГ» (2023) [21], а также в наших публикациях [3, 6, 22].
Физиологически роговица — это сравнительно жесткая биологическая линза, которая должна сохранять свои анатомические размеры и оптические свойства постоянными даже в моменты скачкообразного изменения ВГД, например, во время пульсовой волны в глазах с развитой ОУГ. Это необходимо для сохранения полноценного зрения, особенно в моменты опасности. И пока морфологи не обнаружили в роговице эластические (пружинные по сути) структуры [9, 10].
Поэтому уровень отражения акустических волн воздействия в роговице будет максимальным по сравнению со здоровой склерой с развитыми эластическими структурами. Фактически роговица обладает слабой способностью демпфировать (рассеивать) механические колебания. И для этого не нужно, как это сделали авторы рассматриваемой статьи, проводить клинические исследования, которые в очередной раз подтвердят правильность законов природы. Но законы природы надо не подтверждать, а постоянно использовать в клинике!
А вот ригидность (жесткость) глаукомного глаза будет существенно возрастать от стадии к стадии, и потому будет возрастать и акустическая плотность склеры и при этом снижаться ее способность к демпфированию акустических воздействий. То есть способность склеры гасить с помощью своих развитых эластических структур отраженные от нее акустические волны будет снижаться по мере прогрессирования ОУГ. И если понимать биомеханическую сущность этого явления, то клинические эксперименты для подтверждения таких законов природы также не нужны. Нужно только знать законы природы.
Стоит отметить, что способ акустического воздействия на глаз уже практически широко используется в Dynamic contour tonometer Pascal (DCT) в попытке пересчитать отражающую акустическую способность ФОГ в ВГД. Мы уже писали об опасности такого «вибрационного» воздействия на глаз с частотой около 100 Гц при склонности к отслойке сетчатки в случае совпадения частоты внешнего акустического воздействия с резонансными обертонами склеральной оболочки [23, 24]. Но здесь важно понимать то, что DCT не может надежно измерять уровень ВГД ниже 12 мм рт. ст. из-за сравнительно низкого уровня отраженного от склеры сигнала. То есть способ акустического воздействия на глаз работоспособен только на тех глазах, в которых имеется уже выраженный и заметный скачок ригидности ФОГ (фактически это глаза со сравнительно жесткой наружной стенкой, т. е. с уже заметно ригидной склерой).
Глаза с низким уровнем ВГД исходно имеют относительно низкий уровень ригидности и высокий уровень флуктуации из-за хорошей работоспособности эластических структур склеры, которые эффективно демпфируют уровень отраженного акустического сигнала. Поэтому диагностические возможности способа акустического воздействия на капсулу здорового глаза первоначально имеют объективные ограничения из-за сравнительно высокого затухания отраженного сигнала в эластических структурах склеры. И это совсем не учитывали авторы рассматриваемой статьи.
С другой стороны, авторы статьи констатируют, что группы пациентов подбирали по возрасту, что, безусловно, правильно. Однако выполненный авторами подбор пациентов по одинаковому уровню ВГД принципиально неверен. И вот почему.
К сожалению, частота приоритетного использования неполноценного критерия «ВГД» в диагностике ОУГ в мировой офтальмологии чрезвычайно высока. Мы об этом много писали [7, 24], но авторы рассматриваемой статьи, видимо, не предполагают, что все глаза делятся (А.П. Нестеров, 1998) на три зоны нормы ВГД: зону низкой нормы (9–12 мм рт. ст.), зону средней нормы (13–16 мм рт. ст.) и зону высокой нормы (17–22 мм рт. ст.) [25], аналогично распределению пациентов по артериальному давлению на гипотоников, нормотоников и гипертоников. Мы уже научились объективно определять на пневматическом анализаторе ORA зону нормы ВГД в молодости даже у пожилого пациента, т. е. определять анормальность его текущего ВГД [6]. Кстати, это можно также просто выполнить по нашей методике с помощью пневмоанализатора Corvis ST [6].
Кроме того, авторы статьи включили в группу с одинаковым уровнем ВГД глаза даже тех пациентов с ОУГ, которые находились на длительной гипотензивной терапии. Это неверно в принципе, поскольку не позволяет объективно определить истинную текущую ригидность ФОГ с ОУГ. Поясним это. Авторы пытаются сравнивать здоровые глаза с разной интенсивностью развития ВОГ с глаукомными глазами, когда у тех и других не выяснена их принадлежность к индивидуальной зоне нормы ВГД. А если этого нет, то глаза с низкой зоной нормы ВГД, но с развитой стадией ОУГ (т. е. уже с более высокой ригидностью ФОГ) могут иметь одинаковый уровень ВГД с глазами с ВОГ из зоны высокой нормы ВГД. Но и это еще не все.
На фоне медикаментозной терапии индивидуальный объем ФОГ при разной стадии ОУГ всегда уменьшен и, как правило, на неизвестную нам величину (биомеханика этого процесса нами многократно описана). Поэтому гипотензивная терапия приводит к снижению наружного обжимающего усилия со стороны ФОГ и к ответному снижению уровня ВГД. Поясним это.
Часто после усиления гипотензивной терапии в глазах с ОУГ это новое состояние глаза (при меньшем его объеме) некорректно толкуется многими офтальмологами как медикаментозное снижение ригидности склеры. Да, естественно, ригидность склеры будет при этом частично снижена (пружина менее растянута), но эта новая «рукотворная» ригидность является величиной, которая может быть существенно ниже истинной патологической ригидности склеры на данный момент. И это, кстати, совсем не понимают авторы рассматриваемой статьи. То есть достоверно и объективно отследить прогрессирование глаукомного процесса по такой методике невозможно. Поэтому в рамках доказательной медицины необходимо определять истинный уровень текущей ригидности склеры в глаукомных глазах при непродолжительной отмене медикаментозной терапии. Это необходимо для того, чтобы реально и постоянно контролировать скорость старения ФОГ, которая в первую очередь и определяет прогрессирование глаукомного процесса [6, 21–24].
Приведем другой конкретный пример. При искусственном уменьшении объема глаза с ОУГ примерно на 0,083 мл после установки интраокулярной линзы без осложнений наблюдается заметное снижение уровня ВГД от месяца до полугода, которое потом приходит к дооперационным значением. Что при этом происходит? ФОГ сократила свою поверхность, стала менее растянутой и теперь с меньшим усилием обжимает структуры глаза (пружина менее растянута). В ответ закономерно, но временно снижается и уровень ВГД.
И если говорить объективно, то авторы рассматриваемой статьи, к сожалению, не понимая этого, включили в исследуемую группу глаза, в которых исходно текущая ригидность ФОГ мало различалась, поскольку все глаза имели примерно равный уровень ВГД. И это произошло потому, что авторы явно не знакомы с биомеханикой глаза. Ведь еще в 1974 г. А.П. Нестеров и соавт. в их классической монографии подчеркивали, что «непосредственное влияние на ВГД оказывают только ригидность склеры и объем глаза»: P0 = f (Ri, V), где Р0 — величина истинного ВГД, Ri — ригидность ФОГ, а V — текущий объем глаза [26]. У А.П. Нестерова и соавт. уровень ВГД определяется именно уровнем ригидности ФОГ, а не ригидность ФОГ определяется уровнем ВГД. То есть какова ригидность ФОГ, таково и ВГД, а не наоборот [6, 22].
Из всего сказанного следует, что корректно исследовать уровни ригидности и ВГД в глазах с ВОГ и с ОУГ необходимо только при кратковременной отмене гипотензивных препаратов, причем необходимо подбирать для сравнения группы пациентов не только одного возраста, но и с одинаковой зоной нормы ВГД в молодости. Авторы статьи не сделали этого «на входе», потому и получили «на выходе» столь плачевный результат, когда некорректная постановка задачи, неадекватный выбор групп пациентов, а также методические и теоретические ошибки в постановке экспериментов и в оценке полученных данных привели к таким некорректным выводам.
Разберем более подробно ошибки авторов в постановке экспериментов. Стоит сразу сказать, что любой косвенный способ тонометрии сначала фактически определяет текущую ригидность ФОГ, а потом ригидность пересчитывают в давление с помощью часто некорректных, но общепринятых зависимостей в виде специальных линеек или таблиц. При этом ригидность глаза считают мало изменчивой величиной (не более чем на 26%) и постоянной как для здоровых глаз, так и глаукомных [26]. Некая постоянная «средняя ригидность по больнице». Но, как показали наши исследования [6, 22, 24] и исследования других авторов [27, 28], ригидность может увеличиваться на 200–300%. И сразу встает вопрос с точки зрения доказательной медицины, поскольку с помощью такого грубого способа расчетного измерения уровня ВГД невозможно поставить полноценный диагноз без учета текущего уровня ригидности ФОГ и значения давления в молодости.
Авторы статьи в части оценки ригидности приводят общепринятое уравнение Friedenwald (1937) [29], в котором ригидность (т. е. жесткость) глаза Ri определяется в экзотических для любого грамотного механика единицах [мм-3] (!) по уравнению:
![]()
Этим «уравнением» J.S. Friedenwald описал ту эмпирическую кривую, которую он получил по результатам достаточно спорного эксперимента. И это логарифмическое уравнение в принципе не соответствует законам механики.
А вот уравнение немецкого офтальмолога P. Römer (1913) [30], наоборот, полностью соответствует законам механики, и в нем ригидность у наполненной водой эластичной оболочки определяется как жесткость в общемировых системных единицах Pa/m3 (в паскалях на кубический метр) по классической формуле:
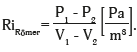
Однако в офтальмологии прижилась именно некорректная формула J.S. Friedenwald, приводящая к существенным ошибкам при пересчете ригидности в давление, а также часто к ошибочным представлениям о том, что такое по своей сути объемная ригидность ФОГ.
Сегодня мы удивляемся исключительной прозорливости P. Römer, который более века назад фактически назвал главное звено в глаукомном процессе: «…Первичные изменения при глаукоме и необходимые условия для ее клинических явлений необходимо искать… в сумке глазного яблока…. Изменение сумки глазного яблока, которое до сих пор слишком мало принималось во внимание, является первичным симптомом заболевания и вызывает, прежде всего, расположение к глаукоме. Только потому изменение склеры мало принималось во внимание, что оно чрезвычайно мало обнаруживается клинически и анатомически… И только если считать глаукому болезнью самодовлеющей, которая, может быть, зависит от перерождения сумки глазного яблока, если рассматривать повышение внутриглазного давления как усиленное выделение жидкости, а закладывание камерного угла как вторичное явление, то становится понятным, что при помощи наших терапевтических мероприятий мы можем воздействовать на механические факторы обмена жидкостей, но довольно часто не можем излечить болезнь как таковую» [30].
Но как же обстоят дела с ригидностью в глазах с разной рефракцией, т. е. в обычных глазах гиперметропов, эмметропов и миопов? Добротное исследование модуля Юнга на выделенных полосках склеры у подростков с миопией привело автора к некорректному выводу о низкой ригидности ФОГ в миопических глазах и, аналогично, к высокой ригидности глаз у детей с начальной гиперметропией [31]. К похожему выводу для миопических глаз пришли и авторы рассматриваемой статьи.
Заметим, что человек, высокоразвитые обезьяны и многие другие виды животных практически поголовно рождаются гиперметропами, т. е. с глазами, у которых короткая передне-задняя ось (ПЗО). И это позволяет каждому виду при необходимости адаптировать длину ПЗО (буквально направленно удлинять) к жизненным условиям зрительной среды. Из этих идей родилась наша метаболическая теория адаптационной миопии, которая оказалась полностью работоспособной, позволяет надежно предсказывать результат индивидуального применения рациональной оптической коррекции и за 10 лет успешно апробирована на нескольких тысячах пациентов [32–34].
Однако миопический глаз имеет наибольшую длину ПЗО по сравнению с детскими глазами гиперметропов и эмметропов. То есть ФОГ миопического глаза самая растянутая, и поэтому ригидность ФОГ у миопического глаза должна быть самой высокой, а у детского нерастянутого гиперметропического глаза — самой низкой. Аналогичный процесс скачка ригидности и ответного скачка ВГД происходит в глазу, когда мы растягиваем оболочку глаза во время вакуумного воздействия на глаз (вакуум-периметрическая проба Волкова — Сухининой) или воздействуем на поверхностный слой ФОГ локально с помощью вакуумного колпачка-присоски.
Но мы все-таки провели и клинические исследования на нескольких сотнях глаз с разной рефракцией, которые подтвердили, что ригидность ФОГ постепенно возрастает при переходе от начальной гиперметропии к эмметропии и к миопии [14]. И это соответствует законам механики. Эти результаты также показали, что в принципе некорректно определять объемную ригидность ФОГ (т. е. ригидность всей оболочки in vivo в целом) на разрывной машине по модулю Юнга на выделенных полосках роговицы или склеры. На этом также споткнулись и авторы статьи.
Теперь рассмотрим достоверность предложенной авторами методики определения ригидности ФОГ с помощью двукратного пневмовоздействия: сначала без предварительно установленного груза 10 г и после его установки. Это фактически использование идеи традиционного способа тонографии при сравнительно продолжительной установке на роговицу глаза грузов разного веса. Как ни прискорбно, но с позиций сегодняшнего углубленного биомеханического понимания физиологических функций ФОГ такие способы в принципе ошибочны. И вот почему.
Фактически все способы тонометрии делятся на закрытые, когда объем глаза во время измерения не меняется, и открытые, когда этот объем глаза во время измерения уменьшается. К закрытым способам относится динамическая пневмотонометрия и кратковременная ударная тонометрия через веко, когда время измерения составляет 20–30 мс и объем глаза не меняется. Именно поэтому закрытые способы тонометрии имеют самую высокую точность, когда относительная погрешность измерений обычно не превышает 5%. И это, безусловно, самые современные достоверные способы тонометрии в рамках доказательной медицины.
«Открытые способы» тонометрии из-за изменения объема глаза во время измерения имеют серьезные погрешности измерений, которые доходят до 15–25% не только в момент самого измерения, но и из-за того, что потом эта погрешность еще заметно увеличивается из-за использования некорректного уравнения J.S. Friedenwald при пересчете ригидности в ВГД.
Установка любого груза на роговицу на время более 0,5 с, безусловно, приведет к выдавливанию из глаза за это время какой-то малой части внутриглазной жидкости, причем ее объем будет тем больше, чем выше исходная текущая ригидность ФОГ.
Заметим, что авторы статьи подчеркнули, что они проводили измерения с дополнительным предварительно установленным грузом в 10 г на каждом глазу 5 раз подряд! Между тем любой тонометрист с многолетним практическим опытом прекрасно знает, что второе измерение ВГД под действием груза следует проводить не ранее, чем через 15–20 мин после первого, когда глаз успевает восстановить свой первоначальный объем. Если проводить повторные измерения ВГД практически без заметных перерывов, то с каждым измерением объем глаза будет дополнительно уменьшаться на неизвестную величину. То есть все недостатки измерения ВГД в состоянии «открытой гидравлической системы» с каждым таким повторным измерением только усугубляются. Например, транспальпебральный тонометр Пилецкого выпуска Рязанского приборного завода в модификации ИГД — 01 и 02 diathera измеряет среднее ВГД после 2–5 одновременных последовательных воздействий штока на роговицу со всеми вытекающими из этого методическими погрешностями измерений. Правда, последняя модификация тонометра ИГД — 03 diathera уже позволяет проводить только однократное измерение ВГД через веко, что, безусловно, существенно повышает точность измерения.
Поэтому вся серия таких некорректных экспериментов — с измерениями 5 раз подряд — и привела авторов к научному провалу. Фактически они сначала «выдавили из глаза» существенный объем водянистой влаги и получили «на выходе» ложный результат — пониженную ригидность ФОГ в глаукомных глазах.
И теперь стоит отдельно сказать о заблуждении многих специалистов во всем мире о влиянии толщины роговицы на уровень ВГД. Авторы рассматриваемой статьи традиционно оказались в плену этого мифа и также попытались учесть в своем исследовании толщину роговицы. Считается, что чем больше толщина роговицы, тем больше ее влияние на точность измерений ВГД. Это миф. Во всех многочисленных попытках найти такую связь сравниваются результаты измерения центральной толщины роговицы с результатами измерения ВГД открытыми или закрытыми способами тонометрии. Данные обоих способов одновременного измерения разных параметров (толщины роговицы и давления) можно сравнивать только с учетом погрешности измерений каждым из них, причем при обязательном равенстве ригидности и флуктуации в исследуемых глазах. Это закон метрологии и вообще грамотных исследований физиологии человека.
Когда же в исследовании изучают совершенно разные глаза, например, с разной ригидностью и с разным ПЗО и др., а точность измерений не учитывается, то это уже трудно отнести к научным исследованиям. И это боль всей мировой офтальмологии. Мы о «роговичном мифе» также писали, но сейчас хотим напомнить читателям, что классическое исследование N. Feltgen et al. [1] показало: точность определения тонометрического ВГД разными способами от толщины роговицы не зависит. При этом уровень истинного ВГД эти исследователи грамотно контролировали через иглу в передней камере глаза. И этот результат полностью соответствует законам механики, поскольку любое силовое воздействие на роговицу сможет сместить внутрь глаза только тот объем внутриглазной жидкости, который позволит сделать податливость склеры. То есть говорить о влиянии толщины роговицы на точность измерения ВГД без учета текущей ригидности склеры и погрешностей их измерений некорректно.
Авторы статьи также полагают, что снижение уровня ВГД сегодня является единственным методом лечения ОУГ. Сегодня приходится в этом сильно сомневаться. Уже стало совершенно очевидно, что патогенетически наиболее обоснованный путь борьбы с ОУГ — это разработка способов снижения ригидности склеры и восстановление ее флуктуации (физиологических функций) для нормализации метаболизма внутриглазных структур, а также уменьшение склонности ДЗН к экскавации (снижение его податливости). Оба этих пути могут быть задействованы одновременно.
В 2005 г. был предложен биомеханиками и успешно апробирован в клинике МОНИКИ под общим руководством профессора А.А. Рябцевой метод снижения ригидности склеры посредством лазерной непроникающей склерэктомии поверхностного, самого жесткого слоя склеры [35, 36]. Но, безусловно, для критических случаев необходимо создать медицинские технологии по уменьшению динамической склонности ДЗН к экскавации [37]. Один из таких эффективных способов предложили еще в 1996 г. биоинженеры [38]. Это способ закачивания инертного биополимера в структуры ДЗН, когда способность ДЗН противостоять экскавации значительно возрастает.
Последнее, что хочется сказать по поводу рассматриваемой статьи, — «наукообразное» определение авторами «среднего возраста пациентов по больнице». Эта явная ошибка вытекает из-за непонимания процессов старения при ОУГ. Поскольку процессы старения при ВОГ и ОУГ напрямую связаны с периодами жизни человека, группы пациентов должны сравниваться только внутри возрастных интервалов жизни, предложенных Всемирной организацией здравоохранения. Кроме того, достоверные исследования взаимосвязи ВОГ и ОУГ необходимо проводить только в соответствующих диапазонах нормы ВГД по А.П. Нестерову [25] или в недавно выявленных впервые в мировой практике шести зонах уровня ВГД, адекватных ригидности глаза [6, 21].
В заключение мы пожелаем удачи авторам рассматриваемой статьи в получении следующего гранта для продолжения их исследований, в которых они, возможно, смогут учесть хотя бы часть наших благожелательных замечаний по существу.
Сведения об авторах:
Кошиц Иван Николаевич — инженер-механик, биомеханик, генеральный директор ООО «Питерком-Сети / МС Консультационная группа»; 194223, Россия, г. Санкт-Петербург, ул. Курчатова, д. 1; ORCID iD 0000-0002-7920-9469.
Светлова Ольга Валентиновна — д.м.н., доцент, профессор кафедры офтальмологии с клиникой им. профессора Ю.С. Астахова ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; профессор кафедры офтальмологии ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0001-7777-1901.
Рябцева Алла Алексеевна — д.м.н., профессор, заслуженный врач Российской Федерации, главный внештатный специалист-офтальмолог Центрального федерального округа РФ, профессор кафедры глазных болезней ФГБНУ «Национальный НИИ общественного здоровья имени Н.А. Семашко»; 105064, Россия, г. Москва, ул. Воронцово Поле, д. 12, стр. 1; ORCID iD 0000-0002-1104-4047.
Гусева Марина Геннадьевна — врач-офтальмолог высшей квалификационной категории лечебно-диагностического центра медико-санитарной части ГУП «Водоканал Санкт-Петербурга»; 196084, Россия, г. Санкт-Петербург, Московский пр., д. 103, корп. 2; ORCID iD 0009-0007-5808-1340.
Эгембердиев Максат Базаркулович — к.м.н., заслуженный врач Республики Кыргызстан, заведующий глазным отделением Чуйской областной объединенной больницы; 720051, Республика Кыргызстан, г. Бишкек, ул. Саратовская, д. 10/3; ORCID iD 0009-0007-8333-6149.
Бакшинский Петр Петрович — д.м.н., заведующий отделением офтальмологии ГБУЗ МО «ВРКБ»; 142700, Россия, г. Видное, ул. Заводская, д. 15; ORCID iD 0009-0005-1982-2279.
Засеева Марина Васильевна — к.м.н., старший лаборант кафедры скорой медицинской помощи и хирургии повреждений ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0009-0005-3279-0099.
Контактная информация: Кошиц Иван Николаевич, e-mail: petercomink@bk.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 21.08.2022.
Поступила после рецензирования 13.09.2022.
Принята в печать 06.10.2022.
About the authors:
Ivan N. Koshits — mechanical engineer, biomechanist, General Director of LLC “Pitercom-Networks/MS Consulting Group”; 1, Kurchatov str., St. Petersburg, 194223, Russian Federation, ORCID iD 0000-0002-7920-9469.
Olga V. Svetlova — Dr. Sc. (Med.), Associate Professor, professor of the Professor Yu.S. Astakhov Department of Ophthalmology with the Clinic, I.P. Pavlov First Saint-Petersburg State Medical University; 6-8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; professor of the Department of Ophthalmology, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0001-7777-1901.
Alla A. Ryabtseva — Dr. Sc. (Med.), Professor, Honored Doctor of the Russian Federation, chief freelance ophthalmologist of the Central Federal District of Russian Federation, professor of the Department of Eye Diseases, N.A. Semashko National Research Institute of Public Health; 12-1, Vorontsovo Pole str., Moscow, 105064, Russian Federation; ORCID iD 0000-0002-1104-4047.
Marina G. Guseva — ophthalmologist, Medical and Diagnostic Center of the Primary Healthcare Unit of the Vodokanal of St. Petersburg; 103 bldg. 2, Moskovsky av., St. Petersburg, 196084, Russian Federation; ORCID iD 0009-0007-5808-1340.
Maksat B. Egemberdiev — C. Sc. (Med.), Honored Doctor of the Republic of Kyrgyzstan, Head of the Eye Department of the Chui Regional United Hospital; 10/3, Saratovskaya str., Bishkek, 720051, Republic of Kyrgyzstan; ORCID iD 0009-0007-8333-6149.
Petr P. Bakshinsky — Dr. Sc. (Med.), Head of the Department of Ophthalmology, Vidnoe District Clinical Hospital; 15, Zavodskaya str., Vidnoye, 142700, Russian Federation; ORCID iD 0009-0005-1982-2279.
Marina V. Zaseeva — C. Sc. (Med.), senior laboratory assistant of the Department of Emergency Medical Care and Surgery of Injuries, I.P. Pavlov First Saint-Petersburg State Medical University; 6-8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0009-0005-3279-0099.
Contact information: Koshits Ivan Nikolaevich, e-mail: petercomink@bk.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 21.08.2022.
Revised 13.09.2022.
Accepted 06.10.2022.
Информация с rmj.ru
