Содержание статьи
Значение висмута трикалия дицитрата в лечении эрозий верхнего отдела желудочно-кишечногог тракта у больных на этапе подготовки к операции
Е. А. Сорокина*, кандидат медицинских наук
Н. А. Морова**, доктор медицинских наук, профессор
А. А. Фокин***, доктор медицинских наук, профессор
В. В. Сафечук*
В. А. Ахмедов**, доктор медицинских наук, профессор
М. В. Мильченко*, кандидат медицинских наук
А. В. Малков*, кандидат медицинских наук
* БУЗ ОО ОКБ, ** ГБОУ ВПО ОмГМА МЗ РФ, Омск
*** ГБОУ ВПО ЧелГМА МЗ РФ, Челябинск
В соответствии с рекомендациями стран Европейского союза (I–IV Маастрихтские соглашения, 1996–2010 гг.) язвенная болезнь желудка и двенадцатиперстной кишки независимо от фазы заболевания (обострение или ремиссия) является абсолютным показанием для проведения эрадикационной терапии (ЭТ) Helicobacter pylori (H. pylori) [1]. В основе лечения используются схемы, способные в контролируемых исследованиях уничтожить бактерию H. pylori, как минимум, в 80% случаев [2]. В соответствии с вышеназванными международными рекомендациями, пациентам назначаются семидневные или четырнадцатидневные схемы лечения, предусматривающие применение ингибитора протонной помпы, амоксициллина и кларитромицина, в качестве терапии 1-й линии [3]. В качестве терапии 2-й линии традиционно используются схемы, включающие применение, кроме ингибитора протонной помпы, соли висмута, тетрациклина, фуразолидона (в ряде стран с низкой резистентностью к бензимидазолам — метронидазола) [4].
Российские стандарты диагностики и лечения кислотозависимых и ассоциированных с H. pylori заболеваний (рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции H. pylori у взрослых, Четвертое московское соглашение) [5, 6] включают наряду с классическими несколько вариантов схем эрадикации 1-й линии (замена кларитромицина на джозамицин или нифурател; добавление четвертым препаратом висмута трикалия дицитрата или замена на него ингибитора протонной помпы), а также схемы терапии 2-й линии (варианты замены тетрациклина и фуразолидона на амоксициллин или рифаксимин). Согласно национальным клиническим рекомендациям [6], добавление к стандартной тройной терапии (ингибитор протонной помпы (ИПП) в стандартной дозе 2 раза в сутки + кларитромицин 500 мг 2 раза в сутки + амоксициллин 1000 мг 2 раза в сутки) висмута трикалия дицитрат 240 мг 2 раза в день является мерой, позволяющей увеличить эффективность стандартной тройной терапии [6].
Важным аспектом лечения кардиохирургических больных, имеющих эрозивно-язвенные изменения гастродуоденальной зоны, является срок эпителизации эрозий и язв, поскольку длительная подготовка к операции на сердце, особенно в условиях стационара, является дорогостоящей. Кроме того, в некоторых случаях существует возможность прогрессирования коронарной недостаточности с развитием острых форм ишемической болезни сердца, развитие которых негативно влияет на прогноз для жизни.
В связи с изложенным мы изучили возможность применения препаратов висмута, обладающих антихеликобактерным и цитопротективным действием для сокращения времени эпителизации гастродуоденальных эрозий (пациенты с наличием язв не включались в этот этап исследования ввиду большой вариабельности размеров и глубины деструкции слизистой оболочки).
Целью настоящего исследования было оценить возможность влияния препаратов висмута на сроки эпителизации гастродуоденальных эрозий у кардиохирургических больных, получающих ИПП и ЭТ 1-й линии, а также фармакоэкономическую эффективность предложенной схемы лечения у исследуемой категории пациентов.
Материалы исследования
В исследование включен 51 пациент (37 мужчин и 14 женщин) в возрасте от 39 до 71 лет (средний возраст 54,6 ± 9,3 года (M ± σ)) с эрозиями желудка или двенадцатиперстной кишки, которые находились в стационаре ввиду предстоящего кардиохирургического вмешательства с использованием искусственного кровообращения. Больные были разделены на две группы.
Пациенты первой группы (31 человек) получали ИПП омепразол (Омез) в дозе 20 мг 2 раза в сутки) и, при наличии показаний, семидневную тройную ЭТ первой линии (ИПП ± ЭТ). Эрадикация H. pylori была назначена 17 пациентам, у которых данная бактерия была выявлена с помощью быстрого уреазного теста и морфологического исследования с окраской по Романовскому–Гимзе.
Пациенты второй группы (20 человек) получали ИПП (Омез в дозе 20 мг 2 раза в сутки), висмута трикалия дицитрат (В) (Де-Нол в дозе 120 мг 4 раза в сутки) и, при наличии показаний, семидневную ЭТ первой линии (ИПП + В ± ЭТ). Антихеликобактерная терапия была проведена 11 пациентам с верифицированной инфекцией H. pylori.
В схеме эрадикации пациентам обеих групп назначались амоксициллин (Флемоксин Солютаб по 500 мг 4 раза в сутки) и кларитромицин (Фромилид 500 мг 2 раза в сутки).
На 10-й и 14-й день от начала терапии проводилась эзофагогастродуоденоскопия, и в двух выделенных группах сравнивалась частота эпителизации эрозий.
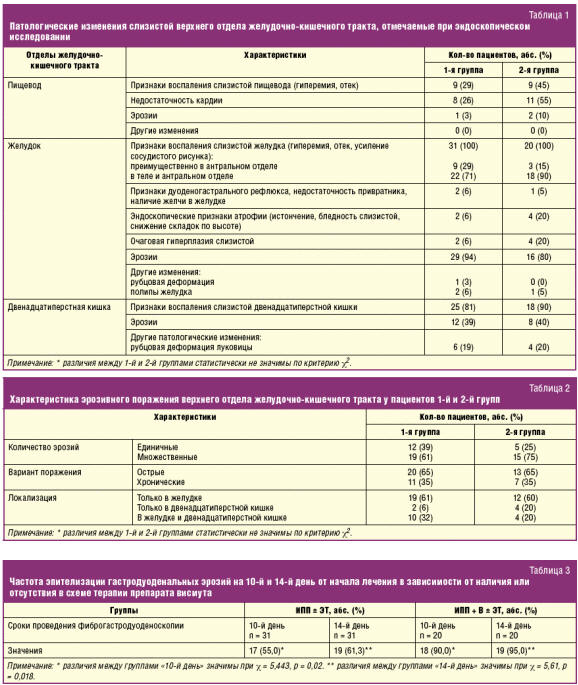
Данные, характеризующие особенности слизистой оболочки гастродуоденальной зоны, полученные при эзофагогастродуоденоскопии, представлены в табл. 1 и 2. При этом достоверных различий между группами отмечено не было.
Результаты исследования
Динамическое обследование пациентов на фоне лечения позволило установить, что во 2-й группе при контрольной эзофагогастродуоденоскопии эпителизация эрозий происходила в более ранние сроки и в большем числе клинических наблюдений. Полученные данные представлены в табл. 3, проиллюстрированы диаграммой на рис.
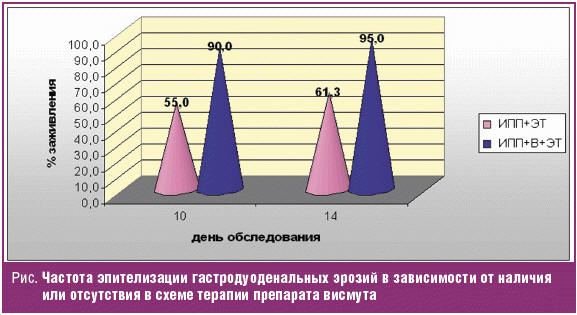
Таким образом, представленные результаты демонстрируют клиническую эффективность использования висмута трикалия дицитрата у кардиохирургических пациентов, выражающуюся в более высокой частоте эпителизации эрозий при применении данного препарата, через 10 дней на 35% и через 14 дней на 33,7%. Это позволяет сократить сроки проведения контрольной эзофагогастродуоденоскопии на 4 дня у 90% больных. Добавление препарата висмута к ЭТ первой линии, включающей ИПП, кларитромицин и амоксициллин, согласуется с Российскими стандартами диагностики и лечения кислотозависимых и ассоциированных с H. pylori заболеваний [5, 6].
Экономическая эффективность применения висмута трикалия дицитрата определялась как отношение затрат на лечение за период времени до проведения контрольной эзофагогастродуоденоскопии к эффективности терапии в расчете на одного пациента [7].
Кeff = Cost/Eff,
где Кeff — коэффициент затратной эффективности, Cost — затраты, Eff — эффективность проводимых профилактических мероприятий.
Затраты для каждой группы включали сумму стоимости лекарственных препаратов и проведения первого контрольного эндоскопического исследования, т. е. непосредственно прямые затраты. Стоимость препаратов, которая учитывалась в затратах, была получена из источника сети Internet http://www.med.sgg.ru, где изложены данные об оптовых ценах (со склада в г. Москве) на все фармацевтические препараты, разрешенные к применению на территории Российской Федерации (данные от 10.06.2012 г.):
- Омез («Д-р Реддис Лабораториз») — 30 капсул по 20 мг — 161,68 руб. (стоимость лечения в день одного пациента при двукратном приеме по 20 мг 10,76 руб.);
- Де-Нол («Астеллас») — 112 таблеток (120 мг) — 975,0 руб. (стоимость лечения в день одного пациента при четырехкратном приеме по 120 мг 45,58 руб.).
При этом затраты на ЭТ не учитывались в исследовании, поскольку были сопоставимы во всех группах.
Стоимость диагностической эзофагогастродуоденоскопии по калькуляции Бюджетного учреждения здравоохранения Омской области «Областная клиническая больница» (2012 г.) составляла 800 руб.
Вычисление коэффициентов затратной эффективности в группах позволило получить следующие данные:
- ИПП ± ЭТ (10 дней): Кeff = Cost/Eff = (стоимость Омеза 40 мг в сутки × 10 дней + стоимость ФГДС)/0,55 = (10,76 х 10 + 800)/0,55 = 1650.
- ИПП ± ЭТ (14 дней): Кeff = Cost/Eff = (стоимость Омеза 40 мг в сутки × 14 дней + стоимость ФГДС)/0,613 = (10,76 х 14 + 800)/0,613 = 1631.
- ИПП + В ± ЭТ (10 дней): Кeff = Cost/Eff = (стоимость Омеза 40 мг в сутки и Де-Нола 480 мг в сутки × 10 дней + стоимость проведения фиброгастродуоденоскопии)/0,90 = ((10,76+45,58) х 10 + 800)/0,90 = 1395.
- ИПП + В ± ЭТ (14 дней): Кeff = Cost/Eff = (стоимость Омеза 40 мг в сутки и Де-Нола 480 мг в сутки × 14 дней + стоимость ФГДС)/0,95 = ((10,76+45,58) × 14 + 800)/0,95 = 1514.
Представленные данные показывают, что наименьшая затратная эффективность получена при проведении контрольного эндоскопического исследования на 10-й день лечения у больных, получающих в составе комплексной терапии препарат висмута. При этом у пациентов, получающих лечение без препарата висмута, экономически более выгодным было проведение эзофагогастродуоденоскопии на 14-й день лечения.
В своих предыдущих исследованиях мы рассматривали целесообразность применения висмута трикалия дицитрата в послеоперационном периоде [8]. Особенностью назначения препарата является появление темного стула на фоне лечения, в связи с чем это может вызвать трудности в диагностике желудочно-кишечных кровотечений в послеоперационном периоде, когда имеется послеоперационная анемия, изменения гемодинамики после кардиохирургического вмешательства, назначены анальгетики для борьбы с послеоперационной болью, удален назогастральный зонд. Тем не менее, существует целесообразность назначения этого препарата при возобновлении энтерального питания у больных в случае назначения в послеоперационном периоде кардиотонических средств (адреномиметиков), поскольку эта группа пациентов имеет повышенный риск формирования гастродуоденальных эрозий даже при эффективном использовании антисекреторных препаратов с достижением целевых значений pH желудочного содержимого 4,0 [8].
Таким образом, в нашей работе проиллюстрирована целесообразность добавления висмута трикалия дицитрата в схемы лечения пациентов с эрозивно-язвенными изменениями гастродуоденальной зоны. Применение Де-Нола позволяет сократить сроки заживления эрозивных изменений слизистой оболочки, время предоперационной подготовки больных и является экономически обоснованным. Полученные результаты, вероятно, определяются противовоспалительным, вяжущим, обволакивающим эффектами препарата, а также его бактерицидным действием в отношении H. pylori. Цитопротективные и пленкообразующие свойства препарата реализуются особенно эффективно у больных с сердечно-сосудистыми заболеваниями, поскольку в генезе формирования эрозий гастродуоденальной зоны у них, наряду с влиянием инфекционного фактора, приема нестероидных противовоспалительных препаратов, имеет значение гипоксия, обусловленная сердечной недостаточностью, атеросклеротическим поражением сосудов, кровоснабжающих верхний отдел желудочно-кишечного тракта. Сокращение сроков эпителизации гастродуоденальных эрозий особенно значимо в отношении пациентов с высоким функциональным классом стенокардии, тяжелой сердечной недостаточностью, когда выполнение операции на сердце в более отдаленные сроки может отрицательно повлиять на прогноз для жизни пациента, амбулаторное лечение эрозий на этапе предоперационной подготовки увеличивает сердечно-сосудистый риск для больного. Сокращение сроков пребывания в стационаре также является значимым фактором, увеличивающим доступность кардиохирургической помощи и ее фармакоэкономическую эффективность.
Выводы
Использование висмута трикалия дицитрата для лечения эрозий гастродуоденальной зоны у кардиохирургических пациентов клинически эффективно, что выражается в увеличении частоты их заживления, сокращении сроков проведения контрольной эзофагогастродуоденоскопии с 14-го до 10-го дня у 90% больных, уменьшении сроков подготовки к операции на сердце. Фармакоэкономически обосновано использование ИПП, ЭТ первой линии и висмута трикалия дицитрата у данной категории больных с проведением контрольного эндоскопического исследования на 10-й день от начала терапии.
Литература
- Ивашкин В. Т., Исаков В. А. Основные положения II Маастрихтского соглашения: какие рекомендации по лечению заболеваний, ассоциированных с Helicobacter pylori, нужны в России? // Рос. журн. гастроэнтеол., гепатол., колопроктол. 2001. Т. 11. № 3. С. 77–84.
- Соколова Г. Н., Потапова В. Б., Комаров Б. Д. Прогнозирование заживления язв желудка // Эксп. и клин. гастроэнтерол. 2003. № 5. С. 173.
- Yang K. C., Wang G. M., Chen J. H., Lee S. C. Comparison of rabeprasole — based four- and seven — day triple therapy and omeprazole — based seven — day triple therapy for Helicobacter pylori infection in patients with peptic ulcer // J. Formos. Med. Assoc. 2003. Vol. 102. № 12. P. 857–862.
- Исаков В. А. Фармакогеномика и антихеликобактерная терапия // Эксп. и клин. гастроэнтерол. 2004. № 1 А. С. 61–68.
- Стандарты диагностики и лечения кислотозависимых и ассоциированных с Helicobacter pylori заболеваний (четвертое Московское соглашение): Методические рекомендации № 37 Департамента здравоохранения города Москвы. М.: ЦНИИГ, 2010. 12 с.
- Ивашкин В. Т., Маев И. В., Лапина Т. Л., Шептулин А. А. Рекомендации Российской Гастроэнтерологической Ассоциации по диагностике и лечению инфекции Helicobacter pylori у взрослых // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2012. № 1. С. 87–89.
- Авксентьева М. В. Клинико-экономический анализ. М.: Ньюдиамед, 2008. 778 с.
- Сорокина Е. А., Фокин А. А., Ахмедов В. А. и соавт. Значение рН и тканевой гипоксии в формировании изменений слизистой оболочки желудка и двенадцатиперстной кишки при проведении оперативных вмешательств в условиях искусственного кровообращения // Экспериментальная и клиническая гастроэнтерология. 2012. № 5. С. 14–21.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru





