Введение
Повышение уровня холестерина липопротеинов низкой плотности (ХС-ЛНП) — самый важный модифицируемый фактор риска коронарной болезни сердца и ее осложнений — внезапной смерти, инфаркта миокарда, ишемического инсульта [1–4]. Ингибиторы ГМГ-КоА-редуктазы (статины) — основной класс лекарственных средств, доказавших высокую эффективность в снижении уровня атерогенных липопротеинов в многочисленных рандомизированных исследованиях [5–8], метаанализах [9–11], в т. ч. при их комбинации с эзетимибом [12], ингибиторами проконвертазы PCSK9 [13–14] и этиловым эфиром эйкозапентаеновой кислоты [15]. Результаты рандомизированных исследований с применением статинов позволили подтвердить известную концепцию: чем ниже уровень атерогенных липидов, тем лучше, а также обосновать снижение уровня ХС-ЛНП до целевых значений не более 1,0 ммоль/л и снижение ХС-ЛНП более чем на 50% для групп экстремального сердечно-сосудистого (СС) риска [3, 4]. Ретроспективные анализы завершенных исследований и международные консенсусы продемонстрировали безопасность статинов и комбинированной липидснижающей терапии [16, 17].
Однако исследование CEPHEUS, проведенное в Восточной Европе, показало, что только у 9,8%, пациентов, получавших статины, удалось снизить содержание ХС-ЛНП до 1,8 ммоль/л и ниже [18]. Схожие результаты (достижение уровня ХС-ЛНП <1,8 ммоль/л лишь у 12% больных) были получены в исследовании DYSIS-I, в котором принимали участие российские пациенты [19].
Настоящая статья посвящена обсуждению клинического наблюдения пациентки из группы очень высокого СС-риска с первичной полигенной гиперхолестеринемией IIа типа и мультифокальным атеросклерозом, которая получает гиполипидемическую терапию (оригинальный розувастатин 20–40 мг/сут в монотерапии и в комбинации с эзетимибом 10 мг/сут) длительное время (16 лет).
Клиническое наблюдение
Пациентка Д., 73 года, пенсионерка. Диагноз: ишемическая болезнь сердца (ИБС). Атеросклероз аорты, коронарных сосудов, сонных артерий и артерий нижних конечностей. Первичная полигенная гиперхолестеринемия IIа типа. Варикозная болезнь нижних конечностей. Тромбофлебит нижних конечностей вне обострения. Язвенная болезнь двенадцатиперстной кишки в стадии ремиссии. Нейросенсорная тугоухость II степени. Состояние после ангиопластики со стентированием левой общей сонной артерии (ОСА), проведенным в 2013 г. Артериальная гипертония I стадии, 1-й степени, риск 4 (очень высокий).
Впервые за консультацией кардиолога/липидолога пациентка обратилась в декабре 2004 г. (15,5 года назад). На тот момент она предъявляла жалобы на ощущение дискомфорта в грудной клетке продолжительностью 2–3 мин («щемит сердце») при эмоциональной и физической нагрузке с иррадиацией в правую кисть, возникающее 2–3 раза в неделю, а также приступы головокружений и снижение слуха.
Впервые боль за грудиной возникла в 2002 г. (в 55 лет). В анамнезе уровень общего ХС максимально повышался до 13 ммоль/л (со слов пациентки). С 2003 г. начала принимать симвастатин по 10–20 мг/сут, но на момент первичной консультации (декабрь 2004 г.) статины не получала, т. к. считала, что они не помогают. В мае 2004 г. после работы на даче внезапно на фоне полного здоровья появились онемение в правой руке (длительностью 15 мин), головная боль. К врачам не обращалась. Физическая активность низкая. Диету систематически не соблюдает. Работа в офисе, сидячая. Менопауза с 2003 г. Никогда не курила.
Семейный анамнез отягощен: мать в 60 лет перенесла острое нарушение мозгового кровообращения (ОНМК), у отца дебют ИБС наступил до 50 лет, умер от инфаркта миокарда в 74 года, брат в 56 лет перенес ОНМК.
По данным исходного анализа крови (2 нед. без статинов, декабрь 2004 г.): аланинаминотрансфераза (АлАТ), аспартатаминотрансфераза (АсАТ), креатинфосфокиназа (КФК), глюкоза, лактатдегидрогеназа (ЛДГ), щелочная фосфатаза, γ-глютамилтранспептидаза, мочевина, креатинин, билирубин, натрий, калий — в норме, общий ХС 9,1 ммоль/л, триглицериды 1,81 ммоль/л, ХС липопротеинов высокой плотности (ЛВП) 1,35 ммоль/л, ХС-ЛНП 6,93 ммоль/л. Уровень фибриногена повышен до 3,9 г/л. По результатам консультации был поставлен диагноз наследственной гиперлипопротеинемии (ГЛП) IIа типа и назначена начальная доза аторвастатина 20 мг/сут.
В феврале 2005 г. прошла амбулаторное обследование в ФГБУ «НМИЦ кардиологии» Минздрава России. При дуплексном сканировании были выявлены множественные стенозы в сонных артериях с максимальным стенозом 75% в области левой ОСА и множественные стенозы в сосудах нижних конечностей с максимальным стенозированием 40% в левой подколенной артерии. По результатам велоэргометрии (ВЭМ) на высоте нагрузки и в покое было зарегистрировано снижение сегмента ST в отведениях V4–V6 до 1,5 мм горизонтального характера. Проба была расценена как положительная, толерантность к физической нагрузке средняя. При суточном мониторировании электрокардиографии (ЭКГ) были зарегистрированы желудочковые экстрасистолы (2091) и 22 эпизода депрессии ST на 1 мм общей продолжительностью 3 мин (по дневнику при нагрузке). При эхокардиографии (ЭхоКГ), ЭКГ и суточном мониторировании артериального давления (АД) существенных отклонений от нормы не выявлено за исключением уплотнения стенок аорты. Были назначены ацетилсалициловая кислота 100 мг/сут, изосорбида динитрат 60 мг/сут для профилактики ангинозных болей, аторвастатин 20 мг/сут, рекомендовано продолжить лечение бетагистином 8 мг/сут и прийти на повторную консультацию через 6 мес. Также была рекомендована консультация ангиохирурга для определения показаний к хирургическому лечению стеноза левой сонной артерии. От оперативного лечения атеросклероза сонных артерий пациентка длительное время категорически отказывалась, было принято решение о медикаментозной терапии.
Результаты объективного осмотра (2005 г.): тоны сердца ритмичные, патологических шумов нет. Ритм правильный с частотой сердечных сокращений (ЧСС) 64 в минуту. АД 98/60 мм рт. ст. Дыхание везикулярное, хрипов нет. Печень по краю реберной дуги. Симптом поколачивания по поясничной области отрицательный. Пульсация на периферических артериях удовлетворительная. Ксантом, ксантелазм, утолщения ахилловых сухожилий, липоидной дуги роговицы не выявлено.
В 2010 г. в ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» Минздрава России пациентке проведена мультиспиральная компьютерная томография (МСКТ) с контрастированием. Это эффективный неинвазивный скрининговый метод исследования коронарного русла (особенно у асимптомных пациентов), который широко используется в отечественной [20] и зарубежной клинической практике и включен в международные рекомендации по диагностике и лечению нарушений липидного обмена [3, 4]. Заключение: коронарный кальций (эквивалент Agatson Score) 40,6 ед. КТ-картина атеросклероза и кальциноза аорты и коронарных артерий. Стеноз передней межжелудочковой нисходящей артерии (ПНА) 40%. Фракция выброса 70%. Толщина межжелудочковой перегородки в диастолу 8 мм, толщина задней стенки левого желудочка в диастолу 7 мм. Правый тип кровоснабжения миокарда. Нарушений сократимости миокарда левого желудочка не выявлено.
Повторная МСКТ проведена в 2012 г. в ФГБУ «НМИЦ кардиологии» Минздрава России. Заключение: стеноз ПНА 50% на границе проксимальной и средней трети, кальцинированная бляшка. Комментарии: гемодинамически значимых стенозов не выявлено. По сравнению с данными МСКТ от 2010 г. динамики не отмечено.
За 15 лет наблюдения (в 2004, 2006, 2007, 2008, 2010, 2012 и 2020 гг.) пациентке был проведен ряд нагрузочных тестов (тредмил-тест) для неинвазивной оценки выраженности ишемии миокарда и толерантности к физической нагрузке. Как указано выше, исходно (в 2004 г.) на высоте нагрузки было выявлено снижение сегмента ST в отведениях V4–V6 до 1,5 мм горизонтального характера. Проба была расценена как положительная, толерантность к нагрузке средняя. Повторные тесты 2006–2008 гг. были положительными, а в 2010 г. впервые тест с нагрузкой показал отрицательный результат (отсутствие ишемии). Заключение по результатам тредмил-теста в 2010 г.: проба на наличие транзиторной ишемии миокарда отрицательная. Толерантность к нагрузке высокая. Реакция АД адекватная. Прекращение нагрузки по достижении субмаксимальной ЧСС (140 в минуту). Расчетное значение MET (метаболический эквивалент) 10,5. В марте 2020 г. проведена стресс-ЭхоКГ, по результатам которой также не было выявлено признаков ишемии. Заключение: проба на выявление скрытой коронарной недостаточности отрицательная. Исходно и на максимуме нагрузки зон нарушения локальной сократимости левого желудочка не отмечено. Толерантность к физической нагрузке средняя. Реакция АД на нагрузку по гипертоническому типу. На максимуме нагрузки пациентка жалоб не предъявляла.
В январе 2013 г. в нейрохирургическом отделении ФГБНУ НЦН выполнена операция на сонных артериях: транслюминальная баллонная ангиопластика со стентированием левой внутренней сонной артерии. Послеоперационный период протекал без осложнений. Данные контрольного дуплексного сканирования сосудов магистральных артерий головы: стент равномерно и адекватно расправлен. После операции около полугода беспокоили пульсирующие боли в височной области. В течение года принимала клопидогрел 75 мг, который с февраля 2014 г. принимать перестала в связи с появлением гематом разной локализации. В ноябре 2014 г. при обследовании в ФГБУ «НМИЦ кардиологии» Минздрава России при проведении ВЭМ проба положительная, на высоте нагрузки зарегистрировано горизонтальное снижение сегмента ST до 1,5 мм в отведениях V5–V6, толерантность к нагрузке средняя. Было решено провести коронароангиографию. Заключение: ствол левой коронарной артерии имеет неровности контуров, в среднем сегменте определяется выраженный изгиб. Первая и вторая диагональные артерии с неровностями контуров. В устье интермедиарной ветви стеноз 50%. В огибающей артерии, первой артерии тупого края, правой коронарной артерии — неровности контуров. Показания к хирургическому лечению ИБС отсутствовали, и было решено продолжить консервативное лечение.
В течение всего периода амбулаторного наблюдения пациентка непрерывно получала лечение симва-, аторва- или розувастатином в качестве монотерапии или, больший период времени, комбинацию статина с эзетимибом 10 мг/сут (с 2013 г. по настоящее время принимает оригинальный розувастатин 40 мг/сут в комбинации с эзетимибом).
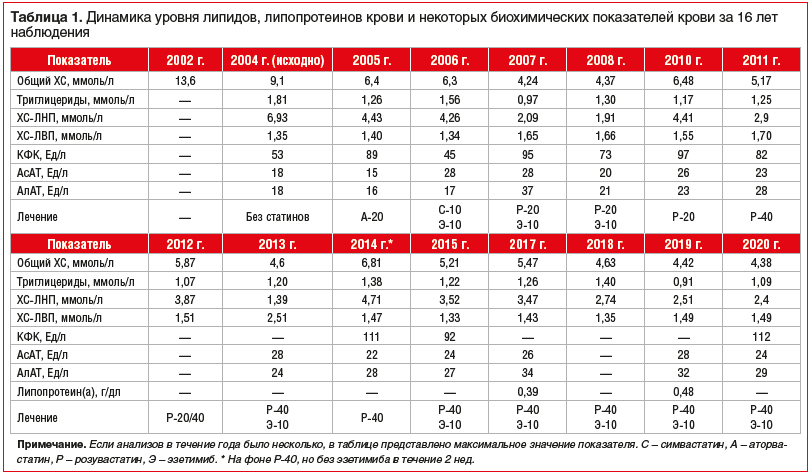
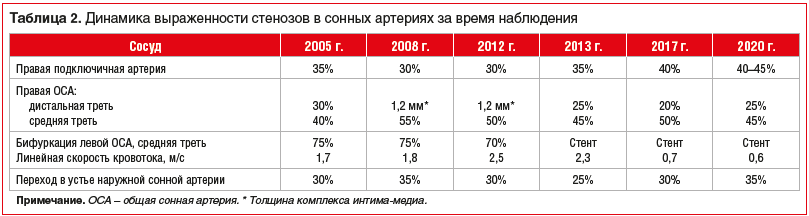
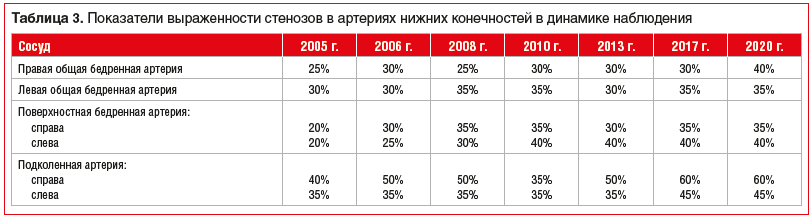
Пациентка наблюдалась и продолжает наблюдаться амбулаторно в ФГБУ «НМИЦ кардиологии» Минздрава России и ФГБОУ ДПО РМАНПО Минздрава России в течение последних 16 лет. В табл. 1–3 представлены данные исследований липидного профиля и некоторых биохимических параметров в динамике наблюдения (за исключением 2009 и 2016 гг.), а также результаты тестов дуплексного сканирования сонных артерий и артерий нижних конечностей. Все ультразвуковые исследования выполнялись на ультразвуковых системах экспертного класса линейными датчиками с частотой от 9 до 17 МГц (большая часть исследований выполнена на аппарате iU-22, Philips, одним экспертом).
Обсуждение
В течение всего периода наблюдения пациентка была высококомплаентна, перерывов в приеме статинов практически не было.
Повышение уровня ХС-ЛНП — самый сильный независимый фактор риска развития атеросклероза [1–4]. У пациентки в анамнезе имело место повышение уровня общего ХС до 13 ммоль/л, что характерно для семейной (наследственной) ГЛП IIa типа. С учетом отягощенного семейного анамнеза, исходного уровня ХС-ЛНП 6,93 ммоль/л диагноз «семейная (наследственная) ГЛП» вполне вероятен, поскольку оценка по алгоритму Dutch Lipid Clinic Network Score составила 8 баллов (вероятная семейная ГЛП) [3]. Так как ДНК-диагностика на предмет семейной гетерозиготной ГЛП не проводилась и при осмотре не выявлено утолщений ахилловых сухожилий, ксантоматоза и липоидной дуги роговицы, было принято решение поставить диагноз первичной полигенной гиперхолестеринемии IIa типа. Полигенная форма семейной ГЛП фенотипически может не отличаться от моногенных форм [21, 22], и такая диагностическая тактика более оправданна, если нет данных за моногенную семейную гиперхолестеринемию [23].
С 2004 г. опубликовано четыре пересмотра Европейских рекомендаций по диагностике и лечению дислипидемий, включая последнюю версию 2019 г. [3]. В этом документе в категорию «очень высокий СС-риск» введено дополнение: наличие бляшек в сонных артериях и артериях нижних конечностей по данным ультразвукового исследования и диагноз «семейная гиперхолестеринемия». Для этой категории больных установлены целевые уровни ХС-ЛНП не более 1,4 ммоль/л и снижение уровня ХС-ЛНП более чем на 50% от исходных значений [3]. Содержание ХС-ЛНП за весь период наблюдения с учетом и низких (1,39 ммоль/л в 2013 г. после операции стентирования), и высоких (4,41 ммоль/л в 2010 г.) значений в среднем составило 3,14 ммоль/л, среднее снижение уровня ХС-ЛНП — 55% от исходного значения 6,93 ммоль/л. В последние годы на комбинированной терапии оригинальным розувастатином 40 мг/сут и эзетимибом был достигнут уровень ХС-ЛНП в пределах 2,4–2,74 ммоль/л, что выше существующих целевых значений для лиц очень высокого СС-риска [3]. Из дополнительных факторов риска у этой пациентки в два раза был повышен уровень липопротеина(а), что является независимым фактором атеросклероза, особенно у больных с наследственной дислипидемией [3, 24]. Наряду с повышением уровня триглицеридов высокое содержание липопротеина(а) — один из основных резидуальных факторов риска при терапии статинами [24]. При повышении уровня липопротеина(а) контроль гиперхолестеринемии должен быть еще более жестким, по принципу: чем меньше уровень ЛНП, тем лучше [3].
Ведение пациентки в течение длительного времени (2004–2013 гг.) было осложнено ее отказом (из-за боязни осложнений операции и смерти) от коронароангиографии и оперативного лечения выраженного стеноза. В декабре 2012 г. из-за значительного увеличения линейной скорости кровотока с 1,8 до 2,5 м/с в области стеноза 75% в бифуркации левой ОСА, по совокупности клинических данных консилиумом врачей было принято решение о необходимости стентирования сонной артерии в области стеноза 75%.
На первичной консультации в декабре 2004 г. больная предъявляла жалобы на редкие загрудинные боли, характерные для стенокардии напряжения, принимала нитраты, результаты серии тредмил-тестов в 2004–2008 гг. были положительными. В 2010 г. тредмил-тест показал субмаксимальную ЧСС 140 в минуту (10,5 MET) без болевых ощущений. Два исследования МСКТ коронарных артерий в 2010 и 2012 гг., а также коронароангиография выявили наличие одного стеноза в интермедиарной артерии и неровности контуров в других коронарных артериях. Особенность этого клинического наблюдения заключается в том, что ретроспективно удалось проанализировать ультразвуковую динамику стенозов в сонных и периферических артериях (исследования выполнялись одним и тем же исследователем на одном и том же оборудовании; см. табл. 2 и 3). С учетом того, что критерием прогрессии/регрессии атеросклеротических поражений считается изменение диаметра стеноза ±15% от исходных значений, можно с высокой долей уверенности говорить о том, что за 16 лет наблюдения длительная и интенсивная (в последние 8–10 лет) гиполипидемическая терапия позволила замедлить прогрессирование атеросклероза в трех сосудистых бассейнах — сонных, коронарных и периферических артериях.
Выявленное на первичной консультации значительное повышение уровня ХС-ЛНП (6,93 ммоль/л) — основной и, пожалуй, единственный значительный модифицируемый фактор риска развития атеросклероза. За 16 лет уровень АД был в пределах нормы, отсутствуют такие факторы СС-риска, как сахарный диабет, курение, ожирение (индекс массы тела в течение 16 лет находился в диапазоне 24,4–25,3 кг/м2). К мягким реклассификаторам СС-риска можно отнести менопаузу [4] и повышенное содержание липопротеина(а) [3, 24]. Влияние длительной интенсивной терапии статинами на состояние атеросклероза в сонных и коронарных артериях хорошо изучено в различных «регрессионных» исследованиях с проведением мониторирования толщины комплекса интима-медиа [25, 26], повторной количественной коронароангиографии [27], внутрисосудистого ультразвукового исследования [28–32], магнитно-резонансной томографии [33], а также оптической когерентной томографии [34–38]. В частности, ряд исследований показал, что за 24 мес. интенсивной терапии статинами (аторвастатин 80 мг/сут, розувастатин 40 мг/сут или в комбинации с i-PCSK9) возможно добиться замедления прогрессирования каротидного [26, 33] и коронарного [28–32] атеросклероза. Механизмы замедления прогрессии атеромы при интенсивном лечении статинами или использовании комбинированной терапии хорошо изучены и включают делипидирование бляшек, их последующую кальцификацию, снижение активности воспаления, количества макрофагов, уменьшение концентрации цитокинов, интерлейкинов 1 и 6, снижение уровня высокочувствительного С-реактивного белка [35–37].
В исследовании ASTEROID через 24 мес. лечения розувастатином 40 мг/сут у большинства (78%) пациентов удалось нормализовать общий объем бляшек и объем бляшек в наиболее пораженных сегментах, среднее снижение ХС-ЛНП составило 53% [29]. В другом исследовании, SATURN, по изучению возможности замедления прогрессии коронарного атеросклероза розувастатин в дозе 40 мг/сут имел преимущество перед аторвастатином 80 мг/сут по процентному изменению общего объема атеромы [30]. Согласно данным [34] всего за 13 мес. лечения розувастатином 40 мг/сут у 83 пациентов после инфаркта миокарда удалось добиться достоверного увеличения толщины покрышки атеромы в неинфарктных артериях с 64,9 до 87,9 мкм (p=0,008) и уменьшить крутизну арки макрофагов (уменьшение интенсивности воспаления) с 9,6° до 6,4° (p<0,0001) [34]. Согласно недавно полученным данным высокие дозы розувастатина способствуют повышению оттока ХС из периферических тканей в печень через белок ATP-binding cassette A1 (ABCA1; АТФ-связывающий кассетный транспортер А1) независимо от снижения уровня липидов [39]. Как уже указано, у больных с ишемическим инсультом / транзиторной ишемической атакой в анамнезе и в подгруппе больных с каротидным атеросклерозом интенсивная терапия аторвастатином 80 мг/сут хорошо переносилась и позволила улучшить прогноз (исследование SPARCL [6]).
За весь период наблюдения не было отмечено ни одного эпизода плохой переносимости или клинически значимых отклонений от нормы лабораторных показателей (АсАТ, АлАТ, КФК, билирубина, глюкозы; см. табл. 1). Два международных консенсуса по безопасности статинов свидетельствуют об их хорошей переносимости и безопасности по всему диапазону зарегистрированных доз со стороны нервной системы, печени, почек, мышц, глаз и др. [16, 17]. Вместе с тем розувастатин имеет преимущество в снижении уровня ХС-ЛНП (анализ базы данных исследования VOYAGER) и лучший профиль безопасности в сравнении с другими статинами (особенно по сравнению с аторвастатином) в начальных и высоких дозах [40–43]. С учетом хорошей текущей переносимости комбинированной гиполипидемической терапии пациентка сдавала анализы на липиды и показатели безопасности 1 раз в год, как и указано в Рекомендациях EAS/EAS 2019 [3].
Из сопутствующих заболеваний у пациентки отмечены: многолетняя язва двенадцатиперстной кишки в стадии ремиссии, нейросенсорная тугоухость, остеохондроз шейно-грудного отдела позвоночника, а также варикозная болезнь вен нижних конечностей. В течение длительного времени пациентка курсами принимала троксерутин, омепразол, 2–3 раза в год капельницы с цитиколином натрия и этилметилгидроксипиридина сукцинатом — с хорошим эффектом и переносимостью.
На момент консультации в марте 2020 г. пациентка чувствовала себя удовлетворительно. Остаются жалобы на головокружение, снижение слуха и онемение рук, больше в ночное время. АД по дневнику самоконтроля — 105/55 мм рт. ст., но в последнее время бывает повышение АД до 135/65 мм рт. ст. и 145/75 мм рт. ст. Степень физической активности высокая — 8–12 тыс. шагов 4–5 раз в неделю. Продолжает терапию оригинальным розувастатином в комбинации с эзетимибом 10 мг/сут, ацетилсалициловой кислотой 100 мг, к лечению рекомендовано добавить метопролола сукцинат 50 мг под контролем АД и пульса. По данным очередной ультразвуковой допплерографии сонных и периферических артерий по сравнению с тестами 2017 г. прогрессии атеросклероза не отмечено. Результат стресс-ЭхоКГ на предмет ишемии миокарда отрицательный. Рекомендовано продолжить текущую терапию и чаще контролировать АД в домашних условиях.
Основным результатом длительного наблюдения и лечения пациентки можно считать отсутствие серьезных осложнений (инфарктов, внеплановых госпитализаций, транзиторной ишемической атаки и инсультов, за исключением плановой операции стентирования левой ОСА в 2013 г., показания к которой имелись с 2004 г.). За весь период наблюдения удалось замедлить прогрессирование атеросклероза в трех сосудистых бассейнах, избежать прогрессирования стенокардии. Значительно улучшилось качество жизни, расширился режим физической активности (скандинавская ходьба и бассейн). Из текущих проблем в 2020 г. предстоит уточнение диагноза, обследование и подбор терапии по поводу частых эпизодов повышения АД.
Заключение
Несмотря на достижения современной кардиологии и липидологии, расширение диагностических и лечебных возможностей ведения пациентов очень высокого СС-риска во всем мире, и в частности в России, в клинической практике не удается полностью соответствовать рекомендациям международных организаций [3, 4], в т. ч. в части достижения целевого уровня липидов [19, 20, 44–48]. За последнее десятилетие было завершено много клинических исследований комбинированной терапии (статины + эзетимиб, i-PCSK9, омега-3 полиненасыщенные жирные кислоты), в которых показана возможность дальнейшего снижения СС-риска при достижении пороговых значений ХС-ЛНП в 0,5–0,7 ммоль/л [12–15].
В рамках представленного клинического наблюдения мы постарались обсудить важные вопросы повседневной рутинной клинической практики, касающиеся диагностики и долговременной интенсивной липидснижающей терапии у пациентов с первичной (наследственной) дислипидемией, роли неинвазивных методов исследования сосудов у таких больных, замедления/регрессии стабильной стенокардии напряжения при терапии статинами, возможных механизмов стабилизации/регрессии атеросклероза, а также использования современных международных рекомендаций при лечении конкретного пациента. Оптимизация терапии статинами в нашей стране — не только насущная необходимость, но и, пожалуй, единственная возможность значительно снизить смертность от сердечно-сосудистых заболеваний в самое ближайшее время.
.
Информация с rmj.ru